西瓜根际促生菌筛选及生物育苗基质研制*
张 杨王甜甜孙玉涵胡官墨李 荣†俞 萍沈其荣
(1 南京农业大学资源与环境科学学院/国家有机肥类肥料工程技术研究中心/江苏省固体有机废弃物资源化高技术研究重点实验室/
江苏省有机固体废弃物资源化协同创新中心,南京 210095)
(2 南京秦邦吉品农业开发有限公司,南京 211516)
西瓜根际促生菌筛选及生物育苗基质研制*
张 杨1王甜甜1孙玉涵1胡官墨1李 荣1†俞 萍2沈其荣1
(1 南京农业大学资源与环境科学学院/国家有机肥类肥料工程技术研究中心/江苏省固体有机废弃物资源化高技术研究重点实验室/
江苏省有机固体废弃物资源化协同创新中心,南京 210095)
(2 南京秦邦吉品农业开发有限公司,南京 211516)
通过从西瓜根际分离筛选具根际定殖能力的植物根际促生菌,将其保活添加至普通育苗基质研制生物育苗基质,以确保功能菌株能够在苗期定殖根际,进而在移栽后发挥促生功能。结果表明,分离获得一株同时具有产吲哚乙酸(IAA)和NH3,且对尖孢镰刀菌和茄科劳尔氏菌均有拮抗作用的植物根际促生菌(PGPR)菌株N23;在三季育苗试验中,与普通基质处理(CK)相比,添加菌株N23的生物育苗基质所育种苗,在多项苗期生长指标上均表现出稳定的促生作用;盆栽试验表明,除叶绿素相对含量测量值(SPAD)外,生物基质所育西瓜种苗的其他检测指标均显著高于对照(普通育苗基质所育种苗,下同);田间试验表明,生物基质所育种苗西瓜、黄瓜、辣椒和番茄种苗移苗后,在苗期植株株高和茎粗均显著优于对照,在产量上均增产10% 以上。结合形态、生理生化特征和16S rDNA基因序列分析,初步鉴定菌株N23为芽孢杆菌属细菌(Bacillus sp.)。综上,利用芽孢杆菌N23研制的生物育苗基质能够有效促进所育不同作物种苗质量,增强移栽后作物的生长和田间产量。因此,本研究能够为根际有益微生物的应用提供新的思路,为生物育苗基质的研制提供理论支撑。
根际有益促生菌;生物基质;育苗;促生;芽孢杆菌
植物根际微生物由于受根系生长及其分泌物的影响,其数量和种群结构显著不同于非根际土壤,构成了根际特有的微生物区系[1]。植物根际促生菌(plant growth-promoting rhizobacteria,PGPR)是指生存于植物根际或根表,可以通过直接或间接的方式促进或调节植物生长并能防治病害的一类有益微生物[2-6]。随着研究的深入,康贻军等[7]提出,细菌成为PGPR的先决条件是接种后的菌株能在根际土壤微生物群体中表现出相当的竞争力。张小兰等[8]的研究也指出,溶磷菌的筛选不仅要考虑其溶磷能力,还有必要基于菌株在植物根际的定殖能力。可见,PGPR在根际土壤中是否有良好的定殖和竞争能力对其发挥应有的生物功能至关重要。因此,分离获得具有高效定殖能力的PGPR菌株,并开发出其最优的施用模式对现代生态农业和有机农业的发展具有重要意义[9]。
随着我国蔬菜产业的发展,工厂化育苗因有出苗整齐,成活率高,省工省力等优点而越来越受到人们的重视[10],从而加速了固体栽培基质的开发研究。然而,传统的育苗基质(草炭、珍珠岩等)的配方因草炭的来源有限,大大制约着穴盘育苗应用的推广。国外工厂化育苗发展较早,技术较为成熟,进口基质保水性能及营养成分明显优于国产泥炭基质[11],因此,提升国内育苗基质的整体水平尤为迫切。
本研究将PGPR菌株与普通育苗基质相结合,预计能够有效促进PGPR菌株在作物苗期的根际定殖,从而保障其促生功能的发挥,增强所育种苗的质量,提高移植后作物的产量。研究结果预计能够为PGPR菌株的高效应用提供新的思路,也为现代高效农业的发展提供理论依据。
1 材料与方法
1.1 试验材料
用于菌株分离的植株样品采至南京市蔬菜花卉科学研究所南京市江宁区横溪镇南京现代园艺科技示范园;供试西瓜品种为“早佳8424”;黄瓜品种为“津优1号”;辣椒品种为“红巨椒”; 番茄品种为“红粉佳人”。供试普通育苗基质由淮安柴米河基质肥料公司提供:总氮13.4 g kg-1,有机质227.8 g kg-1,含水量≤50%,pH 6.96,电导率(EC)1.94 mS cm-1。
1.2 根际及内生菌的初步筛选
参照张杨等[12]的方法。
1.3 菌株产吲哚乙酸(IAA)和产NH3能力的测定
菌株产IAA能力参照Glickmann和Dessaux[13]的方法测定。
菌株产NH3能力的测定:分别将待测菌株接种于蛋白胨氨化培养基中,30℃培养24 h。以不接种的蛋白胨氨化培养基作对照。在培养液中加入3~5滴纳氏试剂,出现黄色或棕红色沉淀则为正反应。未接种的培养基加入纳氏试剂后无黄色或棕红色沉淀出现[3,14]。
1.4 菌株拮抗能力的测定
采用平板对峙培养法,分别筛选对尖孢镰刀真菌西瓜专化型(Fusarium oxysporum f. sp. niveum,FON)和茄科劳尔氏菌(Ralstonia solanacearum,RS)有拮抗功能的菌株。将尖孢镰刀菌(FON)接种至PDB(Potato dextrose broth马铃薯牛肉汤培养基)上[15],28℃ 下培养7 d,用直径为5 mm的打孔器在菌落边缘取菌块,放置于新的 PDB 平板中央;并在其周围3 cm处点接被筛选菌株,每处理4次重复,然后放入28℃ 恒温箱中培养,3 d后,检查有无抑制作用,并测量抑菌圈的大小(取4次重复的平均值)。将被筛选菌株点接于NA (Nutrient agar营养琼脂)培养基上,黑暗中恒温30℃培养12 h;将茄科劳尔氏菌(RS)接种于NA液体培养基中,30℃,170 r min-1震荡18 h,制成对数期的菌悬液(OD600=1.0),将菌悬液倒入无菌的喷瓶中,并将菌液均匀适量地喷至被筛选菌株的NA平板上。每处理设3次重复,然后放入30℃恒温箱中黑暗培养,1 d 后,检查有无抑制作用,并测量抑菌圈的大小(取3次重复的平均值)。
1.5 生物育苗基质的研制
将菌株接种至PDB培养基中发酵生产,条件为:pH 7.0,温度30℃,170 r min-1震荡,发酵中后期形成芽孢,发酵时间为48 h。将各菌株的50 ml发酵液添加至1 kg普通育苗基质中,混合均匀。
1.6 穴盘育苗试验
1.6.1 生物基质对西瓜的育苗效果 本试验于2013年7月—10月在南京农业大学温室内进行。将西瓜种子消毒浸种催芽,露白后埋入基质中,每处理8个重复。育苗试验设计如下:处理为含5%(体积质量比,下同)N23菌株发酵液的育苗生物基质;对照1为添加等量清水的普通育苗基质(CK1);对照2为添加等体积未接菌的PDB培养基育苗基质(CK2)。30 d后取植株样品,分别测定株高、茎粗、叶绿素相对含量测量值(SPAD)和叶面积。育苗试验进行3次,分别为育苗试验1~试验3。
1.6.2 生物基质对其他作物育苗效果 本试验于2014年7月―8月在淮安柴米河基质肥料公司科技示范园内进行。分别将黄瓜、辣椒和番茄种子浸种催芽,露白后埋于基质中,每种作物均设两个处理:1)使用普通育苗基质育苗(CK);2)使用添加功能菌株N23发酵液的生物基质育苗(N23),每处理设置3个重复(每重复采用72孔苗盘育苗72棵)。30 d后取植株样品,分别测定株高、茎粗以及地上部鲜重和干重。
1.7 盆栽试验
将生物基质以及普通基质所育西瓜种苗分别于2014年6月—9月在温室内进行两季盆栽试验。共设2个处理:1)普通基质所育种苗(CK);2)含N23菌株发酵液的生物基质所育种苗。每处理6个重复,每盆钵装土2.5 kg,并添加15 g kg-1的普通鸡粪有机肥与土拌匀作为基肥,选取长势均一的种苗移栽,于40 d时测定各处理的株高、茎粗和SPAD值。
1.8 田间试验
1.8.1 西瓜实验 生物育苗基质所育西瓜种苗田间增产效果两季田间试验分别于 2014年8月—11月和2015年4月—7月在南京市蔬菜花卉科学研究所南京市江宁区横溪镇南京现代园艺科技示范园内进行。待种苗长势两叶一心时移栽至蔬菜大棚中进行田间实验,共设2个处理(同盆栽试验处理)。所有处理均施用普通鸡粪有机肥。有机肥施用量按7500 kg hm-2施用,基肥总氮(N)、磷(P2O5)和钾(K2O)养分分别为120 kg hm-2、90 kg hm-2和120 kg hm-2(不足之处用化肥补齐);在花期和果期进行两次追施化肥,两次追肥氮、磷(P2O5)和钾(K2O)养分分别为90 kg hm-2、60 kg hm-2和60 kg hm-2,90 kg hm-2、0 kg hm-2和60 kg hm-2。试验每个处理设3次重复,随机区组设计。每个小区面积为2 m×4 m,基肥于耕层混合均匀。每个小区移栽西瓜株数为10株。在西瓜移栽30 d时测定植株的株高和茎粗,移栽60 d开始测定各处理作物的产量,所采记产作物按统一规格采摘,且之后每隔一段时间计产一次,共计产3次。
1.8.2 其他作物实验 生物育苗基质所育其他作物种苗田间增产效果田间试验于2014年8月—11月在淮安柴米河基质肥料公司科技示范园内进行,将功能型基质和普通基质分别育黄瓜、辣椒和番茄种苗,待种苗长势两叶一心时移栽至蔬菜大棚中进行田间实验,共设2个处理(同1.6.2试验处理)。施肥计划一律按企业常规管理施用量施以化肥。移栽约30 d后分别测定黄瓜、辣椒和番茄植株的株高、茎粗。移栽60 d开始计处理作物的产量,所采记产作物按统一规格采摘,且之后每隔一段时间计产一次,共计产4次。
1.9 菌株的鉴定
以总 DNA 为模板,采用通用引物 27F/1492R[16]进行 16S r DNA 扩增。PCR 产物切胶回收后,委托美吉生物工程(上海)有限公司测序,测序结果在RDP数据库中进行比对,选取同源性较高的序列使用MEGA 4.1 软件构建系统发育树,采用1 000次重复取样进行 Bootstrap 检验,确定菌株的分类地位。
1.10 数据分析
使用Excel 2007程序和SPSS 19.0软件进行数据统计分析,使用最小显著差异法(LSD)进行多重比较(p<0.05),采用T检验法(Student’s t test)进行两个样本间的显著性差异比较。
2 结 果
2.1 初筛菌株的促生及拮抗性能
分离获得根际菌株(编号前为G)及内生菌株(编号前为N)共84株,选取其中6株能够产生IAA菌株,再进行产NH3及拮抗能力测定,6株菌分别命名为G36、G35、G8、G3、N23、N14。测定结果表明,G36、G35、G8和G3对尖孢镰刀菌及茄科劳尔氏菌均无拮抗作用,其中G36产NH3的能力大于G3,G35和G8无明显产NH3能力;N23和N14两株菌具有最高的产IAA和产NH3的能力,且对尖孢镰刀菌和茄科劳尔氏菌均有拮抗作用,由抑菌圈大小可以看出N23的拮抗效果显著强于N14,基于此,具有较强复合功能的菌株N23被选取进行进一步研究,如表1。
2.2 含菌株N23生物基质的穴盘育苗效果
在1.6.1生物基质对西瓜育苗效果的三次育苗试验的试验1和试验2中,相比于添加等量清水的普通育苗基质(CK1)及添加等体积未接菌液体PDB培养基育苗基质(CK2)所育种苗,添加菌株N23研制成的生物育苗基质对西瓜苗的生长有明显促生效果,除茎粗和SPAD值外,其他生长指标均显著高于CK1和CK2。在育苗试验3中,生物基质处理(N23)相比CK1和CK2,除叶面积和SPAD外,其他生长指标均显著高于对照,如表2。综上,添加功能菌发酵液的生物基质对西瓜种苗的生长有明显促生作用,同时,三次育苗试验结果表明,发酵液中培养基并未对本试验结果产生显著影响。
添加N23菌株生物育苗基质对黄瓜、辣椒和番茄幼苗均具有促生效果。生物育苗基质所育黄瓜种苗,除茎粗外,其他生长指标均显著优于CK;所育辣椒种苗,所有生长指标均显著优于CK;所育番茄种苗,所有生长指标均有显著差异,如表3。综上,添加菌株N23的生物育苗基质不仅对西瓜苗期生长有促进作用,对其他多种作物苗期生长均有促进作用。
2.3 含菌株N23生物基质的盆栽试验效果
两季盆栽试验结果一致,相比于使用普通育苗基质(CK)所育种苗,添加功能菌生物育苗基质所育种苗在移栽30 d后仍然有优异生长特性,除SPAD值外,其他生长指标均显著高于对照,如表4。

表1 初筛菌株的促生及拮抗性能Table 1 Plant growth-promoting and antagonistic characteristics of the strains of bacteria out of the first screening

图1 所分离菌株的功能特性Fig.1 Functions of the isolated bacteria

表2 以菌株N23为功能菌的生物基质对西瓜育苗效果Table 2 Effects of inoculation of nursery substance with Strain N23 on watermelon seedling growth
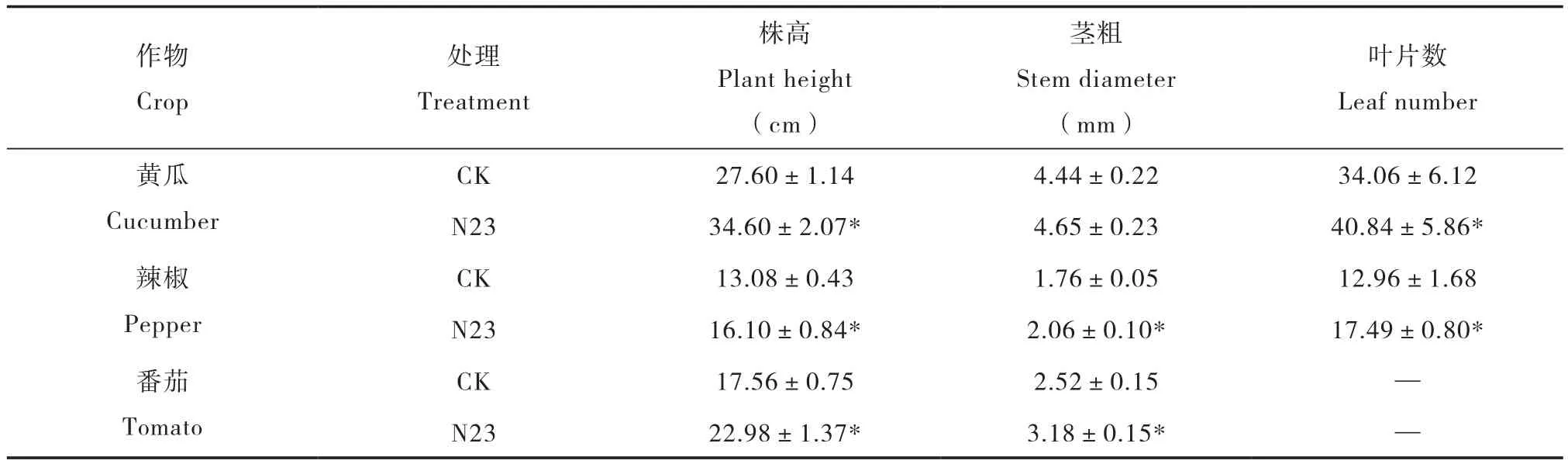
表3 以菌株N23为功能菌的生物基质对黄瓜、辣椒和番茄的育苗效果Table 3 Effects of inoculation of nursery substance with strain N23 on seedlings growth of different crops

表4 生物基质和普通基质所育西瓜种苗盆栽生长效果Table 4 Growth characters of watermelon seedlings transplanted from bio-nursery substrate and ordinary nursery substrate after transplanting in the pots
2.4 含菌株N23生物基质所育种苗的田间生长效果
相比于普通育苗基质所育种苗(CK),添加功能菌N23研制成的生物育苗基质所育种苗移栽后,两季西瓜田间结果株高和茎粗均显著优于对照。两季西瓜田间增产效果一致,第一季,生物基质所育种苗处理(N23)的产量较普通基质所育种苗处理(CK)增产约12.4%;第二季则增产约25.4%,如表5。
相比于普通育苗基质所育种苗(CK),添加功能菌研制成的生物育苗基质的处理(N23)所育番茄、辣椒和黄瓜三种作物的种苗移栽后,在作物株高和茎粗上能保持苗期生长优势(表6);在当季产量上,番茄产量为9 710 kg hm-2,辣椒产量为23 816 kg hm-2,黄瓜产量为31 283 kg hm-2,均显著高于普通育苗基质所育种苗产量,在番茄、辣椒和黄瓜上分别增产60%、25%和18%。

表5 生物基质和普通基质所育西瓜种苗田间生长效果Table 5 Growth characters of watermelon seedlings transplanted from bio-nursery substrate and ordinary nursery substrate after transplanting in the field

表6 生物基质和普通基质所育黄瓜、辣椒和番茄种苗田间生长效果Table 6 Growth of tomato,pepper and cucumber seedlings transplated from bio-nursery substrate and ordinary nursery substrate in the field
2.5 菌株N23鉴定为芽孢杆菌属细菌
菌株N23在LB(Luria-Bertani培养基)平板上的菌落呈乳白色,皱褶,边缘不整齐,具有一定的黏性,易挑起。革兰氏染色阳性,菌体着色均匀,呈杆状,两端钝平,呈不规则形状。淀粉水解反应、V.P反应(Voges-Proskauer reaction)、接触酶反应、利用柠檬酸盐反应、硝酸盐还原、石蕊牛奶还原胨化、甲基红反应以及明胶液化反应均呈阳性;D-果糖、麦芽糖、阿拉伯糖、木糖和乳糖利用均呈阳性;发酵葡萄糖产酸不产气,厌氧条件下不生长;7%NaCl培养条件下生长,能够产生芽孢。利用N23菌株的16S rDNA序列(登录号为KP403800)所构建发育树如图2所示,与死谷芽孢杆菌Bacillus vallismortis DSM11031T(AB021198)相似性在99%以上。结合菌株的形态特征、理化特征并结合16S rDNA序列分析,将菌株N23初步鉴定为芽孢杆菌属细菌。
3 讨 论
3.1 多功效PGPR的获得

图2 菌株N23的系统发育树Fig. 2 Phylogenetic tree of strain N23
本研究首先从西瓜植株根系筛选出6株产IAA优势菌株,进一步复筛出具有产NH3能力4株菌株G36、G3、N23和N14,最后通过对尖孢镰刀菌和茄科劳尔氏菌的拮抗测试获得具有复合功能的根际促生菌株N23。目前,已有大量关于植物根际促生菌(PGPR)促进植物生长及防控土传病害的报道[17-19]。菌株促生性能主要体现在产生一些植物促生物质,如吲哚乙酸(IAA)、赤霉素和玉米素等植物生长激素[13],如:Cattelan等[20]研究发现接种产IAA的促生菌可以促进大豆地上部及根系的生长;Kumar和 Singh[21]提出氨作为提供氮素的重要原料,为微生物产氨促进植物生长重要因子之一。因此,本研究首先利用产IAA和氨能力初筛具促生能力的潜在根际细菌,通过多级筛选,首先获得潜在的促生菌株。PGPR菌株的防病功能主要体现在其具有抑制土传病原菌生长的功效[22-23],因此,本文继续通过测定菌株对设施蔬菜两种常见病害——枯萎病和青枯病[24-26]病原菌拮抗能力进行复筛,选择目标细菌,最终获得一株具有多种功效的细菌,预计所分离细菌不仅能够促进作物生长,同时具有防控设施蔬菜土传病害的能力。
3.2 生物育苗基质的应用效果与可能促生机理
功能菌株N23保活添加至普通育苗基质中研制成的生物育苗基质,在3次育苗试验中均体现出促生优势。这与张杨等[12]利用辣椒根际枯草芽孢杆菌研制的生物基质促生效果一致。表明将PGPR与普通育苗基质联合研制成生物育苗基质后能够有效促进所育种苗的生长。目前大量的有关PGPR的研究均是直接添加至作物根际或研制成生物有机肥或复合微生物肥料施用后促进作物生长[27]。相比于先前研究,本研究开发出了新的PGPR利用模式,能够为PGPR的研究提供新思路。
两季盆栽试验结果表明,西瓜苗移栽后的株高、茎粗、和真叶数等生长指标均显著高于对照处理(CK)。将生物基质所育种苗(N23)移栽大田试验中,西瓜、黄瓜、辣椒和番茄四种作物的生长指标和产量均显著优于普通育苗基质所育种苗处理(CK)。由于盆栽和田间试验均保证了作物生长充足的养分供应,因此,处理的促生功效推断由PGPR发挥。现有大量PGPR菌株的研究均表明,该类微生物能够有效促进植株的生长[12,15,25-27],这与本研究结论一致。但与先前研究不同的是,本研究将PGPR与普通育苗基质联合形成生物育苗基质,育苗过程中,PGPR菌株即能够在苗期定殖于作物根际,预计到田间后能够进一步发挥促生功能;另一方面,本试验所筛选并研制的生物育苗基质能有效提高作物苗期质量,推测苗期的生长优势同样是取得盆栽试验促生效果的原因之一。因此,生物育苗基质能够首先提高所育种苗的质量,促进功能菌在苗期的定殖,进而两者协同作用,促进种苗移植后田间的增产。最后,本文筛选的功能菌株被鉴定为芽孢杆菌属细菌(Bacillus sp.),其与死谷芽孢杆菌、龙舌兰芽孢杆菌和枯草芽孢杆菌的同源性较近,但具体到种的分类地位尚需在以后的工作中进一步确定。
4 结 论
本研究分离筛选获得1株同时具有产IAA和NH3能力,既对尖孢镰刀菌又对茄科劳尔氏菌有拮抗作用且能力较高的PGPR菌株。将其保活添加至普通的育苗基质中而研制成对作物苗期生长具有促进作用的生物育苗基质,在三次育苗试验中,与普通基质处理(CK)相比添加菌株N23的生物基质处理(N23),多项作物苗期生长指标均表现出稳定的促生及根际定殖能力;移栽后,通过盆栽试验及田间试验证实使用生物基质所育种苗在移苗后其株高、茎粗和田间产量均具有显著优势。最后,结合形态、生理生化特征和16S rDNA 基因序列分析,初步鉴定菌株N23为芽孢杆菌属细菌(Bacillus sp.)。
[1] Adesemoye A O,Torbert H A,Kloepper J W. Enhanced plant nutrient use efficiency with PGPR and AMF in an integrated nutrient management system. Canadian Journal of Microbiology,2008,54(10):876—886
[2] Lee S W,Lee S H,Balaraju K,et al. Growth promotion and induced disease suppression of four vegetable crops by a selected plant growth-promoting rhizobacteria(PGPR)strain Bacillus subtilis 21-1 under two different soil conditions. Acta Physiologiae Plantarum,2014,36(6):1353—1362
[3] 康贻军,程洁,梅丽娟,等. 植物根际促生菌的筛选及鉴定. 微生物学报,2010,50(7):853—861
Kang Y J,Cheng J,Mei L J,et al. Screening and identification of plant growth-promoting rhizobacteria (In Chinese). Acta Microbiologica Sinica,2010,50 (7):853—861
[4] 胡江春,薛德林,马成新,等. 植物根际促生菌(PGPR)的研究与应用前景. 应用生态学报,2004,15(10):1963—1966
Hu J C,Xue D L,Ma C X,et al. Research advances in plant growth promoting rhizobacteria and its application prospects(In Chinese). Chinese Journal of Applied Ecology,2004,15(10):1963—1966
[5] Schippers B,Bakker A W,Bakker P A H M. Interactions of deleterious and beneficial rhizosphere microorganisms and the effect of cropping practices. Annual Review of Phytopathology,2003,25(1):339—358
[6] 孙珊,黄星,范宁杰,等. 一株溶磷细菌的分离、鉴定及其溶磷特性研究. 土壤,2010,42(1):117—122
Sun S,Huang X,Fan N J,et al. Studies on phosphorus solubilizing activity of a strain isolated from corp rhizosphere(In Chinese). Soils,2010,42 (1):117—122
[7] 康贻军,程洁,梅丽娟,等. 植物根际促生菌作用机制研究进展. 应用生态学报,2010,21(1):232—238
Kang Y J,Cheng J,Mei L J,et al. Action mechanisms of plant growth promoting rhizobacteria(PGPR):A review(In Chinese). Chinese Journal of Applied Ecology,2010,21(1):232—238
[8] 张小兰,韦中,梅新兰,等. 一种基于根际定殖能力筛选溶磷菌的方法. 南京农业大学学报,2014,37 (2):79—84
Zhang X L,Wei Z,Mei X L,et al. A method for screening phosphate solubilizing bacteria based on the rhizosphere colonization ability of strains(In Chinese). Journal of Nanjing Agricultural University,2014,37(2):79—84
[9] 刘静洋,崔松松,韩国民,等. 棉花根际细菌的生理活性和促生效果. 中国土壤与肥料,2013(6):88—92 Liu J Y,Cui S S,Han G M,et al. Physiological activity and promoting effects of rhizobacteria on cotton (In Chinese). Soil and Fertilizer Sciences in China,2013(6):88—92
[10] 李红. 浅谈蔬菜工厂化穴盘育苗生产技术. 现代农业,2015(6):15
Li H. Introduction to vegetable factory seedling production technology(In Chinese). Modernizing Agriculture,2015(6):15
[11] Chaney R L,Munns J B,Cathey H M. Effectiveness of digested sewage sludge compost in supplying nutrients for soilless potting media. Journal of the American Society for Horticultural Science,1980,105(4):485—492
[12] 张杨,文春燕,赵买琼,等. 辣椒根际促生菌的分离筛选及生物育苗基质研制. 南京农业大学学报,2015,38(6):950—957
Zhang Y,Wen C Y,Zhao M Q,et al. Isolation of plant growth promoting rhizobacteria from pepper and development of bio-nursery substrates(In Chinese). Journal of Nanjing Agricultural University,2015,38 (6):950—957
[13] Glickmann E,Dessaux Y. A critical examination of the specificity of the salkowski reagent for indolic compounds produced by phytopathogenic bacteria. Applied and environmental microbiology,1995,61 (2):793—796
[14] Dye D W. The inadequacy of the usual determinative tests for identification of Xanthomonas spp. New Zealand Journal of Science,1962(5):393—416
[15] 韦巧婕,郑新艳,邓开英,等. 黄瓜枯萎病拮抗菌的筛选鉴定及其生物防效. 南京农业大学学报,2013,36 (1):40—46
Wei Q J,Zheng X Y,Deng K Y,et al. Screening and identification of antagonistic Bacillus vallismortis B against cucumber Fusarium wilt and its biologicaleffect(In Chinese). Journal of Nanjing Agricultural University,2013,36(1):40—46
[16] 李引,虞丽,李辉信,等. 一株花生根际促生菌的筛选鉴定及其特性研究. 生态与农村环境学报,2012,28 (4):416—421
Li Y,Yu L,Li H X,et al. Isolation identification and characteristics of a peanut growth-promoting strain of Rhizobacteria(In Chinese). Journal of Ecology and Rural Environment,2012,28(4):416—421
[17] Xue Q Y,Chen Y,Li S M,et al. Evaluation of the strains of Acinetobacter and Enterobacter as potential biocontrol agents against Ralstonia wilt of tomato. Biological Control,2009,48(3):252—258
[18] Zhou T T,Chen D,Li C Y,et al. Isolation and characterization of Pseudomonas brassicacearum J12 as an antagonist against Ralstonia solanacearum and identification of its antimicrobial components. Microbial Research,2012,167(7):388—394
[19] 陈巧玲,胡江,汪汉成,等. 生物有机肥对盆栽烟草根际青枯病原菌和短短芽孢杆菌数量的影响. 南京农业大学学报,2012,35(1):75—79
Chen Q L,Hu J,Wang H C,et al. Effects of bioorganic fertilizer application on population of Ralstonia solanacearum and Brevibacillus brevis in tobacco rhizosphere(In Chinese). Journal of Nanjing Agricultural University,2012,35(1):75—79
[20] Cattelan A J,Hartel P G,Fuhrmann J J. Screening for plant growth–promoting rhizobacteria to promote early soybean growth. Soil Science Society of America Journal,1999,63(6):1670—1680
[21] Kumar V,Singh K P. Enriching vermicompost by nitrogen fixing and phosphate solubilizing bacteria. Bioresource Technology,2001,76(2):173—175
[22] 陈玉婷,林威鹏,范雪滢,等. 硅介导番茄青枯病抗性的土壤定量蛋白质组学研究. 土壤学报,2015,52 (1):162—173
Chen Y T,Lin W P,Fan X Y,et al. Soil quantitative proteomic analysis of silicon-mediated resistance of tomato(Solanum lycopersicum)to Ralstonia solanacearum(In Chinese). Acta Pedologica Sinica,2015,52(1):162—173
[23] 吴学宏,卢志军,王品品,等. 西瓜枯萎病综合防治研究进展. 植物保护,2011,37(4):27—32
Wu X H,Lu Z J,Wang P P,et al. Current advances in integrated management of watermelon Fusarium wilt (In Chinese). Plant Protection,2011,37(4):27—32
[24] 李红丽,郭夏丽,李清飞,等.抑制烟草青枯病生物有机肥的研制及其生防效果研究. 土壤学报,2010,47 (4):798—801
Li H L,Guo X L,Li Q F,et al. Tobacco wilt suppressing bio-manure and its bio-control effect(In Chinese). Acta Pedologica Sinica,2010,47(4):798—801
[25] Wang B B,Shen Z Z,Zhang F G,et al. Bacillus amyloliquefaciens strain W19 can promote growth and yield and suppress Fusarium wilt in banana under greenhouse and field conditions. Pedosphere,2016,26 (5):733—744
[26] Hu H Q,Li X S,He H,et al. Characterization of an antimicrobial material from a newly isolated Bacillus amyloliquefaciens from mangrove for biocontrol of Capsicum bacterial wilt. Biological Control,2010,54 (3):359—365
[27] 巩子毓,高旭,黄炎,等. 连续施用生物有机肥提高设施黄瓜产量和品质的研究. 南京农业大学学报,2016,39(5):777—783
Gong Z Y,Gao X,Hang Y,et al. Research on continuous application of bio-organic fertilizer for improving greenhouse cucumber yield and quality(In Chinese). Journal of Nanjing Agricultural University,2016,39(5):777—783
Screening of Plant Growth-Promoting Rhizobacteria from Watermelon and Development of Bio-nursery Substrates
ZHANG Yang1WANG Tiantian1SUN Yuhan1HU Guanmo1LI Rong1†YU Ping2SHEN Qirong1
(1 College of Resources and Environmental Sciences / National Engineering Research Center for Organic-based Fertilizer/ Jiangsu Key Laboratory of Solid Organic Waste Utilization/ Jiangsu Collaborative Innovation Center for Solid Organic Waste Resource Utilization,Nanjing Agricultural University,Nanjing 210095,China)
(2 Nanjing Qinbang Jipin Agricultural Development Co. Ltd. ,Nanjing 211516,China)
【Objective】In order to improve the technical level of industrialized seedling culture andfind new methods to make use of plant growth-promoting rhizobacteria(PGPR),a new strain of functional bacteria that would promote growth of watermelon was isolated,cultured and inoculated into ordinary nursery substrate,thus forming a kind of bio-nursery substrate.【Method】A number of strains of bacteria were isolated randomly from the rhizosphere soil of watermelon plants and screened by plant growth-promoting properties. One strain which was found to possess complex functions and efficient rhizospheric colonization ability was further cultured and then inoculated into in ordinary nursery substrate in developing bionursery substrates. Repeated seedling nursing tests and pot experiments were performed in greenhouse and subsequently in the field to further validate effect of the novel bio-nursery substrate prepared by inoculating this bacterial strain into ordinary nursery substrate. In the end this strain was proved to be the right one for preparation of bio-nursery substance.【Result】Through screening,a strain of bacteria,N23,capable of both producing indole acetic acid and NH3simultaneously and acting in antagonism against Fusarium oxysporum f. sp. niveum and Ralstonia solanacearum,was isolated from the rhizospheric soil of watermelon plants. Seedling raising experiments show that in the substrate inoculated with Strain N23,watermelon seedlings grew much better than those in the ordinary nursery substrate,in plant height,stem diameter and leaf area. Such an effect was further demonstrated in another three seedlings raising experiments,showing that the strain steadily promotes seedling growth in a number of growth indices. The pot experiments show that the plants growing in the bio-nursery substrate were significantly higher than those in the ordinary nursery substrate,in all measured parameters except SPAD(Soil and Plant Analyzer Development),which differed very slightly. In the field experiments,watermelon,cucumber,tomato,and pepper seedlings cultured in the bio-nursery substrate grew better than those cultured in ordinary nursery substrate,in plant height and stem diameter,which coincided with the results in the pot and seedling experiments. And in the two seasons of field experiments,the watermelon in the former was 12.5% and 25.4% higher than that in the latter,respectively. In the field experiments cucumber,tomato,and pepper in the former was 18%,60% and 25%,than their respective one in the latter. Morphological and biochemical analysis and 16S rDNA gene sequencing of Stain N23 shows that the strain is one of Bacillus sp.【Conclusion】All the findings in this study demonstrate that the bio-nursery substrate prepared by inoculating Bacillus sp. N23 into ordinary nursery substances promotes seedlings and plant growth as well as yield of the crop. Consequently,this study has provided some novel ideas for making use of rhizobacteria and some theoretical and technical support to the development of PGPR agents for preparation of bio-nursery substances.
Plant growth-promoting rhizobacteria;Bio-nursery substrates;Seedling raising;Plant growth promotion;Bacillus sp.
S144.9
A
(责任编辑:陈荣府)
* 江苏省科技计划项目(BY2016077-05)、南京市科技计划项目(201505041)和江苏省高校品牌专业建设工程资助项目(PPZY2015A061)共同资助 Supported by the Science and Technology Project of Jiangsu Province(No. BY2016077-05),the Science and Technology Project of Nanjing(No. 201505041)and the Top-notch Academic Programs Project of Jiangsu Higher Education Institution (No. PPZY2015A061)
† 通讯作者 Corresponding author,E-mail:lirong@njau.edu.cn
张 杨(1991—),女,吉林人,博士研究生,主要研究领域植物营养学。E-mail:yczhang_0831@163.com
2016-08-30;
2016-12-19;优先数字出版日期(www.cnki.net):2017-01-13
10.11766/trxb201608300287

