芪参补气药茶保护线粒体及其机制
韦豪华,张红玲,李兴太
(大连民族大学 生命科学学院,辽宁 大连 116605)
芪参补气药茶保护线粒体及其机制
韦豪华,张红玲,李兴太
(大连民族大学 生命科学学院,辽宁 大连 116605)
以黄芪和党参为原料组方制成芪参补气药茶(ACT),探索ACT对线粒体的保护作用及其机制。分别用AlCl3比色法和硫酸苯酚法测定ACT的功能因子总黄酮、总糖及总多糖含量。用Ca2+诱导肝线粒体通透性转换(MPT),分光光度法测MPT程度;以Fe2+/维生素C诱发肝线粒体脂质过氧化,采用硫代巴比妥酸显色法测定丙二醛(MDA)含量;测定ACT对Fe2+螯合能力及还原力的影响。实验测得ACT总糖含量为(26 ± 1.3)mg·mL-1,总多糖含量为(12.5 ± 0.8)mg·mL-1,总黄酮含量为(121 ± 8.5)μg·mL-1。结果表明:ACT可抑制Ca2+引起的MPT,可一定程度上抑制线粒体MDA生成,具有较弱的Fe2+螯合能力及一定的还原力。能通过温和的抗氧化和清除活性氧作用,一定的还原力及抑制MPT来保护线粒体,从而维持机体氧化与抗氧化平衡,促进机体健康。
芪参补气药茶;黄芪;党参;线粒体通透性转换;活性氧
近期研究表明,线粒体作为生命活动的枢纽与核心,其最重要功能是通过氧化磷酸化(OXPHOS)提供能量——ATP(85%以上),其每秒每单位质量转换的能量比太阳多10 000倍以上[1]。线粒体又是自由基损伤最敏感的靶部位,也是细胞内自由基的主要来源。线粒体电子传递链上产生的活性氧(ROS)与衰老有着密切的关系[2],ROS引起的核酸、蛋白质及脂质的氧化是决定健康与寿命的关键因素[3]。中国医学认为,气主宰整个生命活动,气与健康的关系极为密切。中国的中老年人中一半以上表现为气虚,气虚又是多种病变的常见病因,气虚导致细胞内ATP水平显著下降,进而引发线粒体的能量代谢障碍,LI Xing Tai提出并用实验证明了通过改善线粒体能量代谢可以实现补气的作用[4]。中药治疗疾病在于以气调气,药茶蕴含着丰富的养生奥秘,药茶和养生的紧密结合诠释了“传统、自然、简约、有效”的药茶养生保健理念。
黄芪和党参是补气药的代表,黄芪有“补药之长”之称,党参能补中益气,用于神疲、力乏等症。已有前期实验证明,黄芪、党参都能够明显增加大鼠肝细胞的ATP含量[5];黄芪多糖通过清除活性氧(ROS)、抑制线粒体通透性转换(MPT)来保护线粒体,使其不受损伤,同时也能够提高细胞的生物能学,使线粒体的功能得到改善[6-7],黄芪的补气效果最好,一般常和党参一同服用,两药结合补气效果更加明显,制成的“芪参补气药茶”能在一定程度上清除3种主要线粒体ROS(超氧阴离子、过氧化氢和羟自由基)[8],从而推测其可能具有保护线粒体的作用。本实验从线粒体的视角研究芪参补气药茶的相关作用机理,为日后进一步对黄芪、党参的药用及保健功能的开发和利用提供科学依据。
1 材料与方法
1.1 材料与试剂
SD大鼠由大连医科大学实验动物中心提供(合格证号:2007 6A007)。黄芪采自黑龙江大兴安岭林区,党参购自大连经济技术开发区保健大药房。
硫代巴比妥酸(TBA)、1,1,3,3-四乙氧基丙烷(TEP)(美国Sigma公司);钌红(RR)、Ferrozine(英国Alfa Aesar公司);考马斯亮蓝G-250、牛血清白蛋白(荷兰Boehringer Mannheim 公司);三羟甲基氨基甲烷(Tris)(美国Gibco公司);N-(2-羟乙基)哌嗪-N’-2-乙烷磺酸(HEPES)(德国Merck公司);4-吗啉丙烷磺酸(MOPS)(北京索莱宝科技有限公司);其他试剂均为国产或进口分析纯。
1.2 仪器与设备
UV-2450紫外-可见分光光度计(日本岛津公司);Polystat 34恒温水浴锅(美国Techne公司);Beckman Coulter Avanti J-E高速低温离心机(Beckman JA-25.50 转子,美国Beckman公司);XW-80A旋涡混合器(上海精密实业有限公司);DY89-1型电动玻璃匀浆机(宁波新芝科器研究所)。
1.3 试验方法
1.3.1 芪参补气药茶(ACT)的制备
分别称取干燥的黄芪粉末和党参饮片各25.0 g,再加入500 mL去离子水浸泡60 min。具体制备方法详见参考文献[8]。
1.3.2 ACT总黄酮、总糖和总多糖含量的测定
以芦丁作为标准品,采用AlCl3比色法测定ACT的总黄酮含量[9];利用Sevage试剂[氯仿:正丁醇(4:1)]除去ACT中的蛋白,经浓缩后加入无水乙醇使其体积分数为80%,通过离心处理后所得到的沉淀依次用无水乙醇、丙酮、无水乙醚分别洗涤,最后得到的沉淀即为ACT的总多糖,经真空干燥处理后,以葡萄糖作为标准品,ACT的总糖和总多糖含量采用硫酸苯酚法来测定[10]。
1.3.3 鼠肝线粒体的制备
用差速离心法分离大鼠肝线粒体[11],具体制备方法详见参考文献[12]。然后用牛血清白蛋白作为标准品,利用Bradford法来测定线粒体的蛋白含量[13]。
1.3.4 线粒体通透性转换(MPT)的测定
在线粒体温育介质(1 mmol·L-1Pi-Tris、250 mmol·L-1蔗糖、5 mmol·L-1谷氨酸-Tris、10 mmol·L-1Tris-MOPS、2.5 mmol·L-1苹果酸-Tris,25 ℃、pH 7.4)中加入150 μmol·L-1的Ca2+,然后再加入ACT(模型组不加)或钌红(0.5 μmol·L-1,模型组不加),接着加入0.5 mg线粒体启动实验,得到最终体积为2 mL。在0、2、5、10、20、30 min通过监测线粒体悬液在波长为540 nm处吸光度的下降程度来测定MPT[14-15]。
1.3.5 MDA含量的测定
采用TBA显色法测定MDA的含量[16]。反应体系含有0.25 mmol·L-1FeSO4和0.6 mmol·L-1的维生素C(VC)(正常组不加FeSO4和VC),以及不同浓度的ACT(模型组不加)和0.5 mg的线粒体蛋白,再用pH 7.4、0.1 mol·L-1的磷酸盐缓冲液(PBS)补充体积到2 mL(空白参照管不加ACT和线粒体),经37 ℃水浴60 min,取出后再加入20%三氯乙酸(TCA)0.5 mL终止反应,接着分别倒入离心管后以5 000×g离心10 min,最后取上清液2 mL,再加入 0.67%的硫代巴比妥酸(TBA)1 mL,100 ℃煮沸10 min,用空白参照管调零, 在波长为532 nm处测定其吸光度A,以TEP(1,1,3,3-四乙氧基丙烷)作为外标,经线性回归分析后计算MDA的含量。ACT的作用以MDA的抑制率(IR)按式(1)表示。
IR/%=(MDA含量模型-MDA含量ACT)/(MDA含量模型-MDA含量正常)×100。
(1)
1.3.6 亚铁离子螯合能力的计算
试管中依次加入不同浓度的EDTA溶液(0.6 mg·mL-1)或ACT溶液、0.1 mL 2.25 mmol·L-1Ferrozine、0.1 mL 0.375 mmol·L-1FeSO4溶液,然后用Hepes缓冲液补充体积到3 mL,经旋涡混合器混匀后,室温放置20 min,在波长562 nm处测定其吸光度A,以EDTA作为阳性对照,结果用螯合率来表示[17],按式(2)计算。 螯合率/%=[(A对照-AACT或EDTA)/A对照]×100。
(2)
1.3.7 总还原力的计算
试管中加入不同浓度的ACT溶液、0.5 mL 1% K3Fe(CN)6溶液和0.5 mL 0.2mol·L-1PBS(pH 6.6),用超纯水将体积补足至1.5 mL,在经过50 ℃水浴20 min,冷却后再加1.0 mL 10% TCA溶液,在转速为3 000 r·min-1的条件下离心10 min,取上清1.5 mL,加入0.1% 的FeCl3溶液0.1 mL,再加0.4 mL超纯水补足体积至2 mL,混匀后静置10 min,最后在波长700 nm处测定其吸光度A,吸光度越大即还原力越强[18]。以2,6-二叔丁基-4-甲基苯酚(BHT)为阳性对照。
1.3.8 数据处理

2 结果与分析
2.1 ACT的总黄酮、总糖与总多糖的含量
多糖为党参的主要功能因子,研究表明,党参多糖含量的高低可作为党参的质量评价指标。黄芪主要含多糖、黄酮和皂苷等活性成分,具有清除活性氧、抗氧化、抗衰老等活性,多糖和黄酮为其主要功能因子。黄芪和党参都含较多的糖类物质,是人类营养所需,均可能参与机体的能量代谢。因此,本实验测定了ACT的总黄酮、总糖及总多糖含量作为制定其质量标准的依据。取ACT 200 μL,测定得到ACT总黄酮含量、总糖含量与总多糖含量分别为(121±8.5)μg·mL-1、(26±1.3)mg·mL-1和(12.5±0.8)mg·mL-1。
2.2 ACT对鼠肝MPT的影响
线粒体是细胞内具有双层膜结构的重要细胞器,其外膜的通透性良好。线粒体内膜的非特异的通透性变大即为MPT。许多研究表明,线粒体上存在一种位于线粒体内外膜间的由多种蛋白质组成的非选择性的复合孔道,即线粒体膜通透性转换孔 (MPTP)。MPTP作为线粒体内外信息交流的中心枢纽,其开放的状态决定了线粒体功能的发挥。MPTP被打开之后,线粒体内膜的通透性非特异性增大,这时,线粒体就会发生MPT。线粒体通透性转换孔长时间打开,会导致细胞的凋亡或坏死[19]。此外,MTPT对细胞内各种离子浓度的变化十分敏感,尤其对在细胞内信号传导系统有重要作用的Ca2+浓度的变化极其敏感, MPTP大量开启会导致膜电位的崩解及细胞的凋亡。MPT能够诱导破坏内膜的通透性屏障,从而破坏膜电位和pH梯度[20]。有实验表明,当 Ca2+浓度为150 μmol·L-1时,就会引起可检测的MPT,Ca2+积累之后再加入钌红(RR),便可以阻止Ca2+再分布[21]。本实验中,Ca2+诱导明显的MPT,其效应几乎被0.5 μmol·L-1钌红完全抑制,低剂量(3mg·mL-1)ACT早期抑制MPT不显著,但随时间的增加作用变得明显,高剂量(6 mg·mL-1)时抑制效应增强,见表1。

表1 ACT对肝线粒体通透性转换的影响±s,n=6)
注:与模型组比较,“*”表示有显著差异(P< 0.05),“**”表示有较显著差异(P< 0.01),下表同。
脂质过氧化(Lipid Peroxidation,LPO)会导致膜通透性增加,进而引起MPT。发生LPO时,线粒体膜的受损会导致Ca2+的通透性增加进而导致细胞凋亡[22]。ACT抑制MPT作用与其抑制脂质过氧化及清除ROS作用密切相关,说明其抑制MPT可能是通过清除ROS及抗氧化作用,从而保护线粒体。
2.3 ACT对鼠肝线粒体MDA的影响
脂质在Fe2+作用下可以氧化分解产生MDA。用Fe2+/VC处理之后,肝线粒体中的MDA(LPO的终产物)显著增多,见表2。
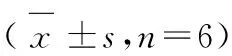
表2 ACT对鼠肝线粒体MDA生成的影响
MDA可被ACT以浓度依赖性的方式抑制,虽然其作用不是很强,但还具有一定的抗氧化活性。研究表明,LPO已被认为是线粒体膜功能降低的重要原因之一。LPO可破坏膜结构导致线粒体和细胞损害。线粒体发生LPO或生成超氧化物是脂肪酸诱导线粒体功能障碍、ATP耗竭及细胞死亡的触发因素[23]。LPO可通过对线粒体膜、膜蛋白及线粒体DNA的作用最终导致线粒体损伤。因此,ACT有可能通过与内源性抗氧化剂共同(如协同)作用,以维持或重新建立氧化还原平衡,具有一定的抗衰老作用。
2.4 ACT对Fe2+螯合能力的影响
Fenton反应是指Fe2+和H2O2反应生成羟自由基的反应。具有螯合Fe2+活性的药物可以有效降低导致LPO的过渡金属催化剂的浓度、阻止ROS的产生和由此所引起的氧化损伤。因此,Fe2+的螯合能力与抗氧化有十分密切的关系,见表3。
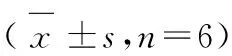
表3 ACT 对Fe2+螯合能力的影响
在Fe2+螯合测定体系中,ACT在较低质量浓度时,作用并不是很显著,但随其质量浓度的逐渐升高,对Fe2+的螯合能力也随之增强,当其质量浓度为8.0 g·L-1时,螯合率可达19.94%。但与EDTA相比,可以发现其螯合Fe2+的能力较低。
2.5 ACT对还原力的影响
研究表明,物质的还原力越强,其抗氧化性就越强。物质抗氧化活性的一个重要表现是其还原力的大小,在氧化还原反应中,物质提供电子而自身发生氧化的能力即为还原力。还原力大的物质可以很好的提供电子,提供的电子不仅可以让Fe3+还原为Fe2+,还能够与自由基发生反应,最终使自由基成为更加稳定的物质。本实验通过还原Fe3+来测定ACT的还原力,由表4可知,A700nm随着还原力的增加而增加,ACT的还原力随浓度的增加而增强,但远没有BHT强。
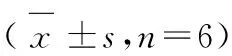
表4 ACT 对还原力的影响
注:组间相同字母表示无显著性差异(P≥0.05);组间不同字母表示有显著性差异(P<0.05)。
3 讨 论
线粒体是机体进行各项生命活动关键细胞器,为机体提供大部分的能量,保证机体的生命活力。细胞中的ROS主要源于线粒体,所有需氧生物在代谢过程中都会产生ROS。ROS对氧化应激、基因表达以及细胞凋亡等重要细胞过程的调控具有重要的作用。细胞内ROS的产生与清除处于动态平衡,或可以说体内氧化与还原处于平衡时,生命才能维持健康。ROS被认为是多种病理的影响因素。然而,近几十年的研究表明了ROS在众多正常生理调节过程中的关键作用。事实上,持续暴露于高浓度的ROS中可引起蛋白质,膜脂质和核酸残基的氧化损伤,但低至中等的ROS水平可调节生长、凋亡和其他细胞信号通路[24]。线粒体作为细胞活动的控制中心,不仅是细胞呼吸链和OXPHOS的中心,也是细胞凋亡的调控中心。线粒体作为一种必要的调节器调节细胞的生物能学,它所产生的ROS不但驱动氧化还原的敏感事件,而且还应答ROS介导的细胞的氧化还原状态的变化[25]。线粒体实现其生理功能主要是通过调整ROS的生成以及能量代谢[26]。由此可见,保护好线粒体对健康而言非常重要。
为避免化学溶剂的带入,本实验用水作为溶剂来提取药茶的总活性成份,综合利用了其中的各种营养物质,既符合传统的饮茶和用药习惯,又符合传统药茶养生的保健理念。实验结果表明,芪参补气药茶能一定程度抑制鼠肝线粒体脂质过氧化,对3种主要ROS的清除作用亦不是很强,对Fe2+螯合能力也较弱,但具一定还原力,这就说明其抗氧化的作用比较温和,这可能对维持机体氧化还原的平衡有一定作用。ROS与Ca2+均可以诱发MPTP的开放,MPTP的开放不仅会使ROS浓度大幅升高,而且也会使线粒体膜通透性增大,从而导致Ca2+的释放;胞浆内Ca2+浓度的大量升高会作为第二信使,启动多条信号转导途径,导致ROS的浓度升高。ROS水平升高会诱发线粒体的膜电位降低及细胞凋亡。对于研究者而言,日后所关注的重点是怎样控制线粒体内 ROS的生成、改善线粒体的生物能学以及防护线粒体的氧化损伤[27]。ACT能够抑制MPT的发生,进而抑制了细胞的凋亡,这就充分说明其对健康具有一定的益处。ACT能通过相对温和的抗氧化作用、一定的还原力及抑制MPT来保护线粒体,保证机体内氧化与抗氧化之间的平衡,这将是ACT促进生命健康的可能机制。
[1] SCHATZ G. The magic garden[J]. Annual Review of Biochemistry, 2007, 76: 673-678.
[2] LEE H C, WEI Y H. Mitochondrial alterations, cellular response to oxidative stress and defective degradation of proteins in aging[J]. Biogerontology, 2001, 2(4):231-244.
[3] DE C E, INSERRA F, FERDER L. Angiotensin Ⅱ blockade: a strategy to slow ageing by protecting mitochondria[J]. Cardiovascular Research, 2011, 89(1): 31-40.
[4] LI Xingtai. Investigation on the Mechanism of Qi-invigoration from a Perspective of Effects of Sijunzi Decoction on Mitochondrial Energy Metabolism[M]// Sakagami Hiroshi. Alternative Medicine. Rijeka: InTech Publisher,2012: 247-275.
[5] LI Xingtai, ZHAO Jia. An Approach to the Nature of Qi in TCM—Qi and Bioenergy[M]// Kuang Haixue.Recent Advances in Theories and Practice of Chinese Medicine. Rijeka: InTech Publisher,2012: 79-108.
[6] LI Xingtai, ZHANG Yakui, KUANG Haixue, et al. Mitochondrial protection and anti-aging activity of Astragalus polysaccharides and their potential mechanism[J]. Int J Mol Sci, 2012, 13(2): 1747-1761.
[7] LI Xingtai, ZHAO Jia. Cancer-preventive mechanism from the perspective of effects of the Astragalus polysaccharides on mitochondrial energy metabolism improvement[M]// Cancer-Cares. Treatments and Preventions. Brisbane: iConcept Press, 2014: 141-180.
[8] 李兴太, 韦豪华, 张红玲, 等. 芪参补气药茶清除线粒体活性氧研究[J]. 大连民族学院学报, 2015, 17(5): 453-457.
[9] 王浩江, 孙体健, 曹晓峰. 月季花中总黄酮含量测定[J]. 山西医科大学学报, 2007, 38(4): 318-319.
[10] DUBOIS M, GILLES K A, HAMILTON J K, et al. Colorimetric method for determination of sugars and related substances[J]. Analytical Chemistry, 1956, 28(3): 350-356.
[11] MICHELE A S, JHON Z, ALAIN Y F, et al. Ischemic injury to rat forebrain mitochondria and cellular calcium homeostasis[J]. Biochimica et Biophysica Acta (BBA)-Molecular Cell Research, 1992, 1134(3): 223-232.
[12] 李兴泰, 冮洁, 匡海学, 等. 红豆越橘果总黄酮保护线粒体及其机制[J]. 食品科学, 2013, 34(19): 67-72.
[13] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1): 248-254.
[14] WALTER L, NOGUEIRA V, LEVERVE X, et al. Three classes of ubiquinone analogs regulate the mitochondrial permeability transition pore through a common site[J]. The Journal of Biological Chemistry, 2000, 275(38): 29521-29527.
[15] HE L, POBLENZ A T, MEDRANO C J, et al. Lead and calcium produce rod photoreceptor cell apoptosis by opening the mitochondrial permeability transition pore[J]. The Journal of Biological Chemistry, 2000, 275(16): 12175-12184.
[16] OHKAWA H, OHISHI N, YAGI K. Assay for lipid peroxides in animal tissues by thiobarbituric acid reaction[J]. Analytical Biochemistry, 1979, 95(2): 351-358.
[17] MANDAL S, HAZRA B, SARKAR R, et al. Assessment of the antioxidant and reactive oxygen species scavenging activity of methanolic extract ofCaesalpiniacristaleaf[J]. Evidence-based Complementary and Alternative Medicine, 2011, 173768:1-11.
[18] ZHAO J, LIU T, MA L, et al. Antioxidant and preventive effects of extract fromNymphaeacandidaflower oninvitroimmunological liver injury of rat primary hepatocyte cultures[J]. Evidence-based Complementary and Alternative Medicine, 2011, 497673:1-8.
[19] RASOLA A, BERNARDI P. Mitochondrial permeability transition in Ca2+-dependent apoptosis and necrosis[J]. Cell Calcium, 2011, 50(3):222-233.
[20] GREEN D R, REED J C. Mitochondria and apoptosis[J]. Science, 1998, 281(5381): 1309-1312.
[21] PETRONILLI V, COLA C, MASSARI S, et al. Physiological effectors modify voltage sensing by the cyclosporin A-sensitive permeability transition pore of mitochondria[J]. Journal of Biological Chemistry, 1993, 268(29): 21939-21945.
[22] JAMBRINA E, ALONSO R, ALCALDE M, et al. Calcium influx through receptor-operated channel induces mitochondria-triggered paraptotic cell death[J]. Journal of Biological Chemistry, 2003, 278(16): 14134-14145.
[23] RAGERS C, DAVIS B, NEUFER P D, et al. A transient increase in lipid peroxidation primes preadipocytes for delayed mitochondrial inner membrane permeabilization and ATP depletion during prolonged exposure to fatty acids[J]. Free Radical Biology & Medicine, 2014, 67(1): 330-341.
[24] SARSOUR E H, KUMAR M G, CHAUDHURI L, et al. Redox control of the cell cycle in health and disease[J]. Antioxidants & Redox Signaling, 2009, 11(11): 2985-3011.
[25] HANDY D E, LOSCALZO J. Redox regulation of mitochondrial function[J]. Antioxidants & Redox Signaling, 2012, 16(11): 1323-1367.
[26] FERNANDES M A, MARQUES R J, VICENTE J A, et al. Sildenafil citrate concentrations not affecting oxidative phosphorylation depress H2O2generation by rat heart mitochondria[J]. Molecular and cellular biochemistry, 2008, 309(1): 77-85.
[27] 李兴太, 刘德文, 张新, 等. 线粒体通透性转换与细胞凋亡[J]. 中国公共卫生, 2015, 31(4): 529-532.
(责任编辑 赵环宇)
Mitochondrial Protection of Astragalus membranaceus/Codonopsis pilosula Qi-invigorating Herbal Tea and Its Underlying Mechanism
WEI Hao-hua, ZHANG Hong-ling, LI Xing-tai
(School of Life Science, Dalian Minzu University, Dalian Liaoning 116605, China)
Astragalusmembranaceus/CodonopsispilosulaQi-invigorating herbal tea (ACT) was prepared fromAstragalusmembranaceusandCodonopsispilosula. Mitochondrial protective activity of ACT and the underlying mechanism were investigated. Total flavonoids, total carbohydrates and total polysaccharides, which are the functional factors of ACT, were determined by AlCl3colorimetry and sulfuric acid/phenol method respectively. Rat liver mitochondrial permeability transition (MPT) was induced by Ca2+overloadinvitroand spectrophotometric method was used to measure it. Lipid peroxidation of liver mitochondria was induced by Fe2+/Vitamin Cinvitro. Thiobarbituric acid (TBA) colorimetry was used to measure the content of malondialdehyde (MDA). Effects of ACT on Fe2+chelation and reducing power were determined. The contents of total carbohydrates, total polysaccharides and total flavonoids of ACT were (26±1.3) mg·mL-1, (12.5±0.8) mg·mL-1and (121±8.5) μg·mL-1respectively. The results showed that ACT could inhibit mitochondria from permeability transition. ACT which also could inhibit mitochondrial MDA production has weak Fe2+chelation ability and could increase reducing power in some degree. The protective effects of ACT on mitochondrial injury were achieved by mild antioxidation and reactive oxygen species scavenging activity, reducing power and inhibiting MPT. Therefore, the balance of oxidation and antioxidant (redox balance) was maintained, which may be the underlying mechanism of mitochondrial protection and the health benefits for ACT.
Astragalusmembranaceus/CodonopsispilosulaQi-invigorating herbal tea;Astragalusmembranaceus;Codonopsispilosula; mitochondrial permeability transition; reactive oxygen species
2017-02-05
辽宁省自然科学基金项目(201602192);大连市科技计划项目(2013E15SF131)
韦豪华(1994-),男,广西河池人,大连民族大学生命科学学院研究生,主要从事中药生化药理学研究。
李兴太(1966-),男,山东菏泽人,副教授,博士,主要从事中药线粒体生物能学与生化药理学研究,E-mail: xtli@dlnu.edu.cn。
2096-1383(2017)03-0216-06
R285.5
A

