VEGF的SNP状态预测贝伐株单抗治疗转移性结直肠癌的长期疗效
招丽蓉 王 巍 伍 婧 胡 斌 林秀强 徐绮华 林 奔 冯 芬 陈永昌
VEGF的SNP状态预测贝伐株单抗治疗转移性结直肠癌的长期疗效
招丽蓉 王 巍 伍 婧 胡 斌 林秀强 徐绮华 林 奔 冯 芬 陈永昌
目的 检测转移性结直肠癌患者外周血血管内皮生长因子(VEGF)单核苷酸多态性(SNP),探讨VEGF的SNP与患者预后的关系。方法 60例转移性结直肠癌患者的外周血样本,均接受过标准的化疗,其中20例加用了贝伐珠单抗,应用MassARRAY方法,成功进行9个VEGF的SNP的检测,包括-2578C>A、-460T>C、-1455T>C、-1154G>A、-634G>C、-398G>A、-497T>C、-2455>-T、-936C>T。结果 60例转移性结直肠癌患者,联合靶向治疗组的总生存期优于单用化疗组(P=0.01),VEGF各SNP变异率与NDBI数据库相似,-1455T>C 变异率极低,无临床价值;-2578C>A和-460C>T变异具有较高一致性;入组患者中SNP-497TT纯合子患者总生存期劣于其他患者(P=0.02);应用贝伐株单抗患者,SNP-497 3种基因型总生存期均有明显差异(P=0.01),SNP-398AA纯合变异者总生存期优于其他患者(P=0.02)SNP—2455 CC纯合子者总生存期优于其他患者(P=0.01)。结论 在转移性结直肠癌,外周血VEGF的SNP状态与贝伐珠单抗以及化疗的长期疗效可能相关,需要进一步增加病例,加强这方面的研究。
转移性结直肠癌;贝伐珠单抗;血管内皮生长因子:基因多态性
(ThePracticalJournalofCancer,2017,32:531~535)
在中国结直肠癌发病率及死亡率呈上升趋势[1],治疗复发转移性结直肠癌的主要方法是化疗联合靶向治疗。其中贝伐珠单抗通过特异性结合患者外周血内血管内皮生长因子(VEGF)起血管靶向治疗作用,使患者中位生存期延长到2年以上[2],但贝伐株单抗价格较贵,且有心脑血管损伤等比较严重的副作用[3]。无论是化疗还是贝伐珠单抗,仍无公认的疗效或毒性预测因子。国外有研究显示,转移性结直肠癌患者在接受贝伐单抗联合伊立替康为基础化疗后,VEGF-2578 AA和VEGF-1154 AA基因型预后较好[4],但相关研究较少。本研究针对60例转移性结直肠癌患者,测定其治疗前VEGF基因的单核苷酸多态性(SNP),进行长期生存随访,结果报告如下。
1 材料与方法
1.1 临床资料
自2011年1月至2015年12月在佛山市第一人民医院治疗的60例转移性结直肠癌患者,有可评价的病灶,接受正规一线化疗。
60例患者中男性35例,女性25例;年龄33~73岁,中位年龄58岁;ECOG体能状况评分均≤2,其中38例应用以奥沙利铂为基础化疗方案(mFOLFOX6或者Xelox),22例应用FOLFIRI化疗方案。根据相应化疗方案,其中20例联合贝伐珠单抗治疗,应用5 mg/kg体重,静脉滴注每2周1次,或者7.5 mg/kg静脉滴注,每3周1次。化疗之前留取患者血标本,化疗之后进行密切随访。
1.2 仪器与试剂
基因扩增仪(Bio-rad),MassARRAY质谱分析仪(sequenom),MassARRAY微量点样仪(sequenom),complete iPLEX®Gold Genotyping Reagent Set 10*384(sequenom),快速DNA提取试剂盒(天根生化科技有限公司),引物和探针(Thermo Fisher scientific)。
1.3 目标SNP及引物设计
针对有报道的VEGF的10个常见SNP进行引物设计,根据MassARRAY实验原理,设计两条扩增引物实现对目标片段的扩增,另外针对每个SNP还需要设计一条单碱基延伸反应引物,延伸引物位于变异位点前一个碱基,在变异位点处可延伸一个碱基(表1)。用基质辅助激光解析电离飞行时间质谱(MALDI-TOF/MS)可区分延伸碱基的分子量,从而判断目的基因是否变异。具体见表1。

表1 MassARRAY引物及探针设计表
1.4 检测流程
样本收集:收集外周血,4 000 rmp离心10 min,去除血清,将白膜层收集用红细胞裂解液处理后,将白细胞保存在-80 ℃备用。
1.4.1 DNA提取和鉴定 使用快速DNA提取试剂盒,按照说明书提取白细胞的总DNA。Nanodrop 2000分光光度计定量检测基因组DNA纯度、浓度;并使用2%琼脂糖凝胶电泳观察基因组DNA的降解状况。
1.4.2 质谱分析引物设计 质谱分析软件设计,具体见表1。PCR扩增反应:PCR缓冲液(10×)0.5 μL、Mgcl2(25 mM)0.4 μL、dNTPs(25 mM)0.1 μL、PCR热启动酶(5 U/μL)0.2 μL、扩增引物混合液1 μL、基因组DNA(10 ng/μL)2 μL,水补足至5 μL。反应条件为:95 ℃ 2 min;95 ℃ 30 s、56 ℃ 30 s、72 ℃ 1 min,45个循环;72 ℃ 5 min。SAP化处理:虾碱性磷酸酶(shrimp alka-line phosphatase,SAP)去除PCR 产物中dNTP。在PCR 产物中加入SAP(1.7 U/μL)0.3 μL、SAP 缓冲液(10×)0.17 μL、水补足至7 μL。反应条件为:37 ℃ 40 min,85 ℃ 5 min。单碱基延伸反应:上述得到的产物中加入iplex缓冲液(10×)0.2 μL、iplex terminator 0.2 μL、iplex 酶0.041 μL、延伸引物混合液0.94 μL、水补足至9 μL。反应条件为:94 ℃ 30 s;[94 ℃ 5 s、(52 ℃ 5 s、80 ℃ 5 s)5个循环],40个循环;72 ℃ 3 min。树脂纯化:在产物中加16μL水,将清洁树脂平铺到6 mg的树脂板中(96 孔板),将树脂倒入延伸产物中,封膜,旋转板30~60 min 进行脱盐去离子防干扰处理;3000×g离心5 min,使树脂沉入孔底部。芯片点样及检测:MassARRAY系统点样仪对延伸产物进行芯片点样,利用分析仪扫描芯片。数据分析:扫描结果以Typer 4.0软件分析。根据变异位点处碱基分子量不同,时间飞行质谱扫描区分各目的基因的变异状况,在质谱峰变异碱基处出现峰,则判断为变异。
1.5 统计学处理
应用SPSS 16.0软件进行统计学分析,计数资料采用χ2检验,计量资料采用均数t检验,应用Kaplan-meier法进行Log Rank生存分析,P<0.05为差异有统计学意义。
2 结果
2.1 变异频率
结果显示成功检测的60个结直肠癌样本9个SNP检测汇总及变异频率分布,总体来讲,与NCBI数据库变异率相似。值得注意的是,-2578C>A和-460C>T变异具有较高一致性(59/60 98.3%),60例患者中59例在纯合、杂合变异及纯合变异3个方面完全一致,应用了贝伐珠单抗的患者两个SNP位点变异状态完全一致,见表2。

表2 60个结直肠癌样本MassARRAY测SNP汇总
2.2 生存分析
总体患者及应用贝伐株单抗治疗的患者均进行了生存分析,中位总生存期(OS)为16.0个月(95% CI:9.3~22.7);联合贝伐株单抗患者中位OS 34.0个月(95% CI:26.5~44.4),单用化疗组中位OS为12.7个月(95% CI:10.8~14.6),差别有统计学差异(P=0.01),见图1;在所有患者中SNP-497TT纯合子患者总生存期差于其他患者(P=0.02)见图2;在应用贝伐株单抗患者,SNP-497 3种基因型总生存期均有明显差异(P=0.01)见图3,SNP-398AA纯合变异者总生存期优于其他患者(P=0.02)见图4,SNP-2455 CC纯合子者总生存期优于其他患者(P=0.01)见图5。
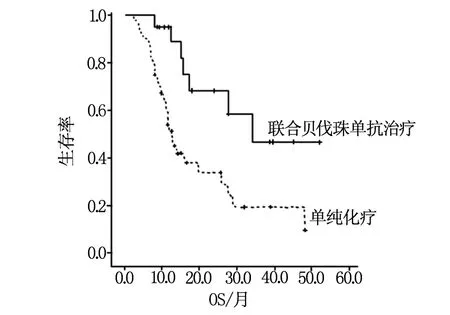
图1 不同治疗方案患者生存期比较
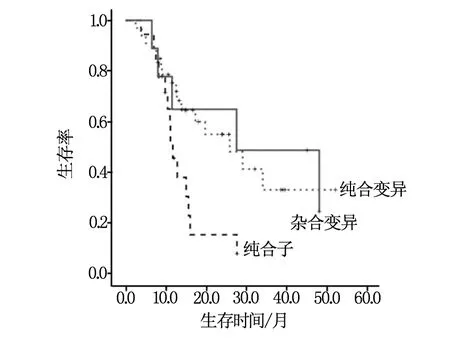
图2 研究人群中SNP-497TT纯合子患者总生存期
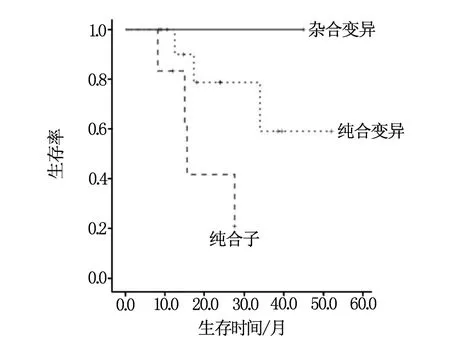
图3 应用贝伐株单抗患者SNP-497三种基因型总生存期
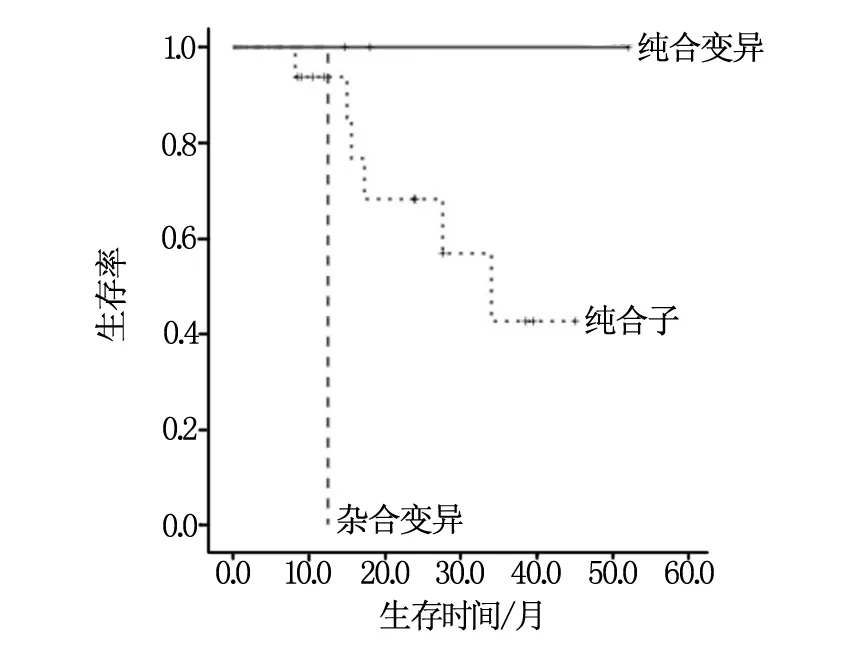
图4 应用贝伐株单抗患者SNP-398AA纯合变异者 总生存期

图5 应用贝伐株单抗患者SNP-2455CC纯合子者 总生存期
3 讨论
经过科学界的不断努力,转移性结直肠癌的中位生存期已经达到30月左右[5]。贝伐珠单抗在其中起到重要作用,但价格昂贵,有脑白质变性、心血管事件和肠穿孔等多种严重并发症[6-7],急需要找出疗效因子指导医生合理应用。多项大型Ⅲ期临床试验(AVF2107g,AVAiL,AVOREN,E4599)的回顾性分析结果是阴性的,无论是肿瘤组织的免疫组化表达,还是治疗前血浆基线VEGF浓度水平,均与贝伐珠单抗的疗效无明确相关性[8]。
由于免疫组化的先天局限性,加上贝伐珠单抗在外周血结合VEGF的特性,近年的研究集中于外周血的疗效预测因子。Willett等开展的一项Ⅱ期临床试验[9]显示,32例局部直肠癌患者接受贝伐珠单抗单药治疗后的血浆VEGF浓度较治疗前升高,且可能与原发灶和淋巴结缩小有一定关系,而单独接受标准放化疗的患者治疗前后血浆VEGF浓度无明显变化。因此有可能治疗前后血浆VEGF浓度变化水平,跟贝伐单抗疗效相关性更大,但VEGF浓度测定比较麻烦,技术标准不统一,抽血的时间点很难确定,需要多次抽血。
同时,VEGF存在多个SNP,在乳腺癌治疗研究中,评价了VEGF基因多态性与药物疗效及毒性之间的关系,该试验在两个治疗组中对所有候选基因型与疗效进行了比较,结果发现VEGF-2578和-1154位点均位于VEGF基因启动子区域,纯合子变异者在贝伐株单抗治疗组中预示患者中位OS更长,但在对照组中这两种基因型均未提示与患者PFS和RR有关[10]。
关于肠癌的回顾性分析[4]亦发现,在接受贝伐单抗联合伊立替康为基础治疗转移性结直肠癌患者,VEGF-2578 AA和-1154 AA纯合子变异基因型预示较好的生存。研究的缺陷是仅仅分析了化疗联合贝伐单抗治疗的转移性直肠癌患者,并没有对单独化疗的生存进行比较;但后来又发表的另两项类似研究[11-12]中,VEGF的SNPs与转移性结直肠癌疗效相关性仍不确定。
国内这方面的文献还比较少,因此本研究纳入了60例患者进行观察,结果发现对于VEGF基因区域的10个SNP,MassARRAY成功检测出9个位点的SNP状况,其变异状态与NCBI数据库相似,rs833062T>C位点变异率低于1%,无临床意义;-2578C>A和-460C>T变异具有较高一致性(59/60 98.3%),在应用了贝伐珠单抗的患者两个位点状态完全一致,未见文献报道,亟待下一步扩大试验例数进行验证。
在全体患者进行生存分析,可以看到贝伐珠单抗显著延长了患者生存期;在所有患者中SNP-497TT纯合子患者总生存差于其他患者(P=0.02);在应用贝伐株单抗患者,SNP-497三种基因型总生存均有明显差异(P=0.01),SNP-398AA纯合变异者总生存优于其他患者(P=0.02),SNP-2455 CC纯合子者总生存优于其他患者(P=0.01),-2578AA纯合子者1例仍存活,预后最好,但与其他患者差别无统计学意义。结果似乎与国外学者报道并不一致,但在仅有的20例接受贝伐株单抗联合化疗的患者,不同SNP基因型之间确实存在生存期差别,值得进一步增加病例和SNP数量。
下一步研究者已经开始前瞻性留取应用贝伐珠单抗治疗者的血标本,同时增加研究中心数量,有条件时开展VEGF血清动态监测,力争早日获得贝伐珠单抗疗效的预测因子。
[1] Chen W,Zheng R,Baade PD,et al.Cancer statistics in China,2015〔J〕.CA Cancer J Clin,2016,66(2):115-132.
[2] Saltz LB,Clarke S,Diaz-Rubio E,et al.Bevacizumab in co- mbination with oxaliplatin-based chemotherapy as first-line therapy in MCRC:a randomized phase Ⅲ study〔J〕.J Clin Oncol,2008,26(13):2013-2019.
[3] 王 巍,冯 芬,林秀强,等.贝伐珠单抗联合化疗导致昏迷2例并文献复习〔J〕.中国肿瘤临床,2013,40(24):1563-1566.
[4] Koutras AK,Antonacopoulou AG,Eleftheraki AG,et al.Va- scular endothelial growth factor polymorphisms and clinical outcome in colorectal cancer patients treated with irinotecan-based chemotherapy and bevacizumab〔J〕.Pharmacogenomics J,2012,12(6):468-475.
[5] Ilic I,Jankovic S,Ilic M.Bevacizumab Combined with Che- motherapy Improves Survival for Patients with Metastatic Colorectal Cancer:Evidence from Meta Analysis〔J〕.PLoS One,2016,11(8):e0161912.
[6] Wang W,Zhao LR,Lin XQ,et al.Reversible posterior leukoencephalopathy syndrome induced by bevacizumab plus chemotherapy in colorectal cancer〔J〕.World J Gastroenterol,2014,20(21):6691-6697.
[7] Botrel TE,Clark LG,Paladini L,et al.Efficacy and safety of bevacizumab plus chemotherapy compared to chemotherapy alone in previously untreated advanced or metastatic colorectal cancer:a systematic review and meta-analysis〔J〕.BMC Cancer,2016,16:677.
[8] Luo HY,Xu RH.Predictive and prognostic biomarkers with therapeutic targets in advanced colorectal cancer〔J〕.World J Gastroenterol,2014,20(14):3858-3874.
[9] Willett CG,Duda DG,di Tomaso E,et al.Efficacy,safety,and biomarkers of neoadjuvant bevacizumab,radiation therapy,and fluorouracil in rectal cancer:a multidisciplinary phase II study〔J〕.J Clin Oncol,2009,27(18):3020-3026.
[10] Baar J,Silverman P,Lyons J,et al.A vasculature-targeting regimen of preoperative docetaxel with or without bevacizumab for locally advanced breast cancer:impact on angiogenic biomarkers〔J〕.Clin Cancer Res,2009,15(10):3583-3590.
[11] Loupakis F,Cremolini C,Yang D,et al.Prospective validation of candidate SNPs of VEGF/VEGFR pathway in metastatic colorectal cancer patientstreated with first-line FOLFIRI plus bevacizumab〔J〕.PLoS One,2013,8(7):e66774.
[12] Hansen TF,Christensen Rd,Andersen RF,et al.The predictive value of single nucleotide polymorphisms in the VEGF system to the efficacy of first-line treatment with bevacizumab plus chemotherapy in patients with metastatic colorectal cancer:results from the Nordic ACT trial〔J〕.Int J Colorectal Dis,2012,27(6):715-720.
(编辑:吴小红)
Relationship between Peripheral Blood VEGF Promoter Region SNP and Prognosis of Patients with Metastatic Colorectal Cancer
ZHAOLirong,WANGWei,WUJing,etal.
TheFirstPeople’sHospitalofFoshan,Foshan,528000
Objective To detect single nucleotide polymorphism (SNP)in vascular endothelial growth factor (VEGF)promoter region in metastatic colorectal cancer patients,and explore the relationship between the SNP and prognosis.Methods Peripheral blood samples were taken from 60 metastatic colorectal cancer patients in our hospital.These patients received standard chemotherapy.20 cases received chemotherapy plus bevacizumab.Three SNPs in VEGF promoter region were detected successfully by MassARRAY method,including-2578C> A,-460T> C and-1455T> C.Results The over survival (OS)in 20 cases with bevacizumab was better than other cases (34.0m vs 12.7m),(P=0.004).The SNP status for each site was similar with NDBI database.-2578C> A and-460C> T mutation had a high consistency in the overall patient.Patients with-497 TT genotype had worse overall survival than other patients (P =0.02).In the patients received bevacizumab,three SNP-497 genotypes related to three significantly different prognosis(P=0.01),SNP-398AA homozygous variation related to superior overall survival (P=0.02),SNP-2455 CC homozygotes related to better overall survival (P=0.01).Conclusion In metastatic colorectal cancer,the VEGF SNP status may be related to the long-term efficacy of bevacizumab and chemotherapy.A further research with more cases is needed to test our hypotheses.
Metastatic colorectal cancer;Bevacizumab;Vascular endothelial growth factor(VEGF);Single nucleotide polymorphism(SNP)
佛山市科技局科研项目(编号:2014AB00278)
528000 广东省佛山市第一人民医院
王 巍
10.3969/j.issn.1001-5930.2017.04.003
R735.3+7
A
1001-5930(2017)04-0531-05
2017-01-16
2017-03-02)

