双波辅助提取结合双水相萃取分离纯化龙须菜多糖研究
颜晓琳,刘 杨
(汕头大学理学院生物系,广东省海洋生物技术重点实验室,广东 汕头 515063)
双波辅助提取结合双水相萃取分离纯化龙须菜多糖研究
颜晓琳,刘 杨
(汕头大学理学院生物系,广东省海洋生物技术重点实验室,广东 汕头 515063)
对龙须菜多糖双波辅助提取工艺进行响应面法优化,最佳条件为:超声波50 W,提取时间31.7 min、微波温度87℃、料液比1∶60.7,在此条件下龙须菜多糖提取率为34.84%。筛选双水相体系获得一种可较好去除蛋白的乙醇/(NH4)2SO4双水相体系.结果表明:双水相系线长度为50时,中间相龙须菜粗多糖回收率最高可达81.1%,证实双波辅助提取结合双水相萃取可成为一种龙须菜粗多糖提取的有效技术手段.
双波提取;海藻多糖;双水相体系
龙须菜[1-2](Gracilaria lamaneiformis)又名海发菜,属红藻门、真红藻纲、杉藻目、江蓠科,龙须菜多糖(GLP)是从龙须菜中提取分离出来的一类具有免疫调节活性、抗肿瘤、抗病毒、抗氧化等功能的重要天然生物活性物质[3-8].
龙须菜多糖传统提取工艺[9-10]主要为热水浸提,而近年来超声波[11]、微波提取法[12-15]被应用于中药化学成分的提取,其主要特点是快速、节能、节省溶剂、污染小而且有利于萃取热不稳定的物质,可避免长时间的高温引起的物质分解.双水相系统(Aqueous Two-Phase Systems,ATPS)由水溶性的不同化合物混合,并在其临界浓度以上形成的具有清晰界面,热力学稳定的两个不相溶的液相.双水相系统优势为:温和液相环境;能进行连续分离操作;易于产业化和扩大化等[16].由于其两相都是水溶液,可作为萃取体系用于生物活性物质的萃取分离及分析,其最大的优势在于可为生物活性物质提供一个温和的分离环境.在应用双水相萃取分离技术过程中,不同系线长度下的上、下相成相组分浓度不同,而不同的成相组分浓度对目标产物的分离效果有很大影响[17-18].
本课题以龙须菜为研究对象,采用双波辅助提取龙须菜粗多糖,将双水相系统应用于龙须菜多糖物质的分离和富集,筛选出合适的双水相体系,能够同时除去龙须菜中的杂蛋白并富集龙须菜活性多糖.
1 材料与仪器
龙须菜采自汕头市南澳岛(5月份),原料除尽杂砂,洗净后于60℃下烘干,粉碎过40目筛,置于试剂瓶中密闭保存备用,使用时在105℃下干燥至恒重.
实验用的试剂均为分析纯.
UV-1800PC扫描型紫外可见分光光度计购买于上海MAPADA公司;JA100电子分析天平购买于上海精密科学仪器有限公司;RE-52AA型旋转蒸发仪购买于上海亚荣生化仪器厂;TDL-5M台式大容量冷冻离心机购买于长沙湘仪离心机有限公司;BCD-188T容声冰箱购买于广东容声股份有限公司;CW-2000超声-微波协同萃取仪购买于上海新拓分析科技有限公司.
2 实验方法
2.1 龙须菜多糖提取工艺
称取龙须菜粉末进行微波超声提取,提取液离心,上清液于-40℃条件下冷冻过夜,然后置于4℃中溶化,溶化液离心,上清液浓缩后用3倍量无水乙醇沉淀多糖,离心去除上清液,将沉淀物溶于适量蒸馏水中制备粗多糖提取液备用.
2.2 多糖的测定
采用苯酚-硫酸比色法.准确称取在105℃干燥至恒重的葡萄糖10 mg,溶于100 mL容量瓶中,定容至刻度,得到浓度为0.1 mg/mL的标准溶液.准确吸取0、0.2、0.4、0.6、0.8、1.0 mL葡萄糖标准溶液,用去离子水补齐到1.0 mL,加入5%苯酚溶液1.0 mL,混匀后静置2 min左右使之充分反应,加入5.0 mL浓硫酸溶液,充分混匀后室温放置.以去离子水为空白管,在490 nm处分别测定吸光度,以葡萄糖浓度(mg/mL)为横坐标,吸光度为纵坐标,绘制标准曲线并进行线性回归.
2.3 多糖的提取
取干粉分别以不同的提取时间、浸提温度、料液比在50 W超声波和500 W微波条件下进行单因素试验,选取提取温度5~40 min,浸提温度50~95℃,料液比1∶40~1∶100(w/v)等条件,以多糖得率为考察指标,考察各因素对多糖提取得率的影响,为响应面法优化多糖提取工艺提供依据.提取得率计算公式(1)如下:

式中Y为多糖提取得率,m为所得多糖质量,M为样品质量.
在单因素实验基础上,根据实验结果设定响应面实验因素与水平,以多糖提取得率作为响应值,通过Minitab软件设计及响应面优化进行分析,响应面实验因素与水平设计如表1.
2.4 双水相体系筛选
按照上述实验方法提取龙须菜粗多糖,然后根据相图配制成双水相体系(ATPS)并混匀30 min;将双水相富集的龙须菜粗多糖体系静置分相,分别测定上下相体积,利用苯酚-硫酸法测定两相中多糖浓度;根据多糖浓度计算出GLP在下相中的收率(Y)及分配系数(K).

式中cb和ct分别代表多糖在上下相中浓度,Vt和Vb分别代表上下相体积,K为分配系数,Yb为收率.

表1 响应面分析实验设计
3 结果与讨论
3.1 葡萄糖标准曲线
根据苯酚-硫酸法测定并绘制葡萄糖标准曲线如图1,该实验重复3次,所得结果R2=0.9988,y=4.7457x-0.0068,该实验重复性好,数据拟合度高.

图1 葡萄糖标准曲线
3.2 龙须菜多糖提取的单因素实验
由图2可知,龙须菜粗多糖得率随着提取时间的增加而升高;当提取时间从5 min增加到30 min时,龙须菜粗多糖得率显著增加;从30 min增加到40 min时,多糖提取率变化不大.这是因为随着提取时间的延长,多糖逐渐溶解于水中,但时间增加到一定程度时,多糖基本已经完全溶出,因此增加缓慢,且多糖长时间在高温下也会有一定程度的降解和失活,因此选择提取时间为30 min.龙须菜粗多糖得率随着温度升高而升高;提升至一定温度后得率趋于稳定不变,这是因为随着温度升高多糖在水中溶解度也随着升高,此时蛋白易变性离心后沉淀下来,进一步增加了多糖含量及纯度,但温度过高会增加能量消耗,但多糖溶出增加量少,因此水浴温度不宜过高,选择提取温度为80℃.龙须菜粗多糖得率随着料液比的增加变化不明显,逐渐趋向平缓,考虑到溶液体积过大不利于后续的浓缩操作且增加提取成本,选择多糖提取的料液比为1:50.

图2 不同提取条件对多糖提取得率的影响
3.3 龙须菜多糖提取响应面优化结果
根据单因素实验结果,以A、B和C为实验中自变量,以粗多糖得率(Y)为响应值,进行响应面实验,结果如表2.
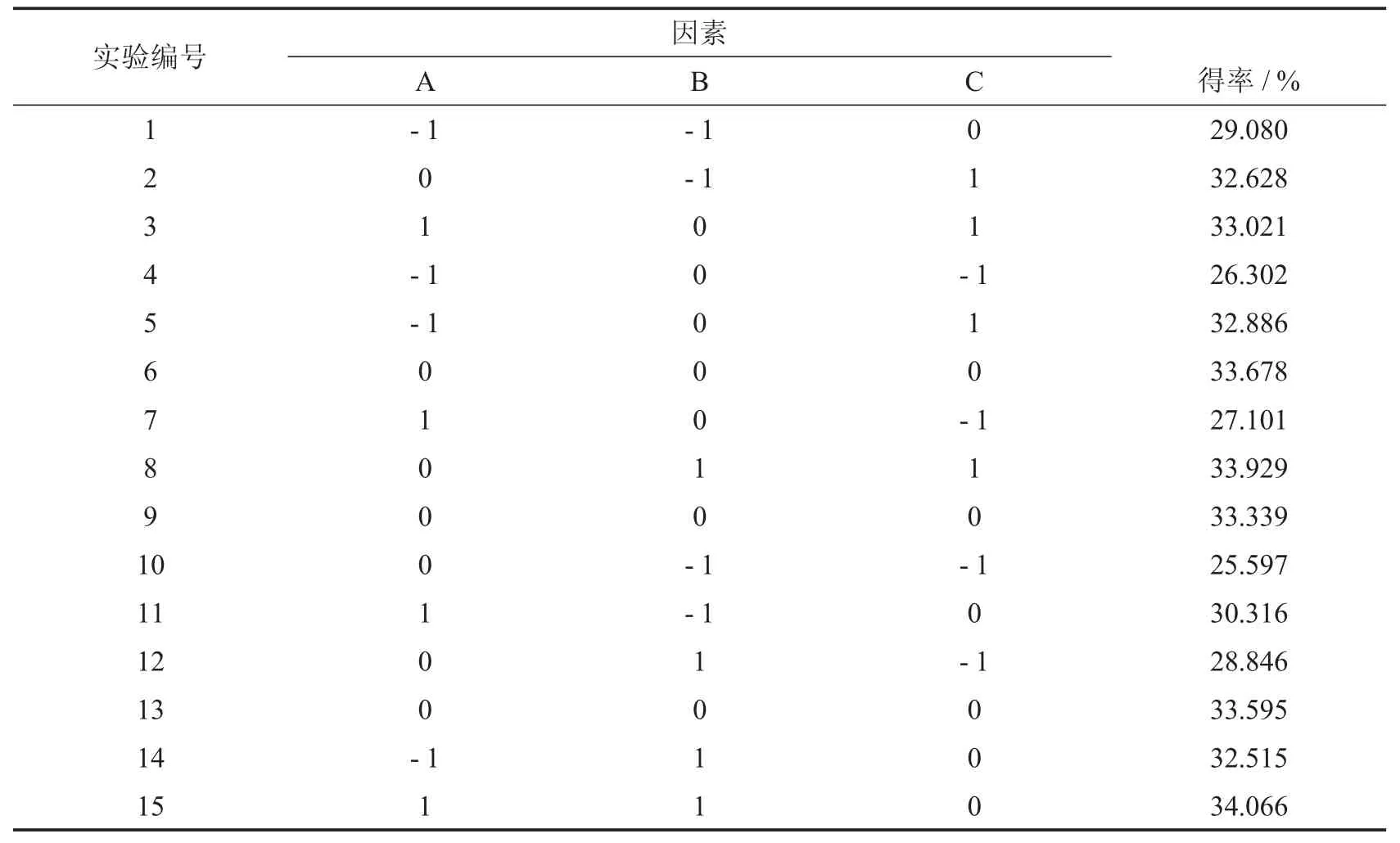
表2 响应面分析实验结果
对所得数据采用Minitab进行回归分析.得到模型回归方程的方差分析如表3所示.
根据表3回归模型方差实验结果,回归模型(P<0.01)极其显著,线性(P<0.01),平方(P<0.01),这些数据表明回归模型可以很好地反映多糖得率与单因素的关系.此外,模型回归(P<0.01)极其显著,失拟(P>0.05)不显著,说明回归模型与预测值之间有良好的拟合度,因此该模型可以用于预测龙须菜多糖得率的实际情况.
由表4可知,自变量A、B、C对多糖得率的影响大小关系为C>B>A,即:料液比>温度>提取时间;此外,因素B、C、A2、C2的P值均小于0.01,即对多糖提取得率的线性效应均极显著,因素B2对多糖得率Y影响显著,而其他因素不显著.
各因素回归拟合后得到如下回归方程:

当参数A=31.7 min,B=87℃,C=1:60.7时,在此最佳工艺条件下进行验证实验(n=3),结果表明,多糖提取得率为34.84%,与模型所得理论值34.96%相近,偏差较小.表明Box-Benhnken实验设计所得到的模型拟合度高,能较真实反映各实验因素对龙须菜多糖提取得率的影响,可用于优化龙须菜多糖的提取工艺.
图3为响应面分析的曲面图和等值线图,这些图可以直接看出各个因素及水平对多糖得率的直观影响.

表3 方差分析

表4 回归方程系数检验
3.4 双水相纯化龙须菜多糖
双水相体系对龙须菜多糖分配系数的影响结果如图4,从图中可以看出不同体系对GLP的分配系数不同,随着TLL增加,PEG1000/(NH4)2SO4分配系数表现为先增加后减小,这是由于PEG随着浓度增加,其对多糖分子的粘性增加,但由于PEG1000分子量偏小,继续增加浓度时,其对多糖的粘性变化较小,而(NH4)2SO4对多糖的滞留效果开始展现出来,因此随后出现了后减小的趋势;PEG1000,PEG2000,PEG4000/(NH4)2SO4的K表现为逐渐减小,表明多糖随着PEG分子量的增大逐渐分配到下相,PEG对多糖的粘性变化较小,而(NH4)2SO4对多糖的滞留效果开始展现出来;而乙醇/(NH4)2SO4体系中,下相比上相更多富集多糖,但是在乙醇-硫酸铵体系中出现明显中间相,多糖更多的被富集于中间相.这是因为乙醇为小分子有机物,可以对多糖起到排斥沉淀的作用.

图3 为响应面分析的曲面图和等值线图
乙醇/(NH4)2SO4体系中不同TLL下GLP在各相的回收率如下图5,从图中可以看出,随着TLL增加,GLP回收率逐渐增加,TLL=55时下相会有一部分盐析出影响实验结果,因此选择TLL=50,此时多糖大量富集在中间相,GLP回收率Y=81.1%.

图4 不同双水相体系对多糖的分配系数

图5 乙醇/(NH4)2SO4体系中不同TLL下多糖在各相的回收率
4 小结
通过双波辅助提取龙须菜粗多糖,并对此工艺过程进行响应面实验设计优化,优化的最佳工艺参数为:提取时间为31.7 min,微波温度87℃,提取过程料液比W/V为1:60.7,在此最佳工艺条件下龙须菜粗多糖提取得率为34.84%.随后,通过对不同类型的双水相体系进行筛选,获得一种可较好去除杂蛋白的双水相体系——乙醇/(NH4)2SO4双水相体系,此双水相体系可以在有效去除杂蛋白的同时,获得较高的粗多糖提取率,且所用试剂廉价并对环境污染低,证实了双波辅助提取结合双水相萃取的方法对龙须菜粗多糖的分离纯化开辟了一条简洁、绿色的提取工艺.
[1]安鑫龙,李雪梅,齐遵利,等.大型海藻龙须菜的生态特征[J].水产科学,2009,28(2):109-112.
[2]何清,马晓宇,峙苗.东海红藻龙须菜的营养成分分析及评价[J].食品科学,2010,31(9):284-287.
[3]陈美珍,王欣,余杰.龙须菜多糖的提取、分离及抗氧化活性的研究[J].汕头大学学报(自然科学版),2005,20(2):37-41.
[4]陈美珍,龙梓洁,余杰,等.龙须菜多糖抗突变和清除自由基作用的研究[J].食品科学,2005,26 (7):219-222.
[5]陈美珍,廖灶辉,余杰,等.龙须菜多糖抑瘤活性及对荷瘤小鼠抗氧化作用的研究[J].中国海洋药物杂志,2008,27(2):46-49.
[6]陈美珍,陈鸿霖,廖灶辉.龙须菜多糖硫酸基含量对抗流感病毒活性的影响[J].食品科学,2008,29 (8):587-590.
[7]陈美珍,余杰,杨拉维,等.龙须菜多糖硫酸化对免疫活性的影响[J].食品科学,2010,31(15):278-282.
[8]FAN Y L,SONG W,WANG W H,et al.Partial characterization and anti-tumor activity of an acidic polysaccharide from Gracilaria lemaneiformis[J].Carbohydrate Polymers,2012,88(4):1313-1318.
[9]潘迎,唐庆九,朱地琴,等.不同提取水温对龙须菜多糖的得率、组成和免疫活性的影响[J].浙江海洋学院学报,2012,31(5):365-401.
[10]郭守军,施楚彬,杨永利,等.龙须菜多糖提取工艺优化[J].中国酿造,2008,24:80-81.
[11]杨华.采用超声波技术提取台湾种龙须菜多糖的工艺研究[J].食品科技,2008(9):158-161.
[12]杨华,杨震峰.微波技术提取台湾种龙须菜多糖的工艺研究[J].中国食品学报,2008,8(6):53-57.
[13]杨华,庄陈丰.响应面法优化微波辅助提取龙须菜多糖工艺及其抗氧化活性研究[J].食品科学,2011,32(20):79-83.
[14]MUSSATTO S I,PASTRANA L,RODRIGUEZ-JASSO R M,et al.Microwave-assisted extraction ofsulfated polysaccharides(fucoidan)frombrown seaweed[J].Carbohydrate Polymers,2011,86(3):1137-1144.
[15]GAO H,ZHANG Z,ZENG W C,et al.Characterization ofantioxidant polysaccharides from Auricularia auricular using microwave-assisted extraction[J].Carbohydrate Polymers,2012,89(2):694-700.
[16]DIAMOMD A D,HSU J T.Aqueous two-phase systems for biomolecule separation[J].Advances in Biochemical Engineering/biotechnology,1992,47(16):89-135.
[17]陈美欣,冯元琦,刘杨,等.乙醇/硫酸铵双水相体系萃取螺旋藻多糖的研究[J].化学研究与应用,2012,24(12):1781-1785.
[18]金婷.双水相萃取芡实多糖工艺研究[J].中国食物与营养,2015,21(2):61-64.
Extraction of Polysaccharides from Gracilaria lamaneiformis by Ultrasonic-microwave-assisted Aqueous Two-phase System
YAN Xiaolin,LIU Yang
(Department of Biology,College of Science,Shantou University,Shantou 515063,Guangdong,China)
The ultrasonic-microwave-assisted extraction of polysaccharides from Gracilaria lamaneiformis was optimized by response surface methodology.The results showed that the optimumconditions for polysaccharides extraction were ultrasonic wave power of50 W,extraction time of 31.7 min,microwave temperature of 87℃and solid-liquid ratio of 1:60.7.Under the optimum conditions,the extraction yield of polysaccharides was 34.84%.Ethanol/(NH4)2SO4aqueous two-phase system can be better to remove the protein.The results showed that when the aqueous two-phase systemline length is 50,the recoveries of polysaccharides in the intermediate phase up to81.1%.The double-wave assisted extraction combined aqueous two-phase purification could be an effective technique for extraction ofpolysaccharides from Gracilaria lamaneiformis.
ultrasonic-microwave-assistedextraction;seaweedpolysaccharides;aqueoustwo-phase
Q5
A
2016-06-12
颜晓琳(1991—),女,研究生,硕士,主要研究方向:生物分离技术,E-mail:14xlyan@stu.edu.cn
刘 杨(1978—),女,教授,博士,主要研究方向:生物分离技术.E-mail:liuyanglft@stu.edu.cn
广东省高等学校优秀青年教师培养计划(Yq2013076);汕头科技计划项目(46).
1001-4217(2017)02-0010-08

