TNF-α对鼠根尖乳头干细胞增殖及多向分化能力的影响*
曹蓉蓉,马俊玥,李淑慧,马 玉,吴佩玲
(新疆医科大学第二附属医院口腔科,乌鲁木齐 830063)
TNF-α对鼠根尖乳头干细胞增殖及多向分化能力的影响*
曹蓉蓉,马俊玥,李淑慧,马 玉,吴佩玲△
(新疆医科大学第二附属医院口腔科,乌鲁木齐 830063)
目的 研究肿瘤坏死因子-α(TNF-α)对鼠根尖乳头干细胞(SCAP)增殖及多向分化能力的影响。方法 采用酶消化法结合组织块法获得SCAP,将细胞分为实验组(TNF-α浓度为5、10、20、50 ng/mL)和对照组(TNF-α浓度为0 ng/mL),使用四甲基偶氮唑蓝(MTT)法检测SCAP的增殖能力;采用茜素红染色及实时定量PCR(qRT-PCR)检测TNF-α对SCAP成骨/成牙本质能力的影响;油红O染色检测TNF-α对SCAP成脂能力的影响;qRT-PCR检测TNF-α对SCAP血管相关基因表达的影响。结果 体外培养SCAP符合间充质干细胞来源的特征且具有多向分化能力。MTT结果显示:与对照组相比,各浓度组均能促进SCAP增殖(P<0.05),其中10 ng/mL TNF-α的促进作用最为明显。茜素红染色结果显示:实验组随着TNF-α浓度的增加,矿化结节逐渐变小,形成数量也逐渐变少。qRT-PCR结果显示:3、7 d时,与对照组相比,实验组骨钙蛋白(OC)、牙本质涎磷蛋白(DSPP)、牙本质基质蛋白-1(DMP-1)表达量降低,3 d时两组OC、DMP-1比较差异有统计学意义(P<0.05);7 d时DMP-1比较差异有统计学意义(P<0.05);14 d时,实验组OC、DMP-1表达量明显降低(P<0.05)。油红O染色结果显示:与对照组相比,实验组随着TNF-α浓度的增加,脂滴形成数量逐渐减少。qRT-PCR结果显示:3、7天时,与对照组相比,血管生成素1、血管内皮生长因子A、血小板内皮细胞黏附分子-1表达量明显降低(P<0.05)。结论 炎性因子TNF-α对SCAP的增殖有明显促进作用但同时不同程度抑制SCAP多向分化能力。
干细胞;分生组织;肿瘤坏死因子α;根尖乳头干细胞;多向分化;大鼠,Wistar
2006年,Sonoyama等[1]从人未发育完全的第三磨牙根尖乳头组织中分离出新的间充质干细胞,命名为根尖乳头干细胞(stem cells from apical papilla,SCAP),并证实其具有高度的增殖、自我更新和多向分化潜能,并在一定的诱导条件下可向成骨/成牙本质、脂肪、软骨、肌肉、神经元等细胞分化。近年来,随着人们对SCAP的深入研究,证实SCAP在介导牙本质再生及牙根发育过程中发挥着极其重要的作用[2]。牙髓炎、根尖周炎是一种复杂的炎症反应,其中包含以肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)为主的多种炎性因子,且炎症的病变程度与炎性因子的水平存在着一定的相关性[3]。有研究结果显示,炎症微环境会影响干细胞的增殖和分化,甚至引起细胞凋亡[4];但对于炎性因子对SCAP分化能力的影响研究甚少。本实验拟通过不同浓度TNF-α对SCAP进行干预,从而研究炎性因子TNF-α对SCAP增殖及多向分化潜能的影响,为研究炎性环境下SCAP生物学特性的改变提供一定的实验基础。
1 材料与方法
1.1 材料 胎牛血清、α-MEM培养基、磷酸盐缓冲液(PBS)、青霉素链霉素溶液、0.25%胰蛋白酶、谷氨酰胺(Hyclone公司,美国),Ⅰ型胶原酶(Wor-thington公司,美国),TNF-α(Peprotech公司,美国),维生素C、B-甘油磷酸钠、地塞米松、吲哚美辛、3-异丁基-1-甲基黄嘌呤(IBXM)、茜素红粉剂(Sigma公司,美国),基质细胞抗原-1(STRO-1,Santa Cruz公司,美国),兔抗大鼠一抗CD90、CD146(北京博奥森生物技术有限公司,中国),油红O染液(南京建成生物工程研究所),荧光定量PCR试剂盒(Thermo公司,美国),光学显微镜、倒置显微镜(莱卡公司,德国),37 ℃细胞培养孵箱(力康生物医疗有限公司),超净工作台(苏州净化设备有限公司),酶标仪(Thermo公司,美国),荧光定量PCR仪(Bio-Rad公司,美国),Wistar大鼠(新疆医科大学动物实验中心)。本研究通过新疆医科大学第一附属医院动物实验医学伦理委员会批准(批准号:IACUC20150423-01)。
1.2 方法
1.2.1 鼠SCAP的培养 健康雄性Wistar大鼠2只,分离根尖乳头组织,剪碎、消化至絮状,离心后接种,每2~3天换液,观察细胞至80%~90%融合时,消化,按1∶3常规传代培养,取3~5代细胞用于后续实验。
1.2.2 细胞鉴定 免疫荧光法鉴定表面标志物STRO-1、CD90、CD146的表达。多向分化能力的鉴定:茜素红染色检测成骨能力;油红O检测成脂能力。
1.2.3 四甲基偶氮唑蓝(MTT)法检测TNF-α对SCAP增殖能力的影响 取第3代SCAP,以2×103/孔密度接种于96孔板,设实验组(TNF-α浓度为5、10、20、50 ng/mL)和对照组(TNF-α浓度为0 ng/mL),每组3个复孔,分别培养1、3、5、7 d,每孔加入5 mg/mL MTT溶液50 μL,37 ℃ 孵育4 h,加入150 μL二甲基亚砜(DMSO),测定各孔490 nm吸光度(A)值并记录。
1.2.4 检测成骨/成牙本质能力
1.2.4.1 茜素红染色 取第3代SCAP,以2×104/孔的密度接种于24孔板,设实验组和对照组,24 h后更换含相应浓度TNF-α的成骨诱导液,3周后茜素红染色,观察矿化结节的形成情况。
1.2.4.2 实时荧光定量PCR(qRT-PCR)检测成骨相关基因的表达 取第3代SCAP,以2×105/孔的密度接种于12孔板,设实验组(TNF-α浓度为10 ng/mL)和对照组(TNF-α浓度为0 ng/mL),培养24 h后,更换含相应浓度TNF-α的成骨诱导液,分别培养3、7、14 d,按步骤提取RNA,根据逆转录试剂盒说明配成20 μL体系合成cDNA,反应条件:42 ℃ 60 min,70 ℃ 5 min。目的基因骨钙蛋白(osteocalcin,OC)、牙本质基质蛋白-1(dentin matrix protein-1,DMP-1)、牙本质涎磷蛋白(dentin sialophosphoprotein,DSPP)及内参甘油醛-3-磷酸脱氢酶(GAPDH)由华大基因设计并合成(表1)。按试剂盒说明书配成25 μL体系进行实验,反应条件为50 ℃ 2 min,95 ℃ 10 min;95 ℃ 15 s,60 ℃ 30 s,72 ℃ 30 s,40个循环。每个目的基因重复3管,同时设置1管阴性对照,结果根据使用倍比关系2-△△Ct表示,其中ΔΔCt=ΔCt(实验组)-ΔCt(对照组)。
1.2.5 油红O检测SCAP成脂能力 取第3代SCAP,分为实验组(TNF-α浓度为5、10、20、50 ng/mL)和对照组(TNF-α浓度为0 ng/mL),培养24 h更换为含相应浓度TNF-α的成脂诱导液A,3 d后更换含相应浓度TNF-α的成脂液B 24 h,3个循环后,油红O染色,观察脂滴形成情况并记录。
1.2.6 qRT-PCR检测血管相关基因的表达 取第3代SCAP,以2×105/孔的密度接种于12孔板,设实验组(TNF-α浓度为10 ng/mL)和对照组(TNF-α浓度为0 ng/mL),培养24 h后,更换含相应浓度TNF-α的成骨诱导液,分别培养3、7、14 d,按步骤提取RNA,根据逆转录试剂盒说明配成20 μL 体系合成cDNA,反应条件:42 ℃ 60 min,70 ℃ 5 min。目的基因血管生成素1(angiogenin 1)、血管内皮生长因子A(vascular endothelial growth factor a,VEGFA)、血小板内皮细胞黏附分子-1(platelet endothelial cell adhesion molecule-1,PECAM-1)及内参GADPH由华大基因设计并合成(表1)。按试剂盒说明书配成25 μL体系进行实验,反应条件为50 ℃ 2 min,95 ℃ 10 min;95 ℃ 15 s,60 ℃ 30 s,72 ℃ 30 s,40个循环。每个目的基因重复3管,同时设置1管阴性对照,结果根据使用倍比关系2-△△Ct表示,其中ΔΔCt=ΔCt(实验组)-ΔCt(对照组)。

表1 qRT-PCR目的基因的引物序列

2 结 果
2.1 SCAP形态 原代培养3~5 d后,可见细胞从组织块边缘呈放射状生长,细胞形态多为短梭形,轮廓清楚,大小基本一致,生长状况良好,可稳定传代,约3~5 d可达到80%~90%汇合,见图1。
2.2 细胞鉴定 SCAP抗STRO-1呈弱阳性表达,抗CD90、CD146呈阳性表达。结果提示符合间充质干细胞来源的特征。茜素红染色阳性,证实SCAP具有成骨/成牙本质向分化的潜能;油红O染色阳性,倒置显微镜下可见胞质内有脂滴形成,证实SCAP具有成脂向分化的潜能。
2.3 MTT检测SCAP增殖能力 与对照组相比,各浓度组均能明显促进SCAP增殖,且差异有统计学意义(P<0.05),其中10 ng/mL TNF-α的促进作用最为明显,见图2。
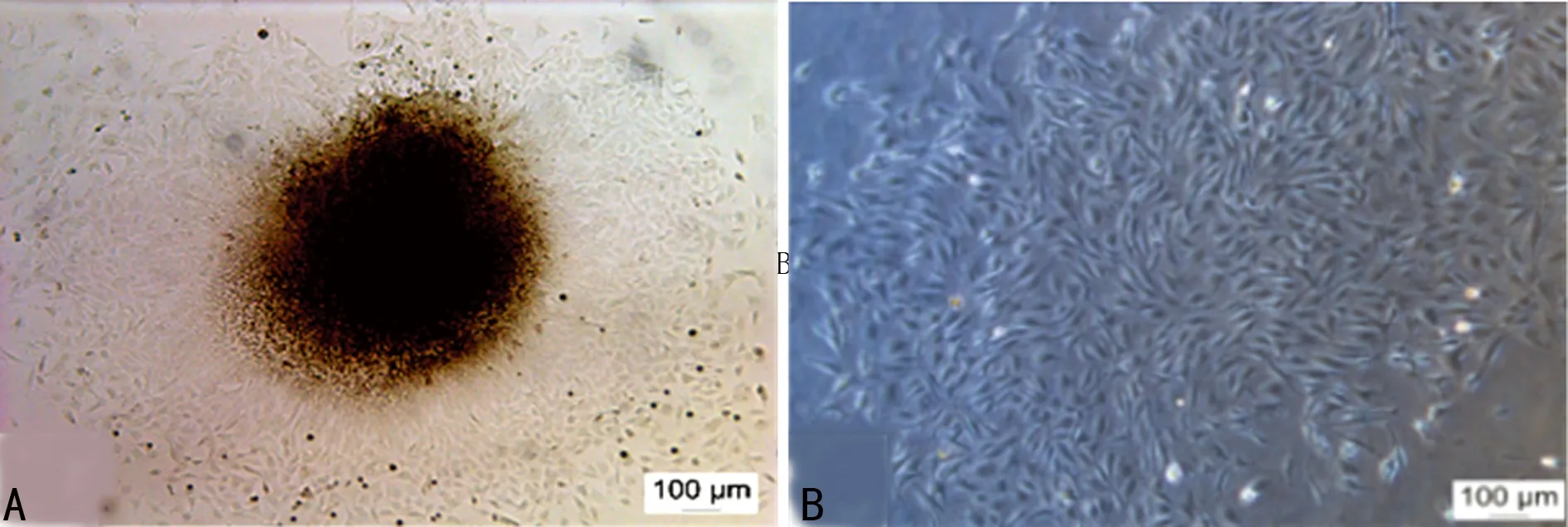
A:CAP原代第3天(×100);B:第3代SCAP(×100)。
图1 SCAP生长情况
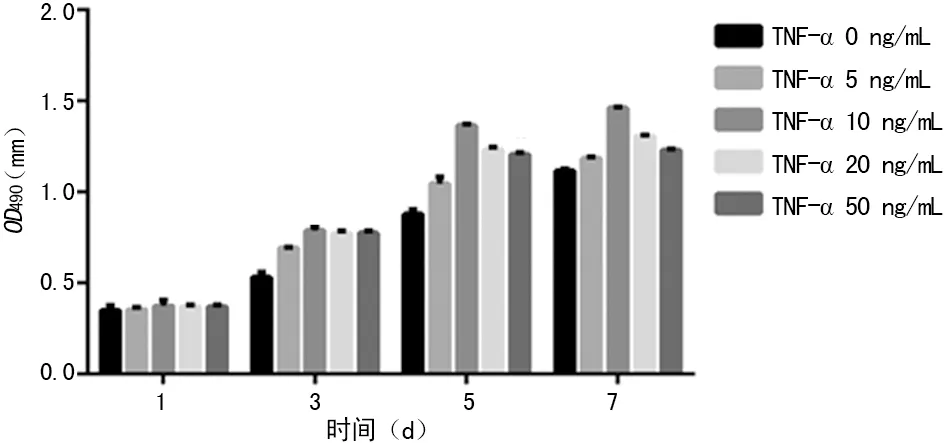
图2 不同浓度TNF-α刺激下SCAP的增殖能力
2.4 SCAP成骨/成牙本质能力的检测
2.4.1 茜素红染色结果 对照组染色后形成矿化结节较大、染色较深;与对照组相比,随着TNF-α浓度的增加,形成的矿化结节逐渐变小,数量也逐渐减少,见图3。
2.4.2 qRT-PCR结果 3、7 d时,与对照组相比,实验组OC、DSPP、DMP-1表达量降低。其中,3 d时两组OC、DMP-1比较差异有统计学意义(P<0.05);7 d时DMP-1比较差异有统计学意义(P<0.05);14 d时,实验组OC、DMP-1表达量明显降低(P<0.05),见表2。
2.5 油红O染色结果 对照组染色后可见胞质内大量红色大小不等的脂滴形成;与对照组相比,实验组随着TNF-α浓度的增加,脂滴形成数量逐渐减少,见图4。
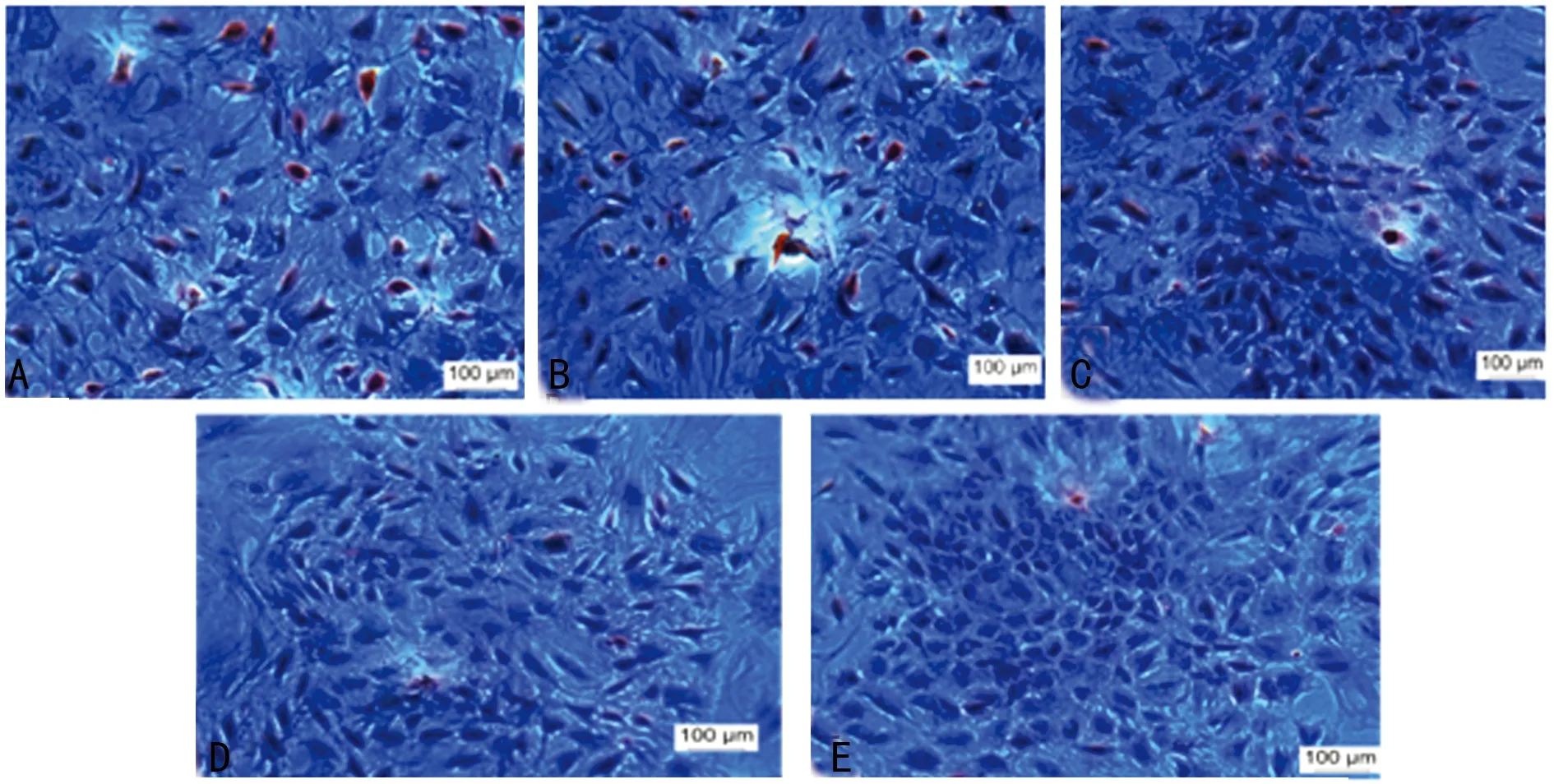
A:对照组;B:实验组(TNF-α 5 ng/mL);C:实验组(TNF-α 10 ng/mL);D:实验组(TNF-α 20 ng/mL);E:实验组(TNF-α 50 ng/mL)。
图3 SCAP经含不同浓度TNF-α的成骨诱导液诱导3周染色结果(×100)

A:对照组;B:实验组(TNF-α 5 ng/mL);C:实验组(TNF-α 10 ng/mL);D:实验组(TNF-α 20 ng/mL);E:实验组(TNF-α 50 ng/mL)。
图4 SCAP经含不同浓度TNF-α的成脂诱导液诱导后的油红O染色结果(×100)
2.6 SCAP成血管相关基因的表达情况 3、7 d时,与对照组相比,实验组ANGPT1、VEGFA、PECAM-1表达量明显降低,且比较差异有统计学意义(P<0.05),见表3。

表2 TNF-α刺激下SCAP成骨/成牙本质相关基因表达

表3 TNF-α刺激下SCAP血管相关基因表达
3 讨 论
临床研究表明,发生牙髓炎及根尖周炎的年轻恒牙经过彻底地清理和消毒后根尖仍能继续发育成形[5],并认为在此过程中SCAP可能发挥了关键的作用。随着研究的深入,学者们发现SCAP在介导牙本质再生及牙根发育过程中均发挥着极其重要的作用[6-7]。但牙髓炎及根尖周炎是一种复杂的炎症反应,当年轻恒牙发生牙髓炎及根尖周炎时,SCAP会暴露于炎性环境中,其中包含以TNF-α 为主的多种炎性因子,且研究表明炎性因子的刺激会改变干细胞的生物学特性,影响其增殖及分化能力[8-9],故明确炎性因子对SCAP增殖及多向分化能力的影响对牙髓牙本质复合体再生及根尖的持续发育成形有着不可忽视的作用。
Yang等[10]的研究也发现TNF-α可促进根尖乳头细胞增殖能力。刘彩奇等[11]研究发现10 ng/mL TNF-α可促进SCAP的增殖,提高克隆形成率。于莉等[12]研究也表明10 ng/mL TNF-α促进SCAP增殖作用最明显。本研究结果与以上研究基本一致,但同时发现随着TNF-α浓度的增加,促进SCAP增殖的作用并不会加强。这可能表明炎性因子TNF-α对SCAP的增殖作用具有浓度的依赖性,高浓度并不能增加促进增殖的作用。
TNF-α是1975年由Cors Wells发现的一种内毒素诱导的糖蛋白,到目前为止,研究者们发现TNF-α通常在健康的牙髓和根尖周组织中检测不到,而发生龋病、牙髓炎及根尖周炎时,牙髓组织和根尖周组织中炎性因子表达增加,其中TNF-α水平最高[13-15],这表明TNF-α在牙髓炎症及根尖周炎症的发生、发展过程中发挥了重要作用。也有学者研究表明TNF-α会抑制SCAP的成骨/成牙本质的能力[7-8]。本研究结果也显示TNF-α可抑制SCAP矿化结节的形成;抑制成骨、血管相关基因的表达;同时抑制SCAP成脂能力。本研究为牙髓牙本质复合体的再生及牙根继续发育提供一定的实验基础。
本研究采用酶消化法分离培养鼠SCAP,通过不同浓度的TNF-α对SCAP进行干预,结果表明TNF-α可促进SCAP的增殖能力,但同时会抑制其多向分化能力,为进一步研究在炎症微环境中SCAP生物学特性的改变及牙髓牙本质复合体再生提供了实验基础,也为临床治疗根尖周组织病变的提供了一定的理论依据。
[1]Sonoyama W,Liu Y,Fang D,et al.Mesenchyrmal stem cell-mediated functional tooth regeneration in swine[J].PLoS One,2006,1:e79.
[2]Jung IY,Kim ES,Lee CY,et al.Continued development of the root separated from the main root[J].J Endod,2011,37(5):711-714.
[3]Wisithphrom K,Windsor LJ.The effects of tumor necrosis factor-alpha,intefleukin-1 beta,interleukin-6,and transforming growth factor-betal on pulp fibroblast mediated collagen degradation[J].J Endod,2006,32(9):853-861.
[4]Hua P,Liu LB,Liu JL,et al.Inhibition of apoptosis by knockdown of caspase-3 with siRNA in rat bone marrow mesenchymal stem cells [J].Exp Biol Med,2013,238(9):991-998.
[5]Petrino JA,Boda KK,Shambarger S,et al.Challenges in regenerative endodontics:a case series[J].J Endod,2010,36(3):536-541.
[6]杨杰,赵玉鸣,王文君,等.犬根尖牙乳头干细胞的分离培养和生物学特性[J].北京大学学报,2012,44(6):921-926.
[7]于莉,李淑慧,周春梅,等.根尖乳头干细胞向牙髓牙本质复合体分化能力的实验研究[J].临床口腔医学杂志,2016,32(1):26-30.
[8]张欣然,刘翠,朱彪,等.肿瘤坏死因子-α诱导骨髓间充质干细胞凋亡作用的研究[J].牙体牙髓牙周病学杂志,2015,25(7):391-395.
[9]Izawa A,Ishihara Y,Mizutani H,et al.Inflammatory bone loss in experiment-al periodontitis induced by aggregatibacter actinomycetemcomitans in interleu-kin-1 receptor antagonist knockout mice[J].Infect Immun,2014,82(5):1904-1913.
[10]Yang H,Ma L,Han X,et al.The Effects of tumor neerosis factor-α on mineralization of human dental apical papilla cells[J].J Endod,2012,38(7):960-964.
[11]刘彩奇,陈柯,黄义彬,等.TNF-α对人根尖乳头干细胞增殖及分化能力的影响[J].口腔医学研究,2014,30(5):392-395.
[12]于莉,李淑慧,袁萍,等.TNF-α对根尖乳头干细胞体外增殖及成牙成骨向分化能力的影响[J].口腔医学研究,2016,32(4):343-346.
[13]Pezelj-Ribaric S,Anic I,Brekalo I,et al.Detection of tumor necrosis factor alpha in normal and inflamed human dental pulps[J].Arch Med Res,2002,33(5):482-484.
[14]Gumus P,Nizam N,Lappin DF,et al.Saliva and serum levels of B-cell activ-eating factors and tumor necrosis factor-alpha in patients with periodontitis [J].J Periodontol,2014,85(2):270-280.
[15]黄海云.TNF-α对牙周膜干细胞和骨髓间充质干细胞增殖和成骨分化及骨创伤修复影响的研究[D].山东:山东大学,2012.
Effect of tumor necrosis factor-α on the proliferation and multi-directional differentiation of stem cells from rat apical papilla*
CaoRongrong,MaJunyue,LiShuhui,MaYu,WuPeiling△
(DepartmentofStomatology,theSecondAffiliatedHospitalofXinjiangMedicalUniversity,Urumqi,theXinjiangUygurAutonomousRegion830063,China)
Objective To evaluate the biological effect of tumor necrosis factor-α(TNF-α) on the proliferation and multi-directional differentiation of stem cells from rat apical papilla(SCAP).Methods SCAP was extracted by combining enzyme digestion method with tissue block method.The cells were divided into control group(TNF-α 0 ng/mL) and experimental group(TNF-α 5,10,20,50 ng/mL).The ability of proliferation of SCAP was measured by MTT method.The ability of osteogenic/dentinogenic differentiation of SCAP was measured by alizarin red staining and quantitative real-time PCR.The ability of adipogenic of SCAP was measured by oil red O staining.The expression of vascular related genes of SCAP was measured by quantitative real-time PCR.Results SCAP was consistent with the characteristics of mesenchymal stem cells and possessed the ability of multi-directional differentiation.The MTT results showed that experimental group promoted the proliferation of SCAP in comparison with the control group.The difference was statistically significant(P<0.05),and 10 ng/mL was the optimum concentration.The results of alizarin red staining showed that with the increase of the concentration of TNF-α,the mineralized nodules in the experimental group gradually became smaller,and the number of the formation decreased gradually.The results of quantitative real-time PCR showed that the expression of OC,DMP-1 and DSPP in the experimental group was significantly lower than that of the control group at 3 and 7 days,in which the expression of OC was statistically significant different(P<0.05);at 14 days,the expression of OC,DMP-1 in the experimental group was significantly lower than that of the control group(P<0.05).The result of Oil red O staining showed that with the increase of the concentration of TNF-α,the lipid droplets formation in the experimental group gradually decreased.The result of quantitative real-time PCR showed that the expression of ANGPT1,VEGFA,PECAM-1 in the experimental group was significantly lower than that of the control group(P<0.05).Conclusion TNF-α might promote the proliferation and inhibit the multi-directional differentiation of SCAP.
stem cells;meristem;tumor necrosis factor-α;stem cells from rat apical papilla;multi-directional differentiation;rats,Wistar
著·
10.3969/j.issn.1671-8348.2017.14.002
国家自然科学基金资助项目(81460103)。 作者简介:曹蓉蓉(1992-),在读硕士,主要从事牙体牙髓学方面研究。△
,E-mail:wplkq@sina.com。
R781.3
A
1671-8348(2017)14-1874-04
2016-11-20
2017-01-08)

