萱草花黄酮对酒精性肝损伤氧化应激及肝细胞凋亡机制的探讨*
徐 博,李 妍,纪朋艳,齐 玲,路 倩,吴畏难,沈 楠△
(1吉林医药学院基础医学院,吉林吉林 132013;2吉林医药学院检验学院,吉林吉林 132013;3吉林市中心医院,吉林吉林 132011)
论著·基础研究
萱草花黄酮对酒精性肝损伤氧化应激及肝细胞凋亡机制的探讨*
徐 博1,李 妍2,纪朋艳1,齐 玲1,路 倩1,吴畏难3,沈 楠1△
(1吉林医药学院基础医学院,吉林吉林 132013;2吉林医药学院检验学院,吉林吉林 132013;3吉林市中心医院,吉林吉林 132011)
目的 探讨萱草花黄酮对急性酒精性肝损伤小鼠肝细胞凋亡及相关蛋白表达的影响。方法 40只小鼠分为4组,分别为空白对照组、模型对照组和萱草花黄酮低、高剂量组,每组各10只。连续灌胃给药7 d,末次给药1 h后,造模组小鼠一次性灌胃50%乙醇12 mL/kg,空白对照组给予同体积蒸馏水。测定各组小鼠血清中天冬氨酸转氨酶(AST)和丙氨酸转氨酶(ALT)活性;肝组织匀浆超氧化物歧化酶(SOD)、丙二醛(MDA)水平;HE染色观察肝脏病理学改变;利用流式细胞仪检测肝细胞悬液中细胞凋亡率;Western blot检测肝细胞caspase-3、Bcl-2和Bax蛋白的表达。结果 萱草花黄酮各组可降低血清AST、ALT活性;还可降低肝组织匀浆MDA水平,提高SOD的活性;肝组织病理学检查可见,萱草花黄酮高剂量组可使肝细胞变性、坏死的程度明显减轻,缓解肝组织的病理学改变;与模型组比较,萱草花黄酮各组肝细胞的凋亡率均有明显下降;Western blot结果显示萱草花黄酮各组caspase-3蛋白水平降低,Bcl-2蛋白表达增加,而Bax蛋白表达减少,Bax/Bcl-2比值降低。结论 萱草花黄酮对小鼠急性酒精性肝损伤具有明显的保护作用并且能够抑制肝细胞凋亡,其作用机制可能与其抗氧化作用及调节凋亡相关蛋白caspase-3、Bcl-2和Bax的表达有关。
萱草花黄酮;肝疾病,酒精性;抗氧化;细胞凋亡
目前,酒精依赖与酒精滥用已经成为我国乃至世界备受关注的重大问题。长期大量或短期过量饮酒可导致酒精性肝病(alcoholic liver disease,ALD) 的发生,此病初期通常表现为脂肪肝,进而依次发展为酒精性肝炎、肝纤维化及肝硬化,严重酗酒时可诱发广泛肝细胞坏死甚至肝衰竭[1-2]。多项实验研究表明,肝细胞凋亡是ALD发生发展的一项重要原因[3]。萱草花的主要药理作用是镇静安神,也具有抗抑郁等作用[4],但其中萱草花黄酮对急性酒精性肝损伤的研究却少见报道。本文拟探讨萱草花黄酮是否对小鼠急性酒精性肝损伤肝细胞的凋亡具有干预作用,为中医中药防治急性ALD的临床应用提供可靠的理论依据。
1 材料与方法
1.1 动物 清洁级健康小鼠40只,雌雄各半,购于吉林大学实验动物中心,许可证号SCXK(吉):2010-0005。饲料充足,饮水不限,室温20~25 ℃,适应环境3 d后使用。
1.2 材料及设备 萱草花黄酮(浓度为1.816 mg/mL,由吉林医药学院药学院提取)、无水乙醇(纯度99.7%,天津市永大化学试剂有限公司,批号:20130902),使用时用生理盐水溶解至相应浓度。考马斯亮蓝试剂盒、天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)、超氧化物歧化酶(SOD)、丙二醛(MDA)试剂盒(中国南京建成生物工程研究所),Annexin-V-GFP 凋亡检测试剂盒(南京基凯生物技术有限公司),β-Actin、caspase-3、Bcl-2和Bax抗体(北京中杉公司)。BA300数码生物显微镜(中国麦克奥迪实业集团有限公司),TD5A台式低速离心机(湖南凯达科学仪器有限公司),722可见光分光光度计(上海欣茂仪器有限公司),流式细胞仪为EPICS-XL型(美国贝克曼公司)。
1.3 方法[5-7]
1.3.1 动物分组与处理 清洁级小鼠40只,体质量20~30 g,将其分为空白对照组(A组)、模型组(B组)、萱草花黄酮低剂量(0.908 mg/mL)组(C组)、萱草花黄酮高剂量(1.816 mg/mL)组(D组)各10只。灌胃给药预处理7 d,末次给药1 h后,B、C、D组小鼠给予50%乙醇12 mL/kg一次性灌胃制备肝损伤模型,A组给予同体积蒸馏水,各组灌胃体积均为0.1 mL/10 g。在全部小鼠末次给药禁食禁水12 h后采集标本。
1.3.2 指标测定 小鼠造模12 h后摘眼球取血,每只小鼠约取血0.8~1.0 mL,分离血清,-80 ℃冻存。小鼠经断髓处死后,迅速取肝脏,冷生理盐水中洗净血液,将肝左叶用滤纸吸干后在同一部位取下并置于10%中性福尔马林中固定,待做病理。取肝组织50 mg,加入9 倍量的冷生理盐水中制成10%肝组织匀浆,离心后取上清液待测。按试剂盒说明书进行ALT、AST、SOD、MDA检测。
1.3.3 肝脏病理检测 上述肝组织经10%甲醛溶液固定后,石蜡包埋,切片厚5 μm。常规HE染色后于显微镜下观察、拍照。
1.3.4 细胞凋亡分析 将肝组织研碎,用磷酸缓冲盐溶液(PBS)洗涤2次,用结合缓冲液调至浓度为3×108/mL的细胞悬液,取200 μL 结合缓冲液重悬细胞,加入 5 μL Annexin-V-GFP 工作液,室温下避光30 min;结合缓冲液洗涤细胞 2 次,300 μL 结合缓冲液重悬细胞后,加入碘化丙啶(PI)溶液5 μL混匀,随后立即用流式细胞仪分析。
1.3.5 Western blot 检测肝组织中caspase-3、Bcl-2和Bax表达 取肝组织,匀浆、提取总蛋白。加入 SDS-PAGE 凝胶电泳分离蛋白,转膜,封闭,抗caspase-3、Bcl-2和Bax的一抗分别1∶1 000稀释,4 ℃孵育过夜,HRP 二抗孵育1 h,洗膜3次后曝光显影,实验组的表达水平与对照组相比为相对表达量。

2 结 果
2.1 萱草花黄酮对酒精性肝损伤小鼠血清中ALT、AST活力的影响 结果表明,B组ALT、AST 的酶水平与A组相比均明显升高(P<0.01),说明肝细胞受损,显示造模成功。C、D组血清 ALT、AST 水平与B组相比均明显降低,差异有统计学意义(P<0.05),见表1。
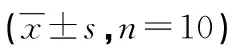
表1 各组小鼠血清中ALT、AST水平比较
a:P<0.01,与A组比较;b:P<0.05,与B组比较。
2.2 萱草花黄酮对酒精性肝损伤小鼠肝组织匀浆中MDA、SOD水平的影响 结果表明,造模后B组肝脏SOD水平显著低于A组,MDA水平高于A组(P<0.05),提示造模成功。C、D组小鼠肝脏的SOD水平较B组显著增加,MDA水平明显递减(P<0.05,P<0.01),见表2。
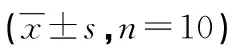
表2 各级小鼠肝匀浆中MDA、SOD水平比较
a:P<0.05,与A组比较;b:P<0.05;c:P<0.01,与B组比较。
2.3 萱草花黄酮对酒精性肝损伤肝脏病理形态的影响 光镜下,A组小鼠肝小叶和胞核结构较清晰;B组肝小叶内肝窦变窄,大部分肝细胞发生水肿变性,并可见点状坏死及炎细胞浸润;与B组比较,C、D组肝细胞水肿、变性、坏死减轻,病理改善明显,以D组为著,见图1。
2.4 萱草花黄酮对酒精性肝损伤小鼠肝细胞凋亡的影响 流式细胞仪分析见图2,左下和右下象限分别代表活细胞和早期凋亡细胞的百分率。结果表明,A、B、C、D组早期肝细胞凋亡率(%)分别为:1.57±0.52、16.86±1.99、4.05±0.11、3.38±0.15。与A组比较,B组发生明显凋亡(P<0.01),与B组比较,C、D组可明显抑制细胞凋亡(P<0.01)。
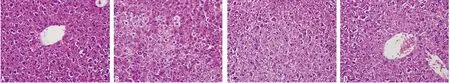
A:A组;B:B组;C:C组;D:D组。
图1 各组小鼠肝脏病理形态的影响(×200)
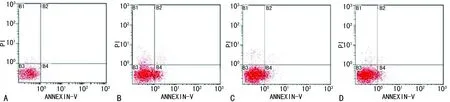
A:A组;B:B组;C:C组;D:D组。
图2 各组小鼠肝细胞凋亡的影响
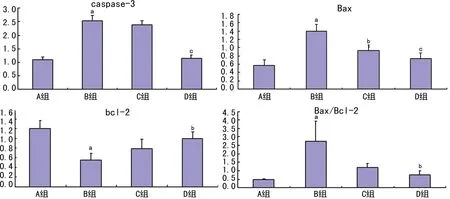
a:P<0.01,与A组比较;b:P<0.05,c:P<0.01,与B组比较。
图3 各组小鼠肝细胞凋亡蛋白caspase-3、Bcl-2和Bax表达的影响
2.5 萱草花黄酮对急性酒精性肝损伤小鼠肝细胞凋亡蛋白caspase-3、Bcl-2和Bax表达的影响 Western blot可见(图 3、4),B组caspase-3和Bax表达显著增加(P<0.01),Bcl-2蛋白表达明显减少;与B组相比,D组caspase-3和Bax表达显著降低 (P<0.01),Bcl-2表达明显升高(P<0.05),Bax/Bcl-2比值显著降低,差异有统计学意义(P<0.05)。
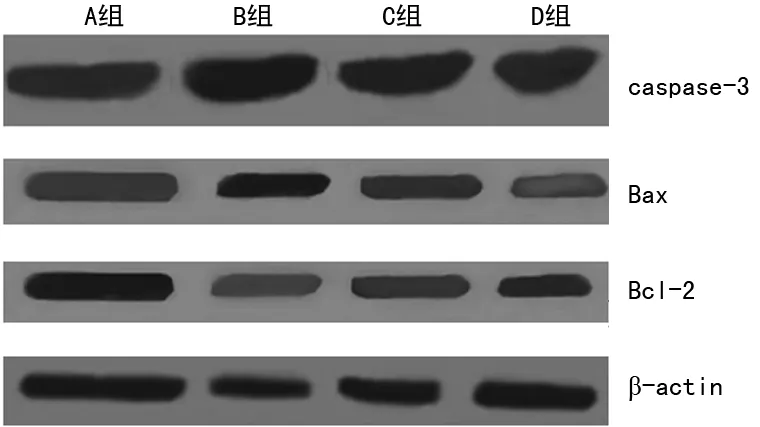
图4 各组小鼠肝细胞凋亡相关蛋白的表达(Western blot)
3 讨 论
饮酒时间长或过量饮酒均可导致ALD的发生。乙醇进入体内后主要在肝脏代谢,可引起肝脏脂质过氧化反应,使肝细胞膜及细胞器结构遭到破坏从而引起代谢和功能方面的障碍[8-9]。如何能利用我国中药资源开发解酒保肝的药物及保健品已受到广泛关注。本实验采用一次性给予大量乙醇灌胃的方法建立小鼠急性酒精性肝损伤模型,与人类一次性大量饮酒导致的肝损伤类似。
ALT与AST是肝细胞损害的敏感指标,也是乙醇所致肝损伤最敏感的标志。当肝细胞受损伤时,存在于肝细胞浆内的ALT与AST可进入血中,引起血清中二者水平升高,可认为其水平反映了肝细胞损伤程度[10-12]。在本研究中,乙醇灌注造模导致AST和ALT迅速增加,这表明肝细胞膜受到损伤。萱草花黄酮各组均能抑制乙醇引起的血清中AST、ALT的上升(表1),从而减轻小鼠肝细胞的损伤程度,这表明其对肝细胞膜有保护、修复和稳定作用。
由肝组织匀浆指标的比较可见,模型组小鼠肝脏MDA水平显著高于正常对照组,SOD活力明显降低,表明肝脏损伤时肝内脂质过氧化反应增强而抗氧化反应酶活性减低;而给予萱草花黄酮的高、低两个剂量组肝功能指标均有不同程度的改善,其中D组在对MDA的抑制作用方面和SOD活力升高方面尤其明显(表2),可见萱草花黄酮可以显著提高肝脏SOD活性,降低MDA水平,增强机体清除自由基的能力,减轻其对小鼠肝脏的损害[13],但仍需实验进一步证实。
病理实验结果显示,模型组小鼠肝小叶内肝窦变窄,大部分肝细胞发生水肿变性,并可见点状坏死及炎细胞浸润,可能是酒精对肝组织造成了一定的肝损伤;与B组比较,各给药组病理改善明显,细胞水肿、变性、坏死程度明显减轻,以D组改善显著(图1)。
凋亡是指在生理或病理信号刺激下,细胞启动自身凋亡基因发生的主动自杀行为,涉及一系列基因的激活与表达,近期研究表明乙醇是肝细胞的一种凋亡诱导剂,细胞凋亡被认为是引发ALD的主要机制[14]。caspase是一个在细胞凋亡中起关键作用的酶家族,在本研究中对caspase-3的活性进行了检测,它是内源性和外源性凋亡信号通路共同活化的关键酶[15]。实验结果显示,与A组相比,乙醇灌胃12 h后,caspase-3活性明显升高,即反映了肝细胞凋亡的发生。Bcl-2和Bax是主要的细胞凋亡调控基因,Bcl-2抑制细胞凋亡,Bax促发细胞凋亡,Bcl-2与Bax的比例决定细胞凋亡是否发生[16-17]。本实验结果显示(图2、3和表3),与A组比较,模型小鼠出现了明显的肝组织损伤和细胞凋亡。与B组比较,D组都能显著减少肝细胞早期凋亡百分数和caspase-3、Bax蛋白的表达(P<0.01);显著增加小鼠肝细胞Bcl-2蛋白的表达(P<0.05);Bax/Bcl-2比值显著降低(P<0.05)。提示萱草花黄酮对减轻肝细胞变性、坏死等损伤性变化,减少肝细胞凋亡具有重要作用,其抗凋亡机制可能与上调抑制凋亡蛋白Bcl-2蛋白的表达,下调促凋亡蛋白Bax蛋白,降低Bax/Bcl-2二者的比值,抑制caspase-3等途径有关[18-21],从而降低了乙醇对细胞的促凋亡作用。结果表明,D组对乙醇所致小鼠急性肝损伤具的保护作用机制可能与调节凋亡相关蛋白caspase-3、Bcl-2和Bax的表达有关。
本研究进一步证明氧化应激和肝细胞凋亡与急性酒精性肝损伤的发病机制有关,并且也说明萱草花黄酮具有增强内源性氧自由基清除系统和抑制肝细胞凋亡的功能,它对乙醇导致的急性肝损伤具有保护作用。
[1]高潇雪,刘立新.酒精性肝病流行病学及发病机制研究进展[J].中华消化病与影像杂志,2016,6(2):62-65.
[2]延华,张粉利,高艳琼,鲁晓岚,罗金燕.饮酒与酒精性肝病流行病学调查研究[J].陕西医学杂志,2015,44(7):917-920.
[3]Wu D,Cederbaum A.Oxidative stress and alcoholic liver disease[J].Semin Liver Dis,2009,29(2):141-154.
[4]郭冷秋,张颖,张博,张鹏.萱草根及萱草花的化学成分和药理作用研究进展[J].中华中医药学刊,2013,31(1) :74-76.
[5]林晓晖,黄玲,王一铮,等.小鼠急性酒精性肝损伤模型的制备及观察[J].北方药学,2014,11(6):67-69.
[6]陈奇.中药药理研究方法学[M].2版.北京:人民卫生出版社,2006:1169.
[7]王春梅,李贺,李生,等.北五味子木脂素对小鼠酒精性肝损伤的保护作用[J].食品科学,2014,35(13):262-265.
[8]Harrison-Findik DD.Is the Iron regulatory hormone hepcidin a risk factor for alcoholic liver disease?[J].World J Gastroenterol,2009,15(10):1186-1193.
[9]Uemura M,Fujimura Y,Matsuyama T,et al.Potential role of ADAMTS13 in the progression of alcoholic hepatitis[J].Curr Drug Abuse Rev,2008,1(2):188-196.
[10]Yin HQ,Choi YJ,Kim YC,et al.Salvia miltiorrhiza Bunge and its active component cryptotanshinone protects primary cultured rat hepatocytes from acute ethanol-induced cytotoxicity and fatty infiltration[J].Food Chem Toxicol,2009,47(1):98-103.
[11]Tiniakos DG.Liver biopsy in alcoholic and non-alcoholic steatohepatitis patients[J].Gastroenterol Clin Biol,2009,33(10/11):930-939.
[12]Zhao J,Chen H,Li Y.Protective effect of bicyclol on acute alcohol-induced liver injury in mice[J].Eur J Pharmacol,2008,586(1/2/3):322-331.
[13]Demir I,Kiymaz N,Gudu BO,et al.Study of the neuroprotective effect of ginseng on superoxide dismutase(SOD) and glutathione peroxidase(GSH-Px) levels in experimental diffuse head trauma[J].Acta Neurochirurgica,2013,155(5):913-922.
[14]Khanal T,Choi JH,Hwang YP,et al.Saponins isolated from the root of Platycodon grandiflorum protect against acute ethanol-induced hepatotoxicity in mice[J].Food Chem Toxicol,2009,47(3):530-535.
[15]Pellegrini M,Bath S,Marsden VS,et al.FADD and caspase-8 are required for cytokine-induced proliferation of hemopoietic progenitor cells[J].Blood,2005,106(5):1581-1589.
[16]Brandon-Warner E,Schrum LW,Schmidt CM,et al.Rodent models of alcoholic liver disease:of mice and men[J].Alcohol,2012,46(8):715-725.
[17]Brooks C,Dong Z.Regulation of mitochondrial morphological dynamics during apoptosis by Bcl-2 family proteins:a key in Bak?[J].Cell Cycle,2007,6(24):3043-3047.
[18]赵志明,杜元杰,左一鹏,等.中药何首乌饮对大鼠卵巢颗粒细胞凋亡相关蛋白Bcl-2,Bax表达的影响[J].现代中西医结合杂志,2012,21(23):2530-2533,2564.
[19]汤小刚,王军伟,洪汝涛,等.乌药不同提取部位对急性酒精性肝损伤模型大鼠的抗氧化作用研究[J].中华中医药学刊,2014,32(12):2934-2936.
[20]靳雅玲,欧士钰.Bcl-2、Bax与肝纤维化关系的研究进展[J].临床医学工程,2013,20(1):124-126.
[21]Li G,Ren J,Xu F,et al.Non-structural and nucleocapsid proteins of Punta Toro virus induce apoptosis of hepatocytes through both intrinsic and extrinsic pathways[J].Microbiol Immunol,2010,54(1):20-30.
Study on mechanism of total flavonoids from hemerocallis fulva on oxidative stress and hepatocyte apoptosis in alcoholic liver injury*
XuBo1,LiYan2,JiPengyan1,QiLing1,LuQian1,WuWeinan3,ShenNan1△
(1.BasicMedicalCollegeofJilinMedicalCollege,Jilin,Jilin132013,China;2.CollegeofClinicalLaboratory,JilinMedicalCollege,Jilin,Jilin132013,China;3.JilinMunicipalCentralHospital,Jilin,Jilin132011,China)
Objective To study the influence of total flavonoids of hemerocallis fulva(TFHF) on hepatocyte apoptosis and related protein expression in mice with alcoholic hepatic injury.Methods A total of 40 mice were randomly divided into four groups:blank control,model control and small and high dose TFHF groups,10 cases in each group.The mice were given the continuous gavage administration for 7 d.Then the model group was given once gavage by 50% ethanol 12.0 mL/kg after 1 h of the last administration.The blank control group was given the equal volume of distilled water.The activity levels of alanine aminotransferase (ALT) and aspartate aminotransferase (AST) in serum as well as the superoxide dismutase(SOD) activity and malondialdehyde (MDA) content in liver tissue hemogenate were detected.Hematoxylin and Eosin(HE) staining was performed for observing the pathological changes of the liver tissue.The flow cytometer was used to test the apoptosis ratio in hepatocyte suspension.The expressions of caspase-3,Bcl-2 and Bax protein were detected by Western blot.Results The various TFHF groups could decrease the activities of ALT and AST in serum (P<0.05),while could decrease the MDA content in liver tissue hemogenate (P<0.01) and increased the SOD activity ;the liver tissue pathological examination showed that the high dose TFHF group could make the liver cell degeneration,alleviated the necrosis degree and relieved the pathological change of hepatic tissue;compared with the model group,the hepatocyte apoptosis rate in each TFHF group was decreased significantly;Western blotting results showed that the caspase-3 protein level in each TFHF group was decreased,expression of Bcl-2 protein was increased,whereas which of Bax protein was decreased and Bax/Bcl-2 ratio was reduced.Conclusion TFHF has obvious protective effect on mice acute hepatic injury induced by ethanol,and can inhibit the hepatocyte apptosis,its action mechanism may be related to its antioxidation and regulation of caspase-3,Bcl-2 and Bax expression.
flavonoids of hemerocallis fulva;liver disease,alcoholic;antioxidation;apoptosis
10.3969/j.issn.1671-8348.2017.10.003
吉林省教育厅基金资助课题(2013359);吉林省科技厅发展计划项目(20140203012YY)。 作者简介:徐博(1984-),实验师,硕士,主要研究领域为中药药理学。△
,E-mail:86027640@qq.com。
R285.5
A
1671-8348(2017)10-1304-04
2016-11-18
2017-01-22)

