人表皮干细胞体外诱导分化为汗腺样上皮细胞的研究*
王元元,杨桂红,杨 涛,唐书谦,伍津津△
(第三军医大学大坪医院野战外科研究所:1.整形美容科;2.皮肤科,重庆 400042)
·论 著·
人表皮干细胞体外诱导分化为汗腺样上皮细胞的研究*
王元元1,杨桂红2,杨 涛2,唐书谦2,伍津津2△
(第三军医大学大坪医院野战外科研究所:1.整形美容科;2.皮肤科,重庆 400042)
目的 探讨体外人表皮干细胞向汗腺样上皮分化的影响条件,并对诱导成的管腔样结构进行鉴定。方法 将人表皮干细胞接种到复方壳多糖真皮基质上和胶原凝胶中,加入不同浓度的表皮生长因子(EGF),体外垂直震荡培养,进行三维培养和定向诱导分化,采用HE染色、免疫荧光等手段观察表皮干细胞定向分化为汗腺样上皮的条件及形态、表型改变。结果 15~20 ng/mL的EGF可诱导组织工程真皮上的表皮干细胞向真皮内生长并可出现腺样结构。HE 染色该结构,显示为单层细胞连接为环状,中间见明显的腔隙,细胞质嗜酸性。利用CK19荧光染色,在激光共聚焦显微镜下观察到细胞团中央有管腔结构,同时此结构表达CK18、癌胚抗原(CEA)。结论 体外培养的人表皮干细胞接种在组织工程真皮上,在一定浓度的EGF诱导条件下,能形成管腔样结构,该管腔样结构在形态学、组织学上与在体汗腺分泌部细胞相似。
表皮干细胞;汗腺样细胞;分化;表皮生长因子
临床上由于各种原因,如皮肤全层大面积烧伤、缺损和其他伴有汗腺发育和功能异常的疾病(如先天性外胚层发育不良等),导致的汗腺结构和功能缺失,排汗及体温调节能力受限,严重影响了患者的生活质量。尽管近年来组织工程化皮肤用于临床治疗,可以解决创面覆盖的问题,已取得了显著效果,但迄今为止,还未研制出带有皮肤附件(如汗腺、毛囊等) 的组织工程化皮肤,无法达到皮肤功能的重建[1]。表皮干细胞(ESC)是皮肤组织特异性干细胞,位于表皮基底层,在维持表皮更新,保持细胞恒定等方面起着重要作用。ESC具有多向分化潜能,体内证实能够向皮肤附属器及表皮分化。若能在体外诱导ESC向汗腺分化,将为研究带汗腺的组织工程皮肤提供重要实验依据。本院自行研制的复方壳多糖组织工程真皮基质凝胶是一种组织工程培养模型。利用此三维培养模型,本实验拟加入影响细胞生长和分化的因素,如表皮生长因子(EGF)等,以促进凝胶中的ESC向汗腺样上皮分化。进而寻找出ESC向汗腺样上皮分化的合适培养条件,并对出现的管腔样结构进行形态鉴定。
1 资料与方法
1.1 一般资料 包皮标本取材于2009年5月至2010年4月在本院皮肤科医学美容门诊行包皮环切术的青年男性20例,平均年龄(23.56±2.43)岁,所有取材均取得患者同意并签署知情同意书,本研究通过本院伦理委员会审查(批号为20080312)。
1.2 主要试剂及仪器 K-SFM培养基,Ⅳ型胶原(美国Sigma公司),中性分离酶(瑞士Roche公司),胰蛋白酶(美国Hyclone公司),胎牛血清(FBS),杜尔伯科改良伊格尔培养基DMEM(美国Gibco公司),EGF(美国Sigma公司),壳多糖,兔抗人CEA抗体,鼠抗人CK18、19抗体,羊抗鼠IgG-FITC抗体(北京中杉公司),激光共聚焦显微镜(德国Leica公司)。
1.3 方法
1.3.1 鼠尾胶原的制备 冻存300 g左右大白鼠鼠尾3根,于75%乙醇溶液中解冻1 h;去皮,D-Hanks液冲洗3遍,抽出尾腱,剪碎成泥,溶于无菌的1%冰醋酸250 mL中,4 ℃保存48 h以上,其间反复振荡;3 000 r/min离心1 h,取上清液;所得物位乳白色半透明黏稠液体,4 ℃贮存备用,测得浓度为20 mg/mL(湿质量)。
1.3.2 复方壳多糖组织工程皮肤的制备及诱导条件的优化 应用酶消化法进行人成纤维细胞的培养,按照文献所述方法获得人表皮干细胞[2]。在冰浴条件下按比例混匀醋酸鼠尾胶原、壳多糖、硫酸软骨素、透明质酸、弹性蛋白及浓缩DMEM;用1N 氢氧化钠调节pH值至7.2~7.4;在凝胶中加入成纤维细胞,细胞量达到105/mL;吸入24孔板培养板中,每孔1 mL,放入孵箱内待形成凝胶后,每孔轻轻加入1代表皮干细胞1 mL(浓度为8×105/mL)于凝胶上,最后再加入角质化细胞生长培养基(KGM),置37 ℃、5%CO2/95%空气、90%以上湿度孵箱培养,每天换液1次;培养3 d后,用不锈钢筛网支架抬高3 mm,行气液界面培养,每日垂直振荡,振荡频率为75次/分,振幅为2 cm;隔日添加下列因素:EGF 5、10、15、20 ng/mL,每组按3复孔进行实验;培养16 d后,用4%多聚甲醛固定后行HE染色,观察皮肤生长情况,选取合适的浓度。
1.3.3 复方壳多糖组织工程凝胶的制备及鉴定 在冰浴条件下按比例混匀醋酸鼠尾胶原、壳多糖、硫酸软骨素、透明质酸、弹性蛋白及浓缩DMEM;用1N 氢氧化钠调节pH值至7.2~7.4;在凝胶中加入1代表皮干细胞,细胞量同前;吸入24孔板培养板中,每孔1 mL,放入孵箱内待形成凝胶后,再加入KGM,置37 ℃、5%CO2/95%空气、90%以上湿度孵箱培养,每天换液1次;每日垂直振荡,振荡频率为75次/分,振幅为2 cm;加入上述定向诱导分化条件筛选出的合适浓度。对复方壳多糖组织工程凝胶进行如下鉴定:(1)按常规进行 HE 染色;(2)免疫荧光观察:将凝胶置于4%多聚甲醛中固定2 h,磷酸盐缓冲液(PBS)漂洗5 min×3次;加一抗工作液[CK19、CK18、癌胚抗原(CEA)],湿盒内 37℃孵箱内放置30 min,PBS漂洗5 min×3次;加入荧光标记的抗体羊抗鼠 IgG-FITC 1∶100,湿盒内 37 ℃孵箱内放置30 min,PBS漂洗5 min×3次;缓冲甘油封片;将制备的样品放在激光扫描共聚焦显微镜的载物台上,在倒置显微镜下寻找细胞后转到激光光源进行扫描;(3)透射电镜扫描观察。
2 结 果
2.1 组织工程皮肤定向诱导分化的条件 各组EGF作用于组织工程皮肤时,均可见皮肤熟化程度较高,表皮分化良好,表真皮结合较好,但5 ng/mL EGF未见明显的表皮细胞向凝胶内生长;10 ng/mL EGF时表皮细胞向凝胶内生长,但未见明显的管腺样结构。15 ng/mL及20 ng/mL EGF作用于组织工程皮肤时,可见表皮细胞向真皮基质凝胶内生长,并出现管腺样结构,见图1。

A:EGF 5 ng/mL;B:EGF 10 ng/mL;C:EGF 15 ng/mL;D:EGF 20 ng/mL。
图1 不同浓度的EGF作用于组织工程皮肤(×200)
2.2 管腔样结构的鉴定
2.2.1 组织学观察 组织切片 HE 染色可见凝胶内的细胞成团生长形成管腔样结构,管腔结构的管壁由单层细胞构成,中间可见较大腔隙,细胞质红染,部分细胞核位于基底部,颜色较深,部分细胞形态可见腔面窄、基底部大,排列有一定的极性,与汗腺分泌部管状结构相似,见图2。
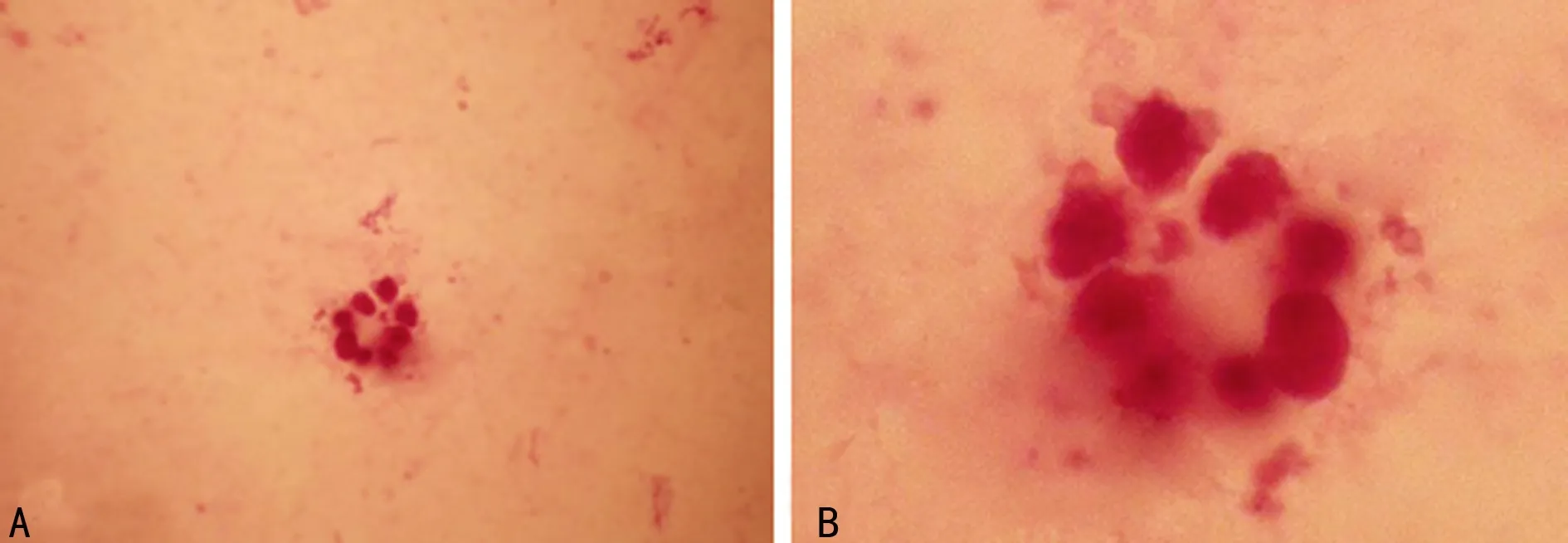
A:×100;B:×400。
图2 60 μm冰冻切片HE染色
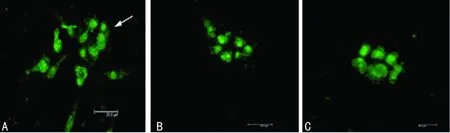
A:抗-CK18阳性;B:抗-CK18阳性;C:抗CEA抗体阳性。
图3 CLSM扫描下免疫荧光观察
2.2.2 免疫荧光观察 ESC和汗腺细胞均表达的CK19,在CLSM扫描下,利用抗-CK19抗体观察凝胶中细胞的形态。发现有细胞聚集成团,形成管腔样结构,管腔结构由单层细胞构成的管壁和中央空腔组成,与汗腺分泌部的管状结构相似(图3A)。管腔样结构抗-CK18(图3B) 和抗-CEA (图3C)免疫荧光染色均表达阳性。
3 讨 论
汗腺是皮肤重要的附属器之一,汗腺发育起始于胚胎的第11周左右, 31周左右便停止发育[3]。ESC是汗腺发育的基础,成人时大部分定位于毛囊隆突部。有学者提出的隆突激活假说认为,当干细胞所处的微环境发生改变时,细胞外的某些信息便可以通过整合素等传递给干细胞,以触发其跨膜信号转导,激活干细胞的分化多潜能性[4]。所以ESC存在向毛囊上皮细胞、皮脂腺细胞、表皮基底细胞、汗腺腺上皮细胞分化的4条可能途径。更多的实验也证明了隆突激活假说的正确性[5-9]。
ESC的增殖与分化受到干细胞“壁龛(Niche)”的调控。干细胞“壁龛”即干细胞所处的微环境,通过细胞与细胞、细胞与细胞外基质两种方式调控着干细胞的增殖与分化。本研究认为,EGF是ESC维持自我更新和分化的基础,不同浓度的EGF可能导致干细胞不同的转归。一方面,低浓度的EGF在体外维持干细胞未分化状态中起着重要作用,是培养ESC必不可少的培养基添加物。目前常用的表皮干细胞培养基如KSFM、Epilife中EGF的浓度为5 ng/mL。另一方面,EGF亦能促使干细胞的分化。有研究表明,表皮细胞不仅能表达EGF,同时也能表达其受体,呈自分泌作用,在表皮的组织学结构中,从表皮基底层到棘细胞层细胞均包含有表皮细胞生长因子受体[10],且EGF受体在表皮成层期方能检出,并随胚龄延展而表达增多,这样就为采用EGF诱控干细胞分化提供了理论依据。从组织发育学的角度讲,表皮及皮肤附属器同源(外胚层) ,即皮肤附属器由表皮增生并分化而成。可以认为汗腺的发生,实质上是在胚胎发生期由某种或多种因素诱导表皮干细胞定向分化为汗腺细胞的过程,表皮干细胞充当着不断完善汗腺组织的角色[11]。Shikiji 等[12]将含表皮干细胞的人角质形成细胞,接种于成纤维细胞与胶原材料的复合物中,进行三维培养,发现高浓度EGF(大于15 ng/mL)能够诱导人工真皮内出现汗腺导管样结构。邓辰亮等[13]用高浓度的EGF(50 ng/mL、100 ng/mL)对二维培养的人表皮细胞进行诱导分化,发现人表皮干细胞增殖能力明显,并表达汗腺相对特异性的标志NHE-1及NKCC-1。
在本研究中,利用EGF诱导组织工程皮肤上的1代表皮干细胞,可见表皮细胞向真皮基质凝胶内生长,出现的管腔样结构由一至两层细胞构成,中央有腔隙。将胶原凝胶中诱导的管腔样结构利用冰冻切片 HE 染色后观察,该结构由单层细胞构成,胞核较大,偏向基底部,胞浆嗜酸性。细胞间的结合不紧密,没有明显的基底膜及肌上皮细胞,但与正常外泌汗腺分泌细胞HE染色有相似性。 免疫荧光利用ESC与腺上皮细胞共表达的细胞表面分子标记CK19来染色凝胶中的细胞,发现细胞均有染色,其中可见细胞聚集成团形成管腔样,同时构成管腔样结构的细胞CK18 和 CEA染色均为阳性表达。综合HE染色、免疫荧光及透射电镜结果分析,本研究认为,所诱导的管腔样结构中的细胞与汗腺腺上皮分泌部细胞从形态学上有一定的相似性。
目前有大量证据表明了EGF在汗腺的发生及维持上的重要作用。Aybay等[14]报道了EGF在顶浆汗腺液中及外分泌汗腺液中的存在。Saga等[15]证实EGF分布在汗腺分泌部,发现在人发育及成熟的汗腺中高度表达EGF活性受体。研究者证实在外分泌汗腺的真皮导管中,EGF受体呈高水平表达[16]。产后应用EGF治疗X性连锁无汗性外胚叶发育不良(XLHED)tabby鼠时,诱导出鼠爪部功能性汗腺的形成。反之,降低tabby鼠中EGFR的表达,则EGF诱导的上述功能性汗腺无法形成[17]。
从本研究的结果来看,低浓度的EGF(5~10 ng/mL)能够使真皮凝胶上的表皮细胞分层良好,但未能促进细胞向凝胶内生长;较高浓度的EGF(15~20 ng/mL)可以促进表皮细胞向真皮基质凝胶内生长,并出现管腔样结构。该结果与有关研究有一致性[12]。但EGF是如何诱导干细胞出现分化并形成管腔样结构,具体机制仍然需要下一步的研究。
[1]付小兵,王正国.现代高新技术与创伤修复[M].北京:人民军医出版社,2002:8-17.
[2]崔洪勋,伍津津,唐书谦,等.表皮干细胞对Ⅳ型胶原的黏附特性及分选方法的研究[J].第三军医大学学报,2009,31(9):802-804.
[3]Li J,Fu X,Sun X,et al.The interaction between epidermal growth factor and matrix metalloproteinases induces the development of sweat glands in human fetal skin[J].J Surg Res,2002,106(2):258-263.
[4]Cotsarelis G,Sun TT,Lavker RM.Label-retaining cells reside in the bulge of the pilosebaceous unit:implications for follicular stem cells,hair cycle,and skin carcinogenesis[J].Cell,1990,61(7):1329-1337
[5]Jahoda CA,Oliver RF,Reynolds AJ,et al.Trans-species hair growth induction by human hair follicle dermal papillae[J].Exp Dermatol,2001,10(4):229-237.
[6]Oshima H,Rochat A,Kedzia C,et al.Morphogenesis and renewal of hair follicles from adult multipotent stem cells[J].Cell,2001,104(2):233-245.
[7]Wu JJ,Liu RQ,Lu YG,et al.Enzyme digestion to isolate and culture human scalp dermal papilla cells:a more efficient method[J].Arch Dermatol Res,2005,297(2):60-67.
[8]Wu JJ,Zhu TY,Lu YG,et al.Hair follicle reformation induced by dermal papilla cells[J].Arch Dermatol Res,2006,298(4):183-190.
[9]Zhang P,Kling RE,Ravuri SK,et al.A review of adipocyte lineage cells and dermal papilla cells in hair follicle regeneration[J].J Tissue Eng,2014,27:5.
[10]Fu XB,Shen ZY,Chen YL,et al.Randomised placebo-controlled trial of use of topical recombinant bovine basic fibroblast growth factor for second-degree burns[J].Lancet,1998,352(9141):1661-1664.
[11]Fu XB,Li JF,Sun XQ,et al.Epidermal stem cells are the source of sweat glands in human fetal skin:Evidence of synergetic development of stem cells,sweat glands,growth factors,and matrix metalloproteinases[J].Wound Repair Regener,2005,13(1):102-108.
[12]Shikiji T,Minami M,Inoue T,et al.Keratinocytes can differentiate into eccrine sweat ducts in vitro:involvement of epidermal growth factor and fetal bovine serum[J].J Dermatol Sci,2003,33(3):141-150.
[13]邓辰亮,杨松林,郑江红,等.诱导表皮干细胞向汗腺上皮细胞分化的研究[J].组织工程与重建外科杂志,2009,5(5):250-252.
[14]Aybay C,Karakus R,Yucel A.Characterization of human epidermal growth factor in human serum and urine under native conditions[J].Cytokine,2006,35(1/2):36-43.
[15]Saga K,Jimbow K.Immunohistochemical localization of activated EGF receptor in human eccrine and apocrine sweat glands[J].J Histochem Cytochem,2001,49(5):597-602.
[16]Ma K,Tan Z,Zhang C,et al.Mesenchymal stem cells for sweat gland regeneration after burns:From possibility to reality[J].Burns,2016,42(3):492-499.
[17]Noordijk M,Davideau JL,Eap S,et al.Bone defects and future regenerative nanomedicine approach using stem cells in the mutant Tabby mouse model[J].Biomed Mater Eng,2015,25(1 Suppl):S111-119.
Research on human epidermal stem cells differentiating into glandular epithelium-like cells in vitro*
WangYuanyuan1,YangGuihong2,YangTao2,TangShuqian2,WuJinjin2△
(1.DepartmentofPlasticandCosmeticSurgery;2.DepartmentofDermatology,DapingHospital,InstituteofFieldSurgeryResearch,ThirdMilitaryMedicalUniversity,Chongqing400042,China)
Objective To investigate the influencing conditions of human epidermal stem cells(ESCs) differentiating into gland-like cells and to identify the induced tubular structure.Methods The ESCs were seeded onto compound polysaccharide shell dermal matrix and collagen gel,adding different concentrations of epidermal growth factor(EGF) and culturing by vertical shaking in vitro,the three dimensional culture and induced directional differentiation were performed.The means of HE staining,immunofluorescence and confocal laser scanning microscope were adopted to observe the conditions,morphology and phenotype change of ESCs directionally differentiating into glandular epithelium-like cells.Results 15-20 ng/mL EGF could induce ESCs in tissue-engineering dermis to grow into dermis and appear the gland-like structure.The HE staining in this structure showed its profile as a single layer with lacune in the middle compartment,eosinophilic cytoplasm,lightly stained.Under CLSM,by CK19 staining,the luminal structure in the middle of the cell mass was observed,while CK18 and CEA were expressed in this structure.Conclusion Under the induction of particular concentration of EGF,the in vitro cultured human ESCs seeded on the tissues engineering dermis could form into the tubular structure,which is similar to the in vivo sweat gland secretory cells in morphology and histology.
epidermal stem cell;glandular epithelium-like cell;differentiation;epidermal growth factor
10.3969/j.issn.1671-8348.2017.10.001
国家自然科学基金资助项目(81201244)。 作者简介:王元元(1981-),主治医师,博士,主要从事表皮干细胞的研究。△
,E-mail:wjjjj@163.com。
R339.3+7
A
1671-8348(2017)10-1297-03
2016-10-18
2017-01-21)

