冻融循环对肝癌新鲜冻存组织RNA完整性的影响
张园,侯彦深,宋佳,董翔
(新疆医科大学附属肿瘤医院 1.肿瘤防治研究所,2.麻醉科,新疆维吾尔自治区 乌鲁木齐 830011)
·论 著·
冻融循环对肝癌新鲜冻存组织RNA完整性的影响
张园1,侯彦深2,宋佳1,董翔1
(新疆医科大学附属肿瘤医院 1.肿瘤防治研究所,2.麻醉科,新疆维吾尔自治区 乌鲁木齐 830011)
目的:评估新鲜冻存组织解冻后RNA降解动力学变化,探讨反复冻融对肝癌组织样本质量的影响。方法:将15例肝癌患者术后组织标本各分11份,其中1份用于组织形态学验证,另外10份于-80℃保存,取4份标本分别在冻融0、1、3、6次后提取RNA,剩余6份标本分别在室温下放置0min(T0)、5min(T5)、15min(T15)、30min(T30)、45min(T45)及1h(T60)后进行RNA提取,采用微芯片凝胶电泳技术分析RNA完整性。结果:切片中肿瘤组织面积均超过85%,坏死组织面积均小于15%,符合国际肿瘤基因组联盟制定的标准,且与术后病理学结果符合率达100%。不同冻融次数组织RNA完整性(RNA integrity number,RIN值)比较,差异有统计学意义(P<0.001),而且冻融次数越多,RIN值越低(冻融循环0、1、3、6次后RIN分别为8.27±0.42、6.38±0.61、5.08±0.61、4.32±0.62)。随解冻后RNA提取时间的延长,RNA完整性也不断降低(T0:RIN=8.33±0.52;T5:RIN=7.95±0.48;T15:RIN=7.09±0.40;T30:RIN=5.88±0.39;T45:RIN=5.06±0.39;T60:RIN=4.40±0.30),与T0时提取RNA比较,解冻后T30、T45、T60后提取RNA的RIN平均值显著下降,且差异有统计学意义(P<0.001)。结论:当研究对RNA质量要求比较高时,肝癌组织解冻不应超过3次,并且在30min内提取RNA,以保证RNA的完整性。
冻融;RNA提取时间;RNA完整性
生物样本库中的新鲜冰冻组织经常被用于PCR、基因芯片、比较基因组杂交等分子生物学实验,因此冻存质量对研究的可靠性尤为重要[1]。组织细胞内RNA容易降解,因此RNA检测成为组织样本质量鉴定的重要指标。完整性和均一性是评价RNA质量的最关键标准,也是下游生物学分析尤其是基因组学研究的基础和保障。
目前,关于不同保存条件对标本影响的研究主要集中在临床样本检测结果的准确性上,有关标本库采集、储存体系角度对样本存储温度变化及反复冻融对标本质量的影响鲜有报道。本研究旨在评估新鲜冻存肝癌组织解冻后RNA降解动力学变化,探讨反复冻融对肝癌组织样本质量的影响。
1 材料与方法
1.1 主要设备
-80℃超低温冰箱(Thermo Fisher Forma995),液氮储存箱(Thermo Fisher CryoPlus3),普通小型(3L)液氮罐,干式恒温器,低温高速离心机(贝克曼 Microfuge 22R),安捷伦2100生物分析仪。
1.2 主要试剂
Trizol,氯仿,异丙醇,DEPC,乙醇,RNA6000 Nano 总RNA分析试剂盒。
1.3 标本采集与分组
1.3.1 组织标本的留取 组织标本来源于新疆维吾尔自治区肿瘤防治研究所肿瘤资源库,15例肝癌患者术前未经过任何生物、化疗及放疗治疗,所有标本均有留取标本知情同意书及伦理审查报告。组织离体后在不影响病理诊断的前提下切取肿瘤组织标本,所留取的标本避免了出血及坏死组织,每例组织标本切成直径约0.8cm的组织块11份(约50mg·个-1),其中1份经福尔马林固定用于组织病理学鉴定,其余分别装入冻存管中,迅速放入液氮转移罐,整个过程在20min内完成。标本在液氮转移罐中速冻 30min后,转移至-80℃超低温冰箱保存。
1.3.2 分组 标本放置于25℃干式恒温器上5min解冻,之后放入液氮速冻20min为1次冻融过程。根据冻融次数分为4组:对每例组织样本分别在冻融0、1、3、6次后提取RNA,以冻融0次做参考,探讨冻融次数对RNA提取效率和RNA质量的影响。
根据标本RNA提取延长时间分为6组:同例患者的组织标本从-80℃超低温冰箱取出后将其中1份标本立刻置于Trizol中进行RNA提取(T0),剩余5份标本分别在室温下放置5min(T5)、15min(T15)、30min(T30)、45min(T45)、1h(T60)后进行RNA提取。RNA提取效率和RNA质量以T0做参考。
1.4 组织形态学检测
将未发生冻融的1份冷冻组织标本室温解冻,常规脱水、石蜡包埋、4~6μm切片,进行HE染色。由病理科主任医师对切片进行病理学检查,确认取材部位与病理学诊断的符合情况,并检测样本的代表性,按照国际肿瘤基因组联盟(ICGC)肿瘤组织样本病理质量标准评判标本质量,即肿瘤部分占80%以上,坏死细胞少于20%为合格标本。
1.5 总RNA提取在2mlEP管中放入组织标本(约50mg),加入1ml预冷Trizol,冰上机械制成匀浆,每使用 1ml Trizol加入0.2ml氯仿,离心后取上清,加入上清液等体积的异丙醇沉淀总RNA后,用75%乙醇洗涤并用RNase-free H2O溶解总RNA。
1.6 RNA浓度和纯度检测取2μl未稀释的RNA样本在NanoDrop2000分光光度计上检测260nm/280nm RNA的浓度,判断RNA纯度标准是OD260/OD280值在1.9~2.0(比值<1.8表明有DNA、蛋白质的污染,比值>2.1表明RNA降解或有异硫氰酸肌等物质的污染)。
1.7 RNA完整性检测参照RNA 6000 Nano Labchip Kit 说明书取50~100ng RNA与1μlRNA 6000 ladder在Agilent 2100生物分析仪上进行分析,采用毛细管电泳法对28S和18S rRNA通过软件进行量化,得到RNA完整性(RIN)的值。RIN值在10(最佳质量)~0(完全降解)之间[2]。根据文献[3]报道,本研究将RIN≥7的样本RNA质量评价为“优”,4≤RIN<7的样本RNA质量评价为“中”,RIN<4的样本RNA质量评价为“差”。
1.8 统计学处理
2 结 果
2.1 病理质控结果
15例肝癌组织样本,经常规切片HE染色阅片,结果显示,所选取的组织肿瘤细胞形态良好,符合肝细胞癌典型的病理特征(图1)。切片中肿瘤组织面积均超过85%,坏死组织面积均小于15%,符合ICGC标准,且与术后病理学结果符合率达100%。
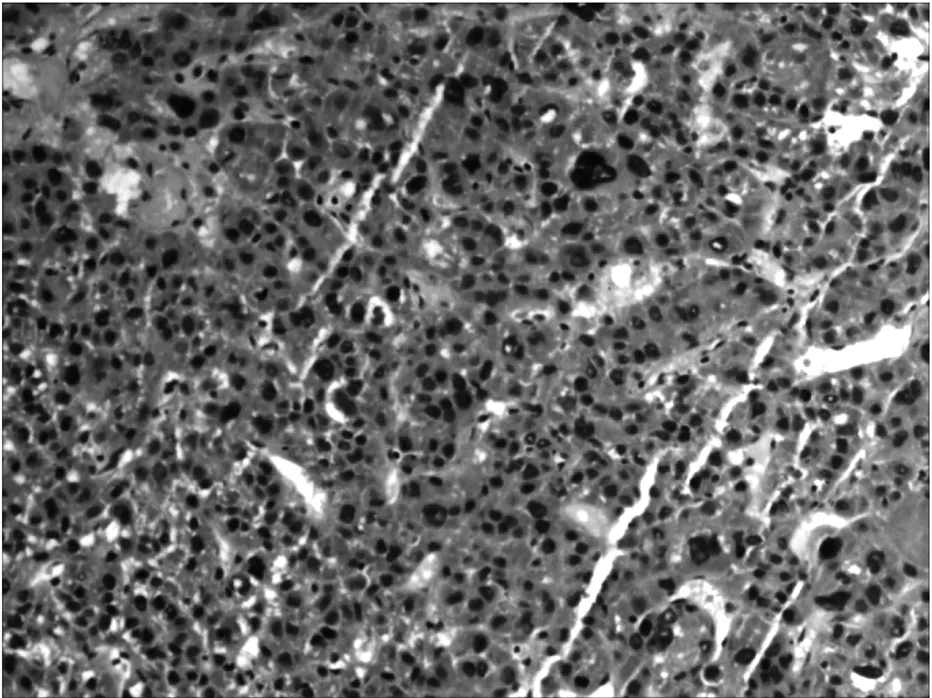
图1 肝癌组织样本 HE×200
Fig1 Liver tumor tissue sample HE×200
2.2 RNA浓度和纯度检测
在NanoDrop2000分光光度计上检测RNA的浓度,结果显示,RNA浓度范围在185.0~1913.8ng·μl-1之间,RNA纯度A260/A280值在1.94~2.06之间。
2.3 反复冻融对RNA样本质量的影响
不同冻融次数组织RIN值差异有统计学意义(P<0.001),而且冻融次数越多,RIN值越低,见表1。冻融0、1、3、6次后RNA质量见表2。
表1 不同冻融循环次数肝癌组织样本RIN值均数比较
Tab 1 Comparison the RIN value of HCC tissue sample after different freeze-thaw cycles

冻融次数nRIN值(x±s)0158.27±0.421156.38±0.613155.08±0.616154.32±0.62F值107.319P值0.000
表2 不同冻融循环次数肝癌组织样本RNA质量评价结果
Tab 2 Assessment the RNA quality of HCC tissue sample after different freeze-thaw cycles

冻融次数RNA质量评价优中差合计0150015141101530150156010515合计1936560
2.4 新鲜冻存肝癌组织解冻后RNA降解动力学变化
检测了15个肝癌组织样本中6份标本的RIN值,新鲜冻存组织解冻后RNA降解动力学变化见表3。T0、T5、T15时标本RIN值平均值均大于7,T0时与T30、T45、T60时相比,RIN平均值显著下降,差异有统计学意义(P<0.001)。
表3 新鲜冻存肝癌组织解冻后RNA降解动力学变化
Tab 3 Kinetics of RNA degradation in fresh frozen HCC tissue samples after thawing

RNA提取时间nRIN值(x±s)T0158.33±0.52T5157.95±0.48T15157.09±0.40T30155.88±0.39T45155.06±0.39T60154.40±0.30F值153.387P值0.000

图2 经过反复冻融后样本RIN变化趋势图(RIN值4和7为分界点)
Fig 2 The RIN of all tissue-samples after repetitive freezingand thawing(The RIN of 7 and 4 are chosen as the value cutoff)
3 讨 论
RNA的完整性和均一性是评价RNA质量的主要标准和进行后续研究的必要前提。使用生物分析仪测量RIN值是替代传统的凝胶评价RNA质量快速而简单的方法,这种方法可以更好地反映RNA电泳图中的特征,可以同时对RNA样品进行定量及质量评估[2]。有研究显示,组织RIN≥7的标本可用于大部分传统分子生物学实验,包括对标本质量要求比较高的基因序列分析,4≤RIN<7的标本可用于RT-PCR实验,而RIN<4的标本质量会严重影响分子生物学的实验结果[2,4]。
在本研究中,未经过冻融循环处理,立刻置于Trizol中进行RNA提取的标本,RIN值均大于7,RIN平均值可达8.27±0.42,标本质量最佳,也证明了本研究中标本在采集、存储及RNA提取的实验技术不存在问题。但是经过1次冻融肝癌组织RIN平均值降到6.38±0.61,3次冻融组织RIN平均值降到5.08±0.61,6次冻融组织RIN平均值降到4.32±0.62。说明反复冻融可影响标本RNA质量,随着冻融次数的增多,RNA完整性越差,对后续研究的影响也越大。若后续研究对RNA样本质量要求比较严格,例如miRNA芯片或miRNA定量PCR检测,应选取未经冻融的标本作相关研究。本研究还提示,对肝癌组织标本经过3次冻融仍有使用价值,可用于RT-PCR实验,但应避免冻融次数的继续增多。李维凯等[5]从大鼠海马组织提取总RNA后,测定了不同时间和温度下保存,以及3次循环冻融后RNA完整性变化,结果表明,不同条件下保存及冻融3次后RNA完整性较首次均有所降低,本研究结果与其一致。
新鲜冻存组织在解冻后的几分钟甚至几秒钟就启动降解程序。本研究显示,新鲜冻存组织解冻后立即提取的RNA质量最佳,随着解冻后时间的延长,RNA的完整性也不断降低,但解冻15min后提取RNA的RIN均值为7.50±1.00,仍可满足对标本质量要求较高的实验研究。当新鲜冻存组织解冻30、45、60min后,提取RNA的RIN值下降,与解冻后5min及立即提取相比具差异有显著性,解冻60min后的样本RNA出现严重降解。因此,要避免新鲜冻存组织RNA的降解,应在解冻后15min内提取RNA。
[1] SHABIHKHANI M,LUVEY G M,WEI B,et al.The procurement,storage,and quality assurance of frozen blood and tissuebiospecimens in pathology,biorepository,and biobanksettings[J].Clin Biochem,2014,47(4-5):258-266.
[2] SCHROEDER A,MUELLER O,STOCKER S,et al.The RIN:an RNA integrity number for assigning integrity values to RNA measurements[J].BMC Mol Biol,2006,7:3.
[3] ELLIOTT P,PEAKMAN T C,UK BIOBANK.The UK Biobank sample handling and storage protocol for the collection,processing and archiving of human blood and urine[J].Int J Epidemiol,2008,37(2):234-244.
[4] SANDUSKY G E,TEHENY K H,ESTERMAN M,et a1.Quality control of human tissues-experience from the Indiana Univerrsity Cancer Center-Lilly Research Labs human tissue bank [J].Cell Tissue Bank,2007,8(4):287-295.
[5] 李维凯,霍韬光,畅蓓,等.保存条件对大鼠海马组织总RNA质量的影响[J].化学研究,2012,23(5):93-96.
Effects of freeze-thawing cycles on RNA integrity in fresh frozen liver tumor tissue
ZHANG Yuan1,HOU Yan-shen2,SONG Jia1,DONG Xiang1
(1.InstituteofCancerResearch;2.DepartmentofAnesthesiology,CancerAffiliatedHospitalofXinjiangMedicalUniversity,Urumqi830011,China)
Objective:To evaluate the kinetics of RNA degradation and the effect of quality after thawing in fresh frozen liver cancer tissue.Methods: Fifteen specimens were from the patients of liver cancer.Each specimen was divided into 11 parts,1 of them was used for histomorphological verification,the others 10 were preserved in -80℃.Four parts of the specimen underwent 0 time,1 time,3 times,6 times repetitive freezing and thawing cycles before RNA extraction.The other 6 parts were thawed at room temperature for 0min(T0),5min(T5),30min(T30),45min(T45),1h(T60) before RNA extraction.RNA integrity was analyzed by microchip gel electrophoresis.Results: The tumor tissue area in detected specimens was over 85%,necrotic tissue area was less than 15%,which meet ICGC standard.The recombination rate of postoperative pathological diagnosis was 100%.The liver tissue RIN value was significant different after different freeze-thawing cycles,and the RIN value was decreased with increasing freeze-thawing times.The RINs were 8.27±0.42,6.38±0.61,5.08±0.61,4.32±0.62 at 0,1,3 and 6 times freeze-thawing cycles,respectively.The RNA integrity was decreased with increasing delayed RNA extraction time(T0:RIN=8.33±0.52;T5:RIN=7.95±0.48;T15:RIN=7.09±0.40;T30:RIN=5.88±0.39;T45:RIN=5.06±0.39;T60:RIN=4.40±0.30).The RIN value at T0 was significantly higher than those that at T30,T45 and T60 (P<0.001).Conclusion: According to the RIN results,we recommend that liver cancer tissue should not be thawed more than 3 times for studies requiring RNA of high quality and within 30 minutes for RNA extraction.
freeze-thawing;RNA extraction time;RNA integrity
2016-06-13
2016-09-03
新疆医科大学创新基金资助项目(XYDCX201472)
张园(1982-),女,河北安国人,助理研究员。E-mail:18099606776@163.com
张园,侯彦深,宋佳,等.冻融循环对肝癌新鲜冻存组织RNA完整性的影响[J].东南大学学报:医学版,2017,36(1):58-61.
R34
A
1671-6264(2017)01-0058-04
10.3969/j.issn.1671-6264.2017.01.014

