高温胁迫对葡萄高温相关基因和蛋白表达的影响
查倩,奚晓军,蒋爱丽,田益华
(上海市农业科学院林木果树研究所/上海市设施园艺技术重点实验室,上海 201403)
高温胁迫对葡萄高温相关基因和蛋白表达的影响
查倩,奚晓军,蒋爱丽,田益华
(上海市农业科学院林木果树研究所/上海市设施园艺技术重点实验室,上海 201403)
【目的】适宜的温度是葡萄生长发育的必要条件,南方地区葡萄在成熟期常常经历连续高温环境,叶片容易失水干枯,果实会发生明显的日灼,严重地影响了其经济效益。选择不同树龄葡萄树进行高温胁迫的相关研究,以解释高温对葡萄的伤害,为生产中高温逆境的抵御措施提供理论依据。【方法】选择南方地区常见的鲜食葡萄品种‘巨峰’‘巨玫瑰’‘醉金香’‘夏黑’‘申玉’‘申丰’‘申华’和‘沪培1号’为试验材料,其中葡萄幼苗选择长势基本一致的1年生扦插苗移至人工气候培养箱,在可控条件下培养7 d后于每天10∶ 00—16∶00(模拟夏季高温发生时段)进行不同温度处理(25℃、35℃、45℃),观察处理后0、3、6和150 h高温应答反应;葡萄成年树选择6年生树为试验材料,在2015年夏季观测到2个处理点分别为:“37℃”处理(2015年7月23日13∶ 00 h最高气温为37℃)和“42℃”处理(2015年7月31日13∶ 00 h最高气温为42℃),观察以上处理的8个不同葡萄品种在高温胁迫下叶片表型变化,对抗逆基因(HSFA2、GLOS1、HSP70、HSP17.9)和HSP21蛋白的表达量进行分析。【结果】‘申玉’‘夏黑’和‘申华’在高温发生初期,顶部新梢和老叶有失水,并在150 h时有所恢复;‘巨峰’和‘巨玫瑰’叶片在高温发生3 h时轻微失水,6 h时大面积失水,‘申丰’‘沪培1号’‘醉金香’叶片在高温发生3 h时大面积失水,6 h时整株干枯。同时对葡萄幼苗和成年树的抗逆基因的表达进行检测发现:不同温度处理(35℃/45℃/“42℃”)下不同葡萄品种的抗逆基因均被诱导表达,但是表达丰度有所不同,表现为温度水平越高,基因的上调倍数越大。另外,‘申玉’‘申华’‘醉金香’‘巨峰’和‘巨玫瑰’的GLOS1、HSFA2和‘申玉’‘申华’‘夏黑’和‘巨峰’HSP70表达在长期高温处理后恢复至原初水平;并观察到HSP17.9在高温发生后上调表达,但并未因为时间的延长而减弱表达倍数。高温处理(45℃/“42℃”)会诱导葡萄幼苗和成年树的HSP21蛋白水平,但是在一些品种(‘醉金香’和‘申丰’)中HSP21蛋白表达量有所减少。【结论】不同葡萄品种对高温的耐性有差异,其中‘申玉’‘申华’和‘夏黑’抗性最强,而‘申丰’‘沪培1号’和‘醉金香’属于抗性较弱的葡萄品种。树龄和高温发生方式是影响葡萄幼苗和成年树的抗逆基因和蛋白表达差异的主要因素。
葡萄;高温胁迫;抗逆基因;HSP21
0 引言
【研究意义】随着全球气候变暖,日益加剧的高温环境严重地影响葡萄的生长和发育,表现为叶片卷曲失水干枯,果实容易发生日灼,最终影响产量和品质[1]。其中南方多个葡萄生长地区已发生40℃以上的极端高温天气[2]。因此,研究葡萄高温逆境应答机制,对于生产上葡萄栽培指导和优系选育提供参考。【前人研究进展】高温环境影响了葡萄的一系列生理生化和分子生物学过程,近年来抗逆基因和蛋白的研究颇为热门。热激蛋白HSP(Heat Shock Protein)是植物受高温胁迫诱导产生的一类应答蛋白,作为分子伴侣蛋白,它以帮助其他的多肽折叠、组装或者转移,但其本身不可以形成蛋白质,所以HSP蛋白可以组织受损蛋白积累,维护细胞内平衡,从而减少高温伤害[3-4]。热激蛋白 HSP家族包括 HSP100907060和一些sHSPs(Small Heat Shock Protein,分子大小为15—40 kDa)对植物的抗逆性发挥了重要作用[5-6],作用于高温、干旱、盐胁迫等,其中研究热门的HSP21蛋白,属于sHSPs,受高温胁迫诱导增多[7],并参与保护植物叶片的PS II光化学反应,有效地增强植物耐热能力[8-9]。植物的转录因子HSF(Heat Stress Factor)是通过结合 HSP启动子上的热激元件,从而促进 HSP的表达,HSF家族成员庞大,根据低聚物结构域的特点可为3大类ABC,家族庞大。在中国白梨转录组测序结果中已发现137个HSF转录因子;芦柑中克隆到18个HSF成员,其中有7个转录因子应答高温;苹果和番木瓜等果树上也发现这个关键调控因子HSF,与高温胁迫密切相关[10-13]。单个过表达HSF或HSP转基因植物耐热能力并未提升,证明HSF通过信号转导途径调控HSP蛋白的表达[14]。其中A类转录因子HSFA2与高温胁迫密切相关,已在葡萄上克隆到转录因子 HSFA2和一个与肌醇半乳糖苷合成相关的基因GLOS1(Galactinol Synthesis),均发现在高温处理下呈上调表达,且热响应因子 HSFA2反式激活GLOS1的启动子[15],进一步证明HSFA2转录因子在高温中的重要作用。以上所述抗逆基因均已证明在高温逆境下起着一定的调控作用,这些研究结果对分析葡萄的高温应答反应有着重要的意义,为理解葡萄的高温适应过程和后期指导提供理论基础。【本研究切入点】综上可知葡萄高温胁迫应答反应的研究较为热门,但大多研究仅仅针对人工可控条件下葡萄幼苗的高温应答反应,尚缺少研究高温胁迫下葡萄幼苗和成年树的抗逆基因和蛋白的抗逆应答过程。【拟解决的关键问题】对1年生葡萄苗进行人工可控条件下的不同温度处理,对6年生成年树进行田间高温观察,分析高温逆境发生后不同葡萄品种抗逆基因和蛋白的表达差异。综合分析不同树龄的葡萄树高温胁迫应答差异,为葡萄生产中果实成熟阶段的自然高温伤害提供理论依据。
1 材料与方法
试验于 2015年在上海市农业科学院庄行试验站(30°89′ N,121°39′ E)进行。
1.1 试验材料与处理
以1年生盆栽葡萄幼苗‘巨峰’‘巨玫瑰’‘醉金香’‘夏黑’‘申玉’‘申丰’‘申华’和‘沪培1号’为试验材料,种植于塑料盆中,塑料盆大小为半径15 cm,高40 cm;椰糠﹕腐殖土=1﹕1。智能人工气候培养箱(杭州钱江仪器设备有限公司)的可控条件为白/夜为14 h/10 h,温度为(25±1)℃/(20±1)℃,相对湿度为 65%—70%,光合有效辐射为 100 μmol·m-2·s-1。选择生长一致的植株(具有15—20片功能叶)设置3个温度处理,分别为25℃、35℃、45℃,处理时间段为10:00—16:00 h(模拟夏季高温发生时段),其他时间段温度保持(25±1)℃/(20±1)℃(白/夜)。每个处理5株葡萄,设置3个生物学重复。根据前期试验发现8个葡萄品种中,一些品种在45℃处理3 h时有萎蔫现象,一些品种在处理6 h时有萎蔫现象,一些品种在处理6 h仍然正常生长,故设置当天处理的13:00(3 h)和16:00(6 h)以及处理6 d后的16:00(150 h)3个取样时间点,其中150 h时间点的设置是为了观察长期高温对葡萄的影响,取长势一致的新梢第7—9片功能叶(6片叶片)于液氮速冻保存在-70℃冰箱。

图1 2015年7月21日至7月31日气温观察Fig. 1 The observation of air temperature on July 21 to July 31
试验材料为6年生成年树‘巨峰’‘巨玫瑰’‘醉金香’‘夏黑’‘申玉’‘申丰’‘申华’和‘沪培1号’,采用篱架栽培模式,株行距为1.5 m×3.0 m,均采用设施大棚栽培方式。使用HOBO U23-002 data loggers(Onset Computer Corporation, Cape Cod, MA, USA)对棚内温度进行测定,如图 1所示,7月25日之前日最高温度低于40℃,在7月25日至7月31日这个时间段每天至少有1个小时的温度超过40℃(电子版附表1)。所以在本研究中选择2015年7月23日(“37℃”)和2015年7月31日(“42℃”)为两个温度处理点。于当天13:00取新展开幼叶(6片叶片)液氮速冻保存在-70℃冰箱。
1.2 抗逆基因表达分析
总RNA提取方法采用植物总RNA提取试剂盒(Omega,USA),使用1%琼脂糖电泳检测纯度,并且用NANO DROP2000(Thermo Scientific)确定RNA浓度后置于-70℃冰箱保存备用。取 1 μg RNA利用PrimeScript II 1stStrand cDNA Synthesis Kit(TaKaRa)(参考操作手册)反转录合成第一链cDNA,用于后续试验。实时荧光定量PCR反应是在Roche LightCycler®480II 实时荧光定量 PCR仪上进行,使用 SYBR Premix Ex TaqTM(Perfect Real Time)试剂(TaKaRa),反应体系为20 μL,其中含有SYBR Premix Ex TaqTM(2x)10 μL,cDNA 1 μL,上、下游引物(10 μmol·L-1)各0.3 μL,ddH2O 8.4 μL,每个样品重复3次。
目的基因为HSFA2、GLOS1、HSP70、HSP17.9,内参基因组合为GAPDH和EF1r,引物序列见表1。目的基因相对表达量计算使用 geNorm软件[16-17],选择对照处理(25℃处理3 h)为参数,计算其他处理中的基因表达倍数,相对比值结果由 Hem I 1.0软件绘制[18]。
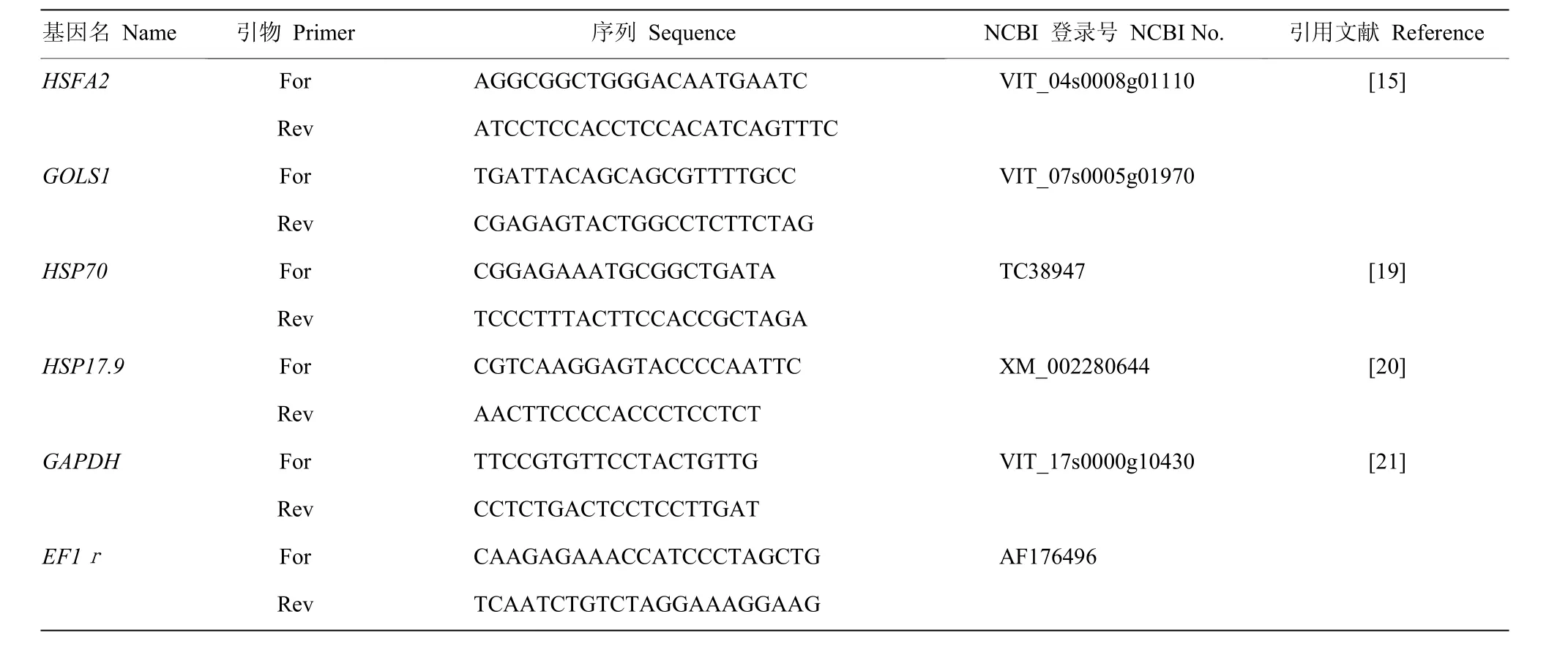
表1 葡萄目的基因实时荧光定量PCR引物序列Table 1 The sequence of primer for target genes in grape
1.3 HSP21蛋白表达分析
采用SHULTZ等[22]方法提取蛋白质,并用BCA蛋白定量试剂盒测定蛋白浓度。20 μg提取的蛋白样品在12% SDS–PAGE电泳后转膜,封闭后加入一抗Anti-HSP21[23](Abcam,England,1﹕3000),4℃孵育过夜,蒸馏水洗膜3次后加入二抗Anti-rabbit IgG(H+L)(CST,USA,1﹕1 000)室温放置1 h,蒸馏水洗膜3次,浸于适量电化学发光试剂中1 min,取出后在室温条件下干燥并用保鲜膜保存,置于暗盒中,压片曝光。利用 Quantity One软件(Bio-Rad,Hercules,CA,USA)对蛋白条带进行灰度分析。
1.4 统计学分析
获得数据用平均值±标准偏差(Mean±SD)表示,利用SPSS 15.0对数据进行统计学分析,P<0.05表示差异显著性。
2 结果
2.1 高温处理对葡萄幼苗植株表型的影响
在3个温度(25℃、35℃、45℃)处理下进行幼苗形态观察,结果发现25℃和35℃下8个品种的幼苗生长状态良好,而 45℃处理下葡萄植株生长状态就出现了明显变化(表2),‘申玉’‘申华’和‘夏黑’经高温处理6 h后仅见顶部新梢和下部老叶失水现象,在150 h时得到恢复;‘巨峰’和‘巨玫瑰’在45℃处理3 h时表现顶部新梢失水,6 h时植株大面积的失水;‘申丰’‘醉金香’‘沪培1号’在高温处理3 h时表现出大面积失水,并在6 h时整株干枯。因此,不同葡萄品种的幼苗在高温胁迫下表现不同,其中抗性由强到弱为:‘申玉’‘申华’和‘夏黑’耐热能力较强;‘巨峰’和‘巨玫瑰’耐热能力次之;‘申丰’‘沪培1号’和‘醉金香’耐热能力最弱。

图2 不同温度处理葡萄高温相关基因表达变化Fig. 2 Relative expression of heat stress related genes in grapevines under different temperature treatments
2.2 高温逆境对葡萄抗逆基因表达的影响
本研究以25℃处理3 h时的数值为基数,取其他数据的相对比值,使用HemI 1.0软件制作基因表达热点图(图2)。在不同温度处理(35℃/45℃)下8个葡萄品种的4个抗逆基因均上调表达:其中GLOS1和 HSFA2表达趋势相似,表现在‘申玉’‘申华’‘醉金香’‘巨峰’和‘巨玫瑰’中GLOS1和HSFA2在高温发生3 h时上调,随后在6—150 h恢复至原初水平,且45℃处理增强趋势高于35℃处理;‘申丰’的GLOS1和HSFA2在35℃处理增强趋势高于45℃处理,‘沪培1号’和‘醉金香’的GLOS1和HSFA2在45℃处理3 h时增强趋势高于35℃处理。‘申玉’HSP70在3 h时表现出35℃处理增强趋势高于45℃处理,在高温后期均恢复至原初水平;35℃处理下的‘申华’‘夏黑’‘巨峰’和‘巨玫瑰’的HSP70表达与25℃处理没有差异,但是45℃处理下这4个品种均表现出增强的趋势,其中‘申华’‘夏黑’‘巨峰’HSP70表达在高温后期恢复至原初水平;‘申丰’‘沪培1号’和‘醉金香’的HSP70在高温中均被诱导表达,其中的差异为基因上调表达丰度不同。不同葡萄品种HSP17.9在高温处理3 h上调表达,表达倍数在5—10,在高温发生后期表达倍数并未减弱。
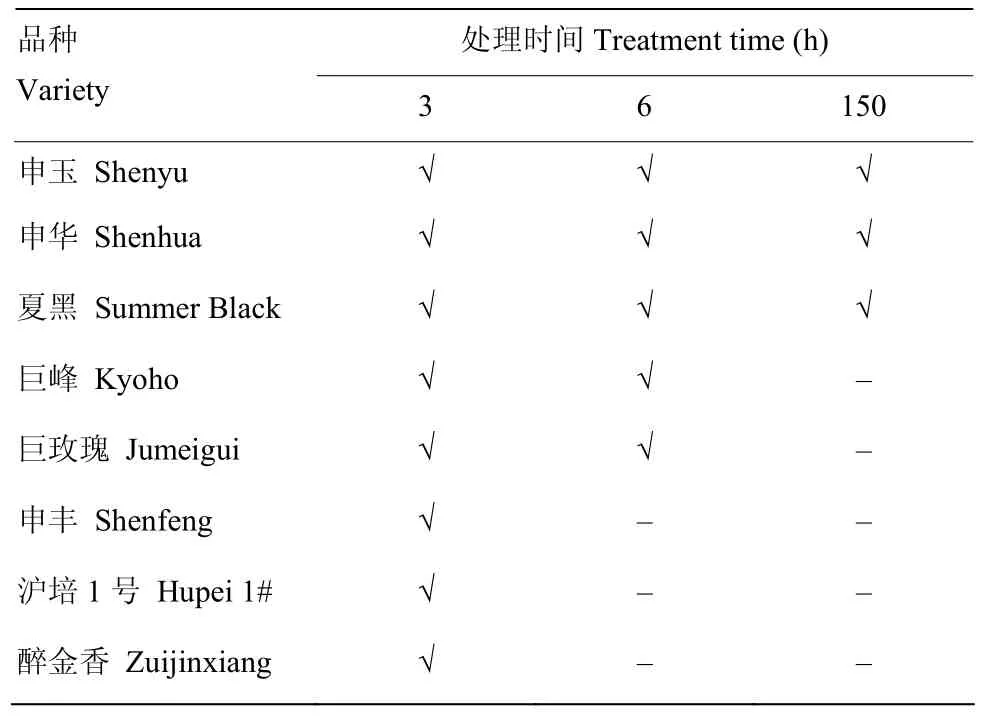
表2 可控条件下不同葡萄幼苗45℃处理萎蔫情况Table 2 The drooping status of different young grapevines at 45℃ treatment under controlled condition
选择8个葡萄品种在“37℃”和“42℃”的GLOS1、HSFA2、HSP70、HSP17.9表达变化进行分析(图2),“42℃”处理下葡萄的 GLOS1、HSFA2、HSP70、HSP17.9表达量普遍较“37℃”处理高,影响这些抗逆基因表达的主要因子为温度。而不同品种之间的表达丰度存在差异,是由于品种之间存在遗传性差异。
2.3 高温逆境对葡萄抗逆蛋白HSP21表达的影响
对 45℃处理后的葡萄幼苗叶片进行高温逆境应答蛋白HSP21表达的检测,结果发现不同葡萄品种的HSP21蛋白表达趋势有差异(图3)。抗热性最强的葡萄品种‘申玉’在 45℃处理 6 h时后开始积累蛋白,并在150 h时积累最多;‘申华’随着45℃处理时间延长,HSP21蛋白积累越多,150 h时HSP21蛋白稍有减少;‘夏黑’在45℃处理3 h时HSP21蛋白有较小幅度的积累,随后在后期显著减少积累量;‘巨峰’随着处理时间的延长,HSP21蛋白积累越多;‘巨玫瑰’在45℃处理3 h时积累较多HSP21蛋白,但是6 h时急剧减少;另外,抗热能力较弱的葡萄品种‘沪培1号’‘醉金香’和‘申丰’在45℃处理下HSP21蛋白量表现出减少趋势。
同时对葡萄成年树的叶片进行抗逆蛋白 HSP21的表达分析发现(图3),‘巨峰’‘巨玫瑰’‘申华’‘沪培1号’叶片中在“42℃”处理点积累较多HSP21蛋白。与“37℃”处理点相比,“42℃”处理点HSP21蛋白含量在‘夏黑’和‘申玉’叶片中略有增加,但在‘申丰’和‘醉金香’叶片中呈减弱趋势,说明品种之间存在差异性,另外,设施条件下其他复杂的非生物因素也是 HSP21蛋白在不同葡萄品种中不一致结果的重要原因之一。
3 讨论
植物的高温抗逆过程极其复杂,植物感受逆境后通过信号转导过程调节细胞内抗逆相关基因和蛋白的表达,进而调整自身的生理状态或形态的改变来适应不利环境[24-25]。因此,抗逆基因和蛋白的表达分析对了解植物高温抗逆机制有着十分重要意义。此外,前人研究植物的高温应答过程集中于可控条件,所以研究设施条件下高温发生后葡萄的应答反应可以为生产上栽培提供更有力的理论依据。
3.1 高温逆境下不同葡萄品种的应答反应
高温逆境对葡萄的伤害最为直观的表现为葡萄叶片表现热害,前人通过石蜡切片观察到葡萄叶片在遭受高温处理后叶肉部分先出现小面积的栅栏组织和海绵组织萎焉失水,最终大面积萎焉干枯[26]。本研究发现一些品种(‘醉金香’‘申丰’‘沪培1号’)在45℃处理3 h时已经表现出失水干枯状态,但是另一些品种(‘申玉’‘申华’‘夏黑’)在45℃处理150 h(每天高温处理时间为6 h)仍然有维持正常生长的健康叶片,能够适应胁迫。由上述可知,不同葡萄品种的遗传背景导致其对抗高温胁迫的能力有所差异,故叶片萎焉干枯程度表现不同。热害表现不仅与高温处理的延续时间相关[27-28],如一些品种(‘巨峰’和‘巨玫瑰’)在45℃处理6 h表现出萎焉现象;而且高温伤害还与温度处理的水平值相关[29],故推测对‘申玉’‘申华’和‘夏黑’这些品种进行更高水平(>45℃)的温度处理,才会出现明显热害现象。
另外,高温逆境影响了植物叶片一系列抗逆基因的表达,具体表现在GLOS1、HSFA2、HSP70、HSP17.9均受高温诱导上调表达[15,30]。本研究发现不同葡萄品种抗逆基因的上调倍数存在差异,不同温度处理(35℃/45℃/“42℃”)下,葡萄叶片的抗逆基因上调表达,这是葡萄叶片对高温胁迫的积极应答过程,这与前人的研究结果一致[31]。但是基因表达丰度值是与温度水平值呈正相关的,45℃处理下这些抗逆基因的上调表达倍数显著高于35℃处理。同样观察到高温处理下抗逆基因的上调表达倍数较其他两个高温处理要小,可能与其他因素有关,需要进一步分析。另外,抗逆基因的上调表达倍数与葡萄的耐热能力(由热害表现的分类)并没有表现出一致性,分析原因是单个抗逆基因的上调表达不能系统的代表此品种的耐热能力,所以分析多个抗逆基因的表达变化显得尤为必要。
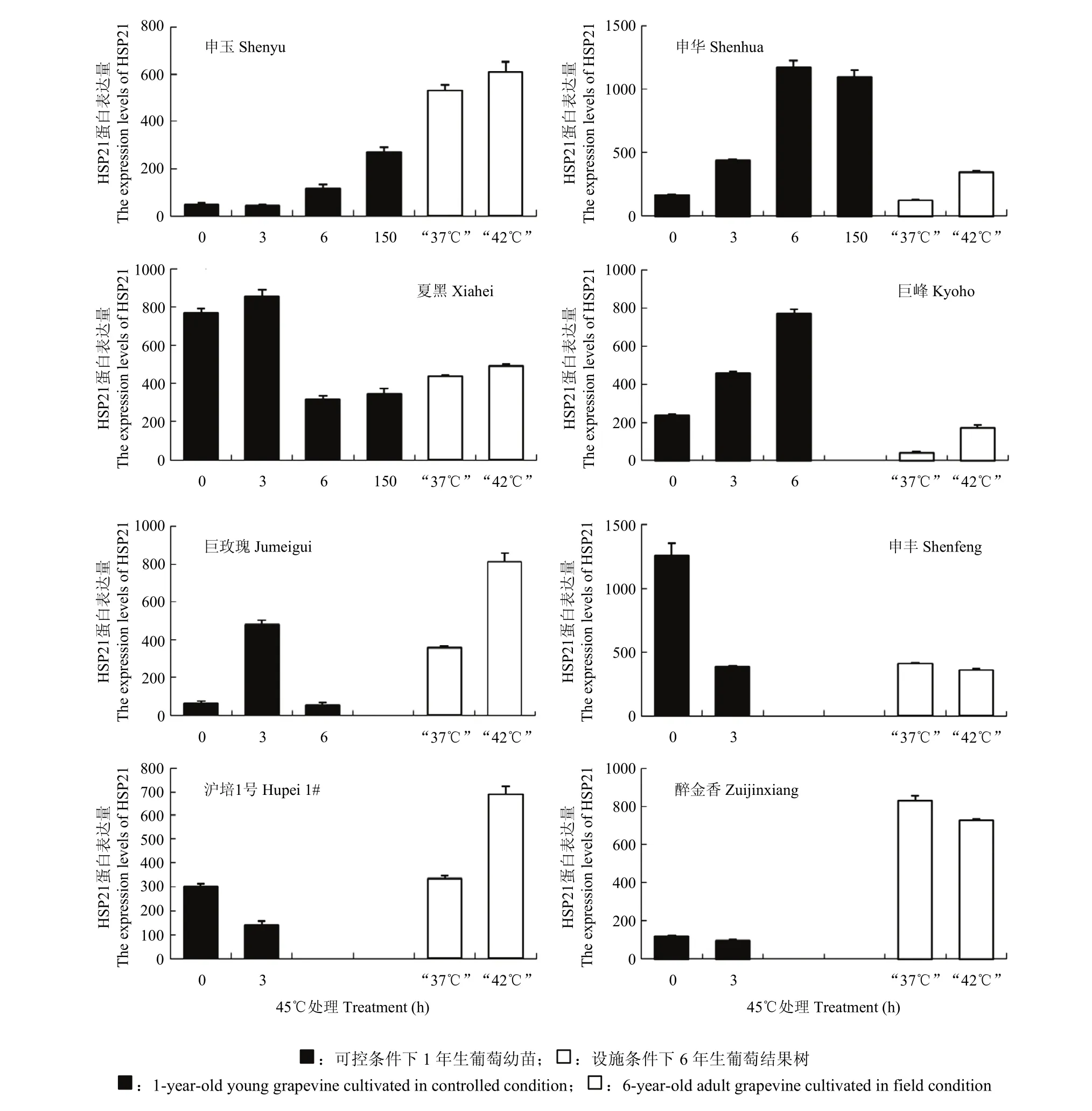
图3 不同葡萄品种HSP21蛋白表达量Fig. 3 HSP21 protein levels in different grapevines
抗逆蛋白 HSP21表达量是植物对逆境反应表现的重要指标,研究表明HSP21蛋白在高温逆境下诱导表达[32],本试验结果得到,极端高温(“42℃”/45℃)下葡萄叶片的HSP21表达量的增减与品种有关,‘申玉’‘申华’品种表达量明显增加,而且连续增加;而‘醉金香’和‘申丰’表现出减少趋势,可能是‘醉金香’和‘申丰’这些品种的叶片已经濒临高温伤害极限,已无力合成有效蛋白用以保护叶片的正常生理过程。
3.2 葡萄的高温逆境适应机制
高温逆境会影响植物分子反应,但植物自身会进化出一套适应机制应对逆境[33-34],其中表现在抗逆基因和蛋白的表达等。不同葡萄品种基因表达表现不一,本研究发现‘申玉’‘申华’‘夏黑’抗逆基因的表达在45℃处理6 h时有恢复趋势,并在后期(150 h)恢复至原初水平,说明高温发生短期内,抗性较强的葡萄会发生可逆性伤害。前人曾报道短期高温会增强辣椒等作物对高温的抵抗能力[35-36],并推断其发生原因是高温增强了植物的细胞膜饱和度,并产生一些保护性的物质,比如糖和蛋白质等。随着生理生化和分子反应的调节,长期高温影响叶片启动修复机制,从而先激发抗逆基因的保护,进而形成高温逆境适应机制。
温度逆境锻炼是提高植物抗逆性的一种有效手段。前人研究表明,高温锻炼可大大提高多种植物的抗高温能力,低温锻炼可明显增强植物的抗寒性。本研究中田间设施条件下的温度变化是呈梯度上升,在“42℃”高温逆境发生时,已经感受了次高温过程(30—37℃),从而增强了适应能力,与前人报道结论相符[37],逆境驯化能提高植物的抗逆性,说明一个不伤害植株正常生长的高温处理可以有效地提高葡萄的耐热抗性[38-39]。另外,本研究发现35℃处理可以诱导葡萄抗逆基因表达,增强葡萄对高温逆境的适应能力。因此判断温度驯化能够增强植物的抗热能力[40-41],这也需要进一步的深入研究。
本研究发现设施条件下高温发生与人工可控条件高温处理之间的抗逆基因和蛋白表达存在差异,主要是源于两种条件下高温发生方式的差异。其中原因之一是次高温驯化过程;其次是两种栽培条件下的葡萄树势存在差异性,在可控条件下就环境和树龄等各种方面还原田间自然高温的发生,为生产提供试验和理论指导,这也是后续研究需要琢磨的重点和难点;第三,田间试验的其他环境因子为不可控因素,为果树试验的主要难点,所以本研究通过两种条件下葡萄的应答反应,能更系统全面地阐述不同葡萄品种的高温应答反应和适应性机制。研究可控条件下高温逆境的葡萄应答反应只能为田间高温发生提供一些理论依据,但是源于田间试验的特殊性和多因素性,用两种方式配合研究具有更强的科学性。
此外,本研究对高温处理后8个葡萄品种叶片的抗氧化酶活性(SOD、POD、CAT)进行了测定(数据未提供),发现生理水平上均有响应高温逆境,但无规律的变化趋势,其原因可能是抗氧化系统的复杂性,说明抗氧化酶活性的变化可能不可以作为评判植物高温胁迫应答反应的统一标准,但仍可间接反应植物的高温逆境响应机制。
4 结论
不同葡萄品种耐热能力有差异,不仅表现于葡萄热害表型,还表现于抗逆基因和蛋白的上调倍数,这源于不同品种的遗传背景差异。‘申丰’‘沪培1号’和‘醉金香’属于抗性较弱的葡萄品种;‘申玉’‘申华’和‘夏黑’的幼苗在长期高温处理后植株表型和抗逆基因表达能恢复至初始水平,这3个品种葡萄能通过增强胁迫适应机制抵抗高温伤害。另外,树龄和高温环境发生方式是影响葡萄幼苗和成年树的抗逆基因和蛋白表达差异的主要因素。
[1] 蒯传化, 刘三军, 吴国良, 杨朝选, 陈勇朋, 王鹏, 刘崇怀, 于巧丽.葡萄日灼病阈值温度及主要影响因子分析. 园艺学报, 2009, 36(8): 1093-1098.
KUAI C H, LIU S J, WU G L, YANG C X, CHEN Y P, WANG P, LIU C H, YU Q L. Analysis of the main factors and threshold temperature on Vitis berry sunburn. Acta Horticulturae Sinica, 2009, 36(8): 1093-1098. (in Chinese)
[2] 杨金虎, 江志红, 魏锋. 近 45 年来中国西北年极端高、低温的变化及对区域性增暖的响应. 干旱区地理, 2006, 29: 625-631.
YANG J H, JIANG Z H, WEI F. Variability of extreme high temperatureand low temperature and their response to regional warming in Northwest China in recent 45 years. Arid Land Geography, 2006, 29:625-631. (in Chinese)
[3] POWERS E T, MORIMOTO R I, DILLIN A, KELLY J W, BALCH W E. Biological and chemical approaches to diseases of proteostasis deficiency. Annual Review of Biochemistry, 2009, 78: 959-991.
[4] HARTL F U, BRACHER A, HAYER-HARTL M. Molecular chaperones in protein folding and proteostasis. Nature, 2011, 475(7356): 324-332.
[5] KOBAYASHI M, KATOH H, TAKAYANAGI T, SUZUKI S. Characterization of thermotolerance-related genes in grapevine (Vitisvinifera). Journal of Plant Physiology, 2010, 167(10): 812-819.
[6] BANILAS G, KORKAS E, ENGLEZOS V, NISIOTOU A A, HATZOPOULOS P. Genome-wide analysis of the heat shock protein 90 gene family in grapevine (Vitis vinifera L.). Australian Journal of Grape and Wine Research, 2012, 18(1): 29-38.
[7] ZHA Q, XI X J, JIANG A L, TIAN Y H. High temperature affects photosynthetic and molecular processes in field-cultivated Vitis vinifera L.× Vitis labrusca L. Photochemistry and Photobiology, 2016, 92(3): 446-454.
[8] HECKATHORN S A, RYAN S L, BAYLIS J A, WANG D, HAMILTON III E W, CUNDIFF L, LUTHE D S.In vivo evidence from an Agrostis stolonifera selection genotype that chloroplast small heat-shock proteins can protect photosystem II during heat stress. Functional Plant Biology, 2002, 29(8): 935-946.
[9] WANG D, LUTHE D S. Heat sensitivity in a bent grass variant. Failure to accumulate a chloroplast heat shock protein isoform implicated in heat tolerance. Plant Physiology, 2003, 133(1): 319-327.
[10] QIAO X, LI M, LI L, YIN H, WU J Y, ZHANG S L. Genome-wide identification and comparative analysis of the heat shock transcription factor family in Chinese white pear (Pyrus bretschneideri) and five other Rosaceae species. BMC Plant Biology, 2015, 15(1): 12.
[11] LIN Q, JIANG Q, LIN J, WANG D L, LI S H, LIU C R, SUN C D, CHEN K S. Heat shock transcription factors expression during fruit development and under hot air stress in Ponkan (Citrus reticulata Blanco cv. Ponkan) fruit. Gene, 2015, 559(2): 129-136.
[12] GIORNO F, GUERRIERO G, BARIC S, MARIANI C. Heat shock transcriptional factors in Malus domestica:identification, classification and expression analysis. BMC Genomics, 2012, 13(1): 639.
[13] TARORA K, TAMAKI M, SHUDO A, URASAKI N, MATSUMURA H, ADANIYA S. Cloning of a heat stress transcription factor, CphsfB1, that is constitutively expressed in radicles and is heat-inducible in the leaves of Carica papaya. Plant Cell, Tissue and Organ Culture, 2010, 102(1): 69-77.
[14] KOTAK S, LARKINDALE J, LEE U, KOSKULL-DÖRING P, VIERLING E, SCHARF K D. Complexity of the heat stress response in plants. Current Opinion in Plant Biology, 2007, 10(3): 310-316.
[15] PILLET J, EGERT A, PIERI P, LECOURIEUX F, KAPPEL C, CHARON J, GOMÈS E, KELLER F, DELROT S, LECOURIEUX D. VvGOLS1 and VvHsfA2 are involved in the heat stress responses in grapevine berries. Plant and Cell Physiology, 2012, 53(10): 1776-1792.
[16] VANDESOMPELE J, DE PRETER K, PATTYN F, POPPE B, ROY N V, PAEPE A D, SPELEMAN F. Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes. Genome Biology, 2002, 3(7): 1-12.
[17] 查倩, 奚晓军, 蒋爱丽, 田益华, 王世平. 葡萄实时定量PCR中稳定内参基因的筛选. 果树学报, 2016, 33(3): 268-274.
ZHA Q, XI X J, JIANG A L, TIAN Y H, WANG S P. Identification of appropriate reference gene by real-time quantitative PCR in grape. Journal of Fruit Science, 2016, 33(3): 268-274. (in Chinese)
[18] DENG W, WANG Y, LIU Z, CHEN H, XU Y. HemI: a toolkit for illustrating heatmaps. PLoS ONE, 2014, 9: e111988.
[19] HREN M, NIKOLIĆ P, ROTTER A, ERMACORA P. 'Bois noir' phytoplasma induces significant reprogramming of the leaf transcriptome in the field grown grapevine. BMC Genomics, 2009, 10(1): 460.
[20] CARVALHO L C, COITO J L, COLAÇO S, SANGIOGO M, AMÂNCIO S. Heat stress in grapevine: the pros and cons of acclimation. Plant Cell Environment, 2015, 38: 777-789.
[21] GUILLAUMIE S, ILG A, RÉTY S, BRETTE M, TROSSAT-MAGNIN C, DECROOCQ S, LÉON C, KEIME C, YE T, BALTENWECKGUYOT R, CLAUDEL P, BORDENAVE L, VANBRABANT S, DUCHÊNE E, DELROT S, DARRIET P, HUGUENEY P, GOMÈS E. Genetic analysis of the biosynthesis of 2-methoxy-3-isobutylpyrazine, a major grape-derived aroma compound impacting wine quality. Plant Physiology, 2013, 162: 604-615.
[22] SHULTZ R W, SETTLAGE S B, HANLEY-BOWDOIN L, THOMPSON W F. A trichloroacetic acid-acetone method greatly reduces infrared auto fluorescence of protein extracts from plant tissue. Plant Molecular Biology Reporter, 2005, 23: 405-409.
[23] WANG L J, FAN L, LOESCHER W, DUAN W, LIU G J, CHENG J S, LUO H B, LI S H. Salicylic acid alleviates decreases in photosynthesis under heat stress and accelerates recovery in grapevine leaves. BMC Plant Biology, 2010, 10: 34.
[24] 万丙良, 查中萍, 戚华雄. 钙依赖的蛋白激酶与植物抗逆性. 生物技术通报, 2009(1): 7-10.
WANG B L, ZHA Z P, QI H X. Calcium-dependent protein kinases (CDPKs) and plant tolerance to environmental stresses. Biotechnology Bulletin, 2009(1): 7-10. (in Chinese)
[25] 裴丽丽, 郭玉华, 徐兆师, 李连城, 陈明, 马有志. 植物逆境胁迫相关蛋白激酶的研究进展. 西北植物学报, 2012, 32(5): 1052-1061.
PEI L L, GUO Y H, XU Z S, LI L C, CHEN M,MA Y Z. Research progress on stress-related protein kinases in plants. Acta Botanica Boreali-Occidentalia Sinica, 2012, 32(5): 1052-1061. (in Chinese)
[26] 查倩,奚晓军, 蒋爱丽, 王世平, 田益华. 高温条件下‘巨玫瑰’葡萄品种叶片表型、可溶性糖和叶绿素荧光特性的研究. 中国农学通报, 2015, 31(25): 118-123.
ZHA Q, XI X J, JIANG AL, WANG S P, TIAN Y H. Study on leaf phenotype, soluble sugar and chlorophyll fluorescence characteristics response to heat stress in ‘Jumeigui’ Grapes. Chinese Agricultural Science Bulletin, 2015, 31(25): 118-123. (in Chinese)
[27] 郭洪雪, 宋希云, 燕增文, 裴玉贺,王海娟,刘兰浩. 高温胁迫对小麦幼苗几个生理生化指标的影响. 华北农学报, 2007, 22(S1): 71-74.
GUO H X, SONG X Y, YAN Z W, PEI Y H, WANG H J, LIU L H. Effects of heat stress on several physiological and biochemical indexes of wheat. Acta Agriculture Boreali-Sinica, 2007, 22(S1): 71-74. (in Chinese)
[28] 段九菊, 王云山, 康黎芳, 张超, 王曼, 杜少敏, 曹冬梅. 高温胁迫对观赏凤梨叶片抗氧化系统和渗透调节物质积累的影响. 中国农学通报, 2010, 26(8): 164-169.
DUAN J J, WANG Y S, KANG L F, ZHANG C, WANG M, DU S M, CAO D M. Effects of high temperature stress on antioxidant system and accumulation of osmotic adjustment substance of bromeliaceae. Chinese Agricultural Science Bulletin, 2010, 26(8): 164-169. (in Chinese)
[29] 周斯建, 义鸣放, 穆鼎. 高温胁迫下铁炮百合幼苗形态及生理反应的初步研究. 园艺学报, 2005, 32(1): 145-147.
ZHOU S J, YI M F, MU D. The preliminary research on the morphological and physiological response to heat stress of Lilium longiflorum seedlings. Acta Horticulturae Sinica, 2005, 32(1): 145-147. (in Chinese)
[30] 张俊环. 葡萄幼苗与果实对温度逆境的交叉适应性及其细胞学机制研究[D]. 北京: 中国农业大学, 2005.
ZHANG J H. Studies on cell physiology of cross adaptation to temperature stress in young grape plants and berries [D]. Beijing: China Agricultural University, 2005. (in Chinese)
[31] ZHA Q, XI X J, JIANG AL, TIAN Y H, WANG S P. Changes in the protective mechanism of photosystem II and molecular regulation in response to high temperature stress in grapevines. Plant Physiology and Biochemistry, 2016, 101: 43-53.
[32] LUO H B, MA L, XI H F, DUAN W, LI S H, LOESCHER W, WANG J F, WANG L J. Photosynthetic response to heat treatments at different temperatures and following recovery in grapevine (Vitis amurenisi L.) leaves. PLoS ONE, 2011, 6: e23033.
[33] FOYER C H, LELANDAIS M, KUNERT K J. Photooxidative stress in plants. Physiologia Plantarum, 1994, 92(4): 696-717.
[34] 杨献光, 梁卫红, 齐志广, 马闻师, 沈银柱. 植物非生物胁迫应答的分子机制. 麦类作物学报, 2006, 26(6): 158-161.
YANG X G, LIANG W H, QI Z G, MA W S, SHEN Y Z. Molecular mechanisms of plant response to abiotic stresses. Journal of Triticeae Crops, 2006, 26(6): 158-161. (in Chinese)
[35] ANDERSON J, MCCOLLUM G, ROBERTS W. High temperature acclimation in pepper leaves. HortScience, 1990, 25(10): 1272-1274.
[36] 吴韩英, 寿森炎, 朱祝军, 杨信廷. 高温胁迫对甜椒光合作用和叶绿素荧光的影响. 园艺学报, 2001, 28(6): 517-521.
WU H Y, SHOU S Y, ZHU Z J, YANG X T. Effects of high temperature stress on photosynthesis and chlorophyll fluorescence in sweet pepper ( Capsicum fructescens L.). Acta Horticulturae Sinica, 2001, 28(6): 517-521. (in Chinese)
[37] 张俊环, 黄卫东. 植物对温度逆境的交叉适应性及其机制研究进展. 中国农学通报, 2003, 19(2): 95-100.
ZHANG J H, HUANG W D. Research advances on mechanism of cross-adaptation to temperature stresses in plants. Chinese Agriculture Science Bulletin, 2003, 19(2): 95-100. (in Chinese)
[38] HOROWITZ M. From molecular and cellular to integrative heat defense during exposure to chronic heat. Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology, 2002, 131(3): 475-483.
[39] MEZA-HERRERA C A, MARTÍNEZ L, ARÉCHIGA ARCHIGA C, BAFIUELOS R, RINCON R M, URRUTIA J, SALINAS H, MELLADO M. Circannual identification and quantification of constitutive heat shock proteins (HSP 70) in goats. Journal of Applied Animal Research, 2006, 29(1): 9-12.
[40] MITTLER R, FINKA A, GOLOUBINOFF P. How do plants feel the heat? Trends in Biochemical Sciences, 2012, 37(3): 118-125.
[41] 陈培琴,郁松林, 詹妍妮. 茉莉酸和高温锻炼对葡萄幼苗耐热性及其抗氧化酶的影响. 生命科学研究, 2006, 10(3): 238-243.
CHEN P Q, YU S L, ZHAN Y N. Effects of jasmonate acid and heat acclimation on thermotolerance and antioxidant enzymes of young grape plants. Life Science Research, 2006, 10(3) 238-243. (in Chinese)
(责任编辑 赵伶俐)
Influence of Heat Stress on the Expression of Related Genes and Proteins in Grapevines
ZHA Qian, XI XiaoJun, JIANG AiLi, TIAN YiHua
(Research Institute of Forestry and Pomology, Shanghai Academy of Agricultural Sciences/Shanghai Key Lab of Protected Horticultural Technology, Shanghai 201403)
【Objective】The suitable air temperature is necessary for growth of grapes. Heat stress often happens in south area of China during grape mature period. The industrial economic benefits of grape are affected by the water-lost leaves and sunburn fruits. So study on the responsive mechanism of grapevines under high temperature stress is particularly important. The present research ismainly focused on the high temperature stress response of young grapes under control condition. As studies on response to high temperature stress in adult grapes are limited, so detailed explanation of high temperature damage in grapevines at different ages could provide a theoretical foundation for prevention of high temperature adversity. 【Method】 This study used 8 table grape varieties in south area of China as experimental materials, including Zuijinxiang, Summer Black, Kyoho, Jumeigui, Shenyu, Shenhua, Shenfeng, and Hupei 1#. Young grapevines (1-year-old) at the same growth stage were acclimated for 7 days in a controlled environment room, with a photoperiod of 14 h light under cool-white fluorescent light at 100 μmol·m-2·s-1. The grape plants were divided into 3 groups and were acclimated for 7 days at normal temperature (25℃). On the following day, 1 group of grapevines was kept at 25℃ in this controlled environment room. The other 2 groups were treated at 35℃or 45℃, respectively, from 10:00 h to 16:00 h (which was stimulated the high temperature levels in the day). The heat response was tested at 0, 3 h, 6 h and 150 h. In addition, the 6-year-old adult grapevines were selected to study heat stress response under field conditions in the present experiment, July 23, 2015 (denoted as “37℃”; highest temperature <40℃) stood for pre-temperature stress and July 31, 2015 (denoted as“42℃”, highest temperature >40℃) stood for post-temperature stress. 【Result】 The phenotype of young grapevines under high temperature stress was observed. The young sprout and aging leaves of Shenyu, Summer Black and Shenhua showed lightly water-loss at the beginning of high temperature stress, and recovered at 150 h. The leaves of Kyoho and Jumeigui showed slightly water-loss at 3 h and seriously water-loss at 6 h under high temperature stress. The leaves of Shenfeng, Hupei 1# and Zuijinxiang showed a seriously water-loss at 3 h, and the leaves of whole plant dry rot at 6 h under high temperature stress. And different temperature treatments (35℃/45℃/“42℃”) induced the expression of resistance genes in young and adult grapevines. However, the expression of genes in levels were different. The higher temperature level induced the greater gene expression. In addition, the expression of GLOS1 and HSFA2 in Shenyu, Shenhua, Zuijinxiang, Kyoho, and Jumeigui and the expression of HSP70 in Shenyu, Shenhua, Summer Black, and Kyoho recovered to the original levels at 6 h/150 h after high temperature treatments. The expression of HSP17.9 was increased by high temperature stress and the expression was not decreased with the prolongation of time. High temperature treatments (45℃/“42℃”) induced the expression levels of HSP21 protein in young and adult grapevines, however, the expression levels of HSP21 protein decreased in some varieties (Shenfeng and Zuijinxiang). 【Conclusion】 It was found that there are differences between different grape cultivars in the tolerance to high temperature stress. Firstly, Shenyu, Shenhua, and Summer Black are more tolerant to high temperature than others. Secondly, the system of heat-tolerance in Kyoho and Jumeigui collapsed. And then, Shenfeng, Hupei 1# and Zuijinxiang belong to the heat-sensitive grape cultivars. In addition, the differences of expression of genes and proteins between the grape seedling and adult trees were due to the tree age and the happening way of high temperature stress.
grapevine; high temperature stress; resistance genes; HSP21
2016-10-27;接受日期:2017-01-22
国家葡萄产业技术体系(CARS-30-9)
联系方式:查倩,E-mail:zhaqian1988@163.com。通信作者蒋爱丽,Tel:021-62208171;E-mail:putaojal@163.com

