优化QuEChERS结合HPLC测定沉积物中14种多环芳烃
吕爱娟,沈小明,时 磊,蔡小虎,沈加林,胡璟珂
中国地质调查局南京地质调查中心,江苏 南京 210016
优化QuEChERS结合HPLC测定沉积物中14种多环芳烃
吕爱娟,沈小明,时 磊,蔡小虎,沈加林,胡璟珂
中国地质调查局南京地质调查中心,江苏 南京 210016
以美国国家标准技术研究院(NIST)2种沉积物标样SRM 1944和SRM 1941b为研究对象,建立并优化了QuEChERS结合HPLC测定沉积物中14种多环芳烃的前处理方法,并与传统索氏提取进行比较。优化后的QuEChERS方法:样品经乙腈浸泡后,超声15 min,漩涡振荡3 min,以NaCl和无水MgSO4盐析,提取液经PSA净化后经HPLC-FLD测定。该条件下14种PAHs的方法检出限为0.5~5.0 μg/kg,SRM 1944和SRM 1941b中PAHs回收率分别为73.4%~104.9%和71.9%~96.4%,相对标准偏差分别为0.47%~3.45% 和0.87%~3.05%。索氏提取SRM1944与1941b回收率分别为78.9%~109.3%和 80.9%~108.2%,相对标准偏差分别为1.46%~10.3%和1.27%~10.8%。优化后的QuEChERS回收率与索氏提取较为接近,但具有更高的精密度。将该方法用于实际海洋沉积物提取,PAHs测定值与索氏提取较为接近。优化后的QuEChERS方法满足批量沉积物样品中PAHs的快速测定要求。
QuEChERS优化;多环芳烃;沉积物;高效液相色谱
多环芳烃(PAHs)是一类环境中普遍存在、具有明显毒性而获得广泛关注的持久性有机污染物。沉积物既是水体有机污染物的最终环境归宿,又是污染物的重要来源。 因此,沉积物中PAHs的分析一直是环境研究的热点[1]。
对于沉积物中PAHs的分析,前处理常用方法为传统的索氏回流提取[2-3]、超声辅助提取[4]、加速溶剂萃取(ASE)[5-6]等,使用的溶剂一般为二氯甲烷[7]、二氯甲烷和丙酮混合物[8],得到提取液再经过浓缩、净化、替换溶剂、最后浓缩成小体积上样。这些提取方法都较为成熟,但仍存在一些不足,如耗时、劳动密集型、需要使用大量有毒有机溶剂(索氏提取和超声)及高成本投资和维护(ASE)等。快速样品前处理技术QuEChERS(Quick、Easy、Cheap、Effective、Rugged、Safe)自2003年开发以来,在食品中的农药分析领域已受到广泛关注,目前已作为检测水果、蔬菜中农药残留时的一种标准前处理方法[9-10]。QuEChERS的基本原理为高湿度样品经乙腈提取后,萃取盐析,通过基质分散萃取去除干扰,萃取液可直接上机检测。QuEChERS简化和缩短了有机化合物的提取步骤,是一种相对环境友好的、高效的前处理技术,越来越涉及到其他领域,如肉类、水产品中的PAHs[11-12],谷物、土壤中的农药残留[13-15]等。 VULLIET等[16]采用QuEChERS法检测了沉积物中苯并(j)荧蒽、二苯并(a,j)蒽、二苯并(a,c)蒽3种PAHs,但目前尚未见到QuEChERS应用于沉积物中USEPA优控的16种PAHs检测的报道。
本文以美国国家标准技术研究院(NIST)研制的沉积物标准样品SRM 1944(航道沉积物)和SRM 1941b(海洋沉积物)为对象,考察了QuEChERS方法在沉积物中优控14种PAHs前处理过程中的准确性和适用性,并对相关技术环节和参数进行优化,以期为沉积物中PAHs快速检测技术提供参考。
1 实验部分
1.1 仪器和试剂
Agilent 1100高效液相色谱系统,荧光检测器(FLD);WH-3漩涡振荡仪;10 μL、100 μL、1 mL、5 mL气密型注射器;Milli-Q纯水系统,KQ-500DE数控超声波清洗器,TDL-5高速离心机。

正己烷、丙酮、二氯甲烷等均为农残级;乙睛为色谱纯;水为Milli-Q超纯水,N-丙基乙二胺(PSA)填料(Welchrom)。
1.2 实验方法
1.2.1 土壤样品的提取和净化
精确称取适量标准样品和已冷冻干燥的样品,分别按以下3种提取方法(索氏提取和QuEChERS)进行提取处理,每个方法平行3份。以空白石英砂为基质进行3种方法的全流程空白实验。
索氏提取条件[17]:200 mL二氯甲烷水浴加热,回流速度控制在6~8次/h,连续回流48 h。将收集的提取液经无水硫酸钠干燥后,60 ℃水浴蒸发溶剂,正己烷替换至10 mL试管,氮吹定容至1~2 mL。硅胶柱净化,20 mL正己烷-二氯甲烷(体积比1∶1)洗脱,洗脱液氮吹,乙腈替换定容至1 mL,待测。
QuEChERS 结合超声提取条件:精密称取2.00 g样品于50 mL具塞玻璃试管中,加入10 mL乙腈,静置过夜,超声15 min,漩涡振荡2 min,加入0.5 g NaCl,1 g无水MgSO4,漩涡振荡1 min,溶液过0.45 μm滤膜,取滤液,加入200 mg PSA,漩涡30 s,3 500 r/min 离心 3 min,取上清液待测,另取5 mL上清液于60 ℃水浴氮吹浓缩至1 mL,待测。
1.2.2 色谱条件
SupelcosilTMLC-PAH专用液相色谱柱(15 cm×4.6 mm,0.5 μm);柱温20 ℃;进样体积15 μL;流速0.8 mL/min;流动相为乙腈-水,梯度洗脱:0~10 min时,60%乙腈(体积分数,下同);10~20 min时,60%~100%乙腈;20~36 min时,100%乙腈;荧光检测器(FLD)采用程序波长检测,见表1。

表1 荧光检测波长程序
2 结果与讨论
2.1 提取溶剂的比较
分别选择乙腈、二氯甲烷、正己烷-丙酮(体积比1∶1)作为提取溶剂来考察QuEChERS法对NIST SRM 1944和SRM 1941b 2种沉积物标准中PAHs提取效率的影响,每种溶剂平行5份。用高速漩涡代替原QuEChERS 方法中的振摇提取。实验结果表明,这3种溶剂对14种PAHs的提取效率无显著性差异(PAHs单组分q检验,P=0.05)。二氯甲烷、正己烷-丙酮(体积比1∶1)是常规方法提取沉积物中PAHs使用较多的溶剂,在进行HPLC分析测定前,均需进行溶剂替换。而乙腈作为QuEChERS方法常用的提取溶剂,易于盐析,与LC兼容可直接进样测定。因此,本实验最终确定乙腈作为提取溶剂。
2.2 QuEChERS提取方法的优化
初期实验发现,单纯仅通过漩涡来提取2种沉积物标样中的PAHs,均存在回收率偏低的问题(图1、图2)。由于沉积物标样均为干性基质,PAHs与样品结合较为紧密,而漩涡在萃取方式上相对柔和,样品与溶剂接触时间短使得目标化合物不能有效溶出,上述因素均可影响PAHs的提取效率。因此,有必要在漩涡基础上增加一些辅助手段,提高目标化合物的提取效率。

图1 不同提取方法对NIST SRM 1944提取效率的比较(n=3)Fig.1 Comparison of the PAHs extraction efficiency for NIST SRM 1941b according to different extraction procedures (n=3)
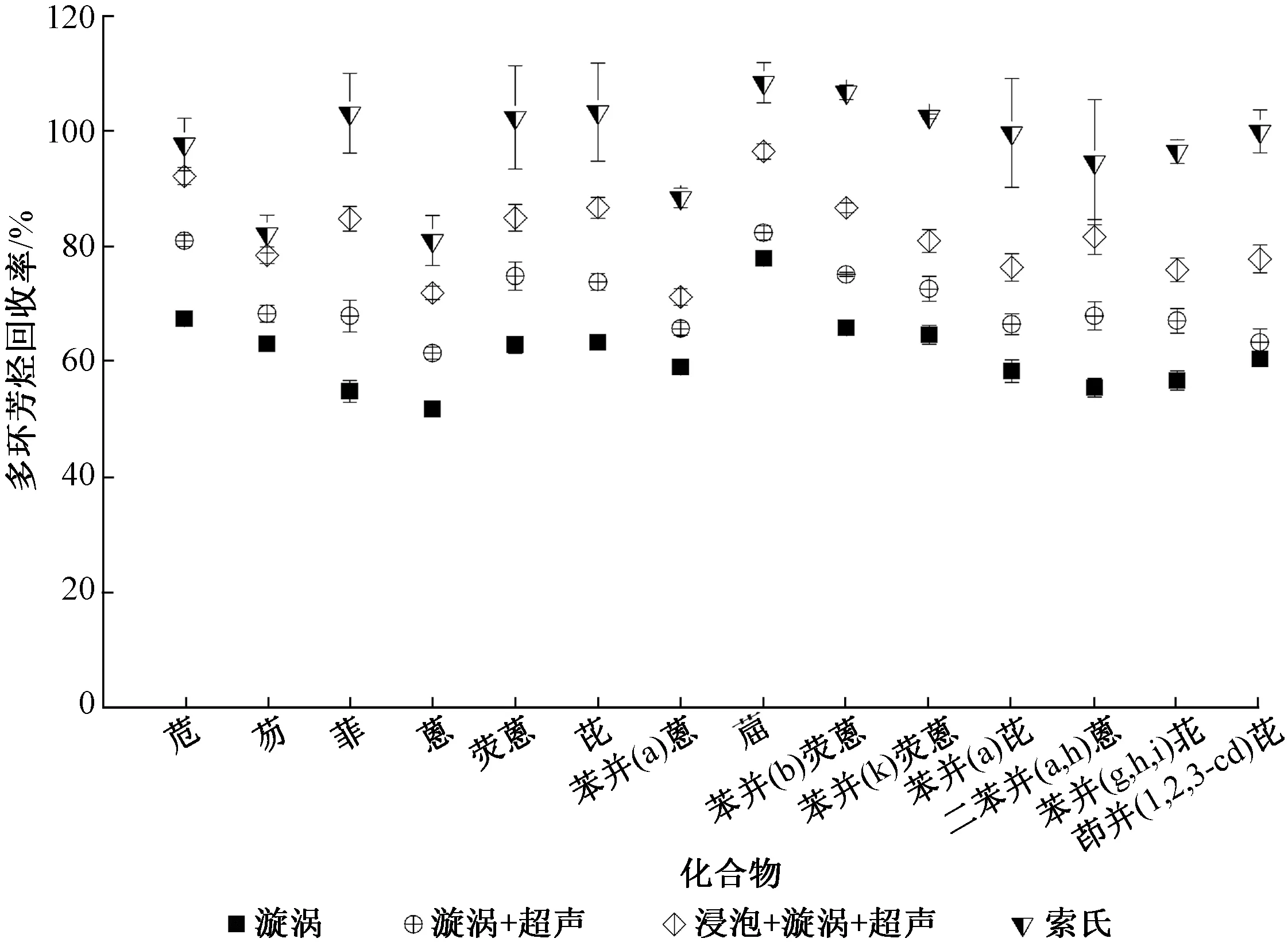
图2 不同提取方法对NIST SRM 1941b提取效率的比较(n=3)Fig.2 Comparison of the PAHs extraction efficiency for NIST SRM 1941b according to different extraction procedures(n=3)
超声波辅助提取是应用较为普遍的一种前处理方法,利用超声波的机械效应、空化效应以及热效应等来增大介质分子的运动速度及穿透力,从而使目标化合物的提取更为有效。增加样品与溶剂的接触时间一定程度上也能增加目标化合物的溶出率。因此,本研究在单独漩涡振荡3 min的基础上,分别设计了超声+漩涡和浸泡过夜+超声+漩涡2种方案,分别对SRM1944和SRM1941b进行提取测定,结果与标准参考值比较,计算回收率。同时为确保实验结果的准确性,用传统的索氏提取对2种沉积物标样进行提取测定。考虑到超声时间设定过长会因为热效应导致提取溶剂温度升高,进而挥发造成损失,故设定其提取时间为15 min。几种提取方案的结果分别见图1和图2。
图1、图2结果显示, SRM 1944与1941b 中 14种PAHs索氏回收率分别为78.9%~109.3%和80.9%~108.2%,相对标准偏差分别为1.46%~10.3%和1.27%~10.8%,说明标准样品总体性质稳定,能保证实验结果的可靠性。不同提取方案对这2种沉积物标准样的提取效率从大到小顺序依次为索氏浸泡+超声+漩涡超声+漩涡漩涡。沉积物通过预先浸泡,再通过超声+漩涡提取,PAHs的回收率能明显提高,SRM 1944与1941b中14种PAHs回收率分别为72.8%~104.9%、71.9%~96.4%,相对标准偏差分别为0.47%~3.45%和0.87%~3.05%,符合EPA8000C[18]关于基质加标回收率70%~130%的要求。
2.3 QuEChERS净化方法的优化
QuEChERS净化步骤关键在于吸附剂的选择。常用的吸附剂有PSA(N-丙基乙二胺)、GCB(石墨化炭黑)及Florisil(弗罗里硅土)。PSA能去除提取液中的色素、有机酸、脂肪酸等;GCB常用于去除色素、甾醇类物质等,但对平面结构化合物会形成强烈的吸附;Florisil主要用于吸附极性化合物。沉积物中存在腐殖质、色素等,根据沉积物和PAHs特点,结合文献[19-20],本文主要比较了PSA和Florisil:将200 mg以上2种吸附剂分别加入未净化的沉积物标准样品SRM 1944和1941b乙腈提取液中,结果显示PSA和Florisil均不会对PAHs有损失,与Florisil相比,PSA取得了理想的吸附效果:能明显吸附溶液中色素,减少提取液中的杂质。
优化后的QuEChERS方法流程简单,避免了索氏提取等传统方法溶剂使用量大、容器之间的替换和溶剂浓缩使得误差增大等缺点,降低了重复样品测定的标准偏差,使得沉积物中PAHs的测定值更为准确。
2.4 校准曲线和方法检出限
精密吸取EPA 610 PAHs混合标样1 mL于100 mL棕色容量瓶中,乙腈稀释至刻度,再稀释成系列浓度的标准溶液,上机分析。取10g空白石英砂,加入PAHs标准溶液,加标量满足14种PAHs的信噪比大于10,按照样品分析的全部步骤,进行7次重复操作,求得7次测定值的标准偏差S,依照《环境监测分析方法标准制修订技术导则》(HJ 168—2010)计算方法检出限,各组分的线性相关系数都在0.999 5以上,14种PAHs的方法检出限为0.5~5.0 μg/kg(表2)。QuEChERS方法稀释倍数较高,实验将氮吹浓缩前后的提取液进行测定,结果表明PAHs浓度无明显差异。因此,在实际沉积物样品检测过程中,可根据样品中PAHs的含量以及检出限要求选择是否浓缩。

表2 沉积物中14种PAHs的标准曲线和方法检出限
2.5 沉积物样品的分析
为进一步验证本研究建立的QuEChERS方法的可靠性,部分实际沉积物样品采用本法进行了检测,与索氏结果进行了比对,结果见表3。
从沉积物样品PAHs结果来看,样品1(除苊外)和样品2中14种PAHs均有检出:其中优化QuEChERS提取和索氏提取样品1中PAHs含量范围分别为ND~50.3 μg/kg和ND~54.7 μg/kg,样品2中PAHs含量分别为48.8~2 530 μg/kg和47.8~2 442 μg/kg。样品1 优化后QuEChERS测定值与索氏提取的比率为0.77~0.99,样品2为0.87~1.20,索氏提取和优化后的QuEChERS方法对沉积物中高低浓度的PAHs测定结果比较接近,且优化后的QuEChERS方法相对标准偏差小。实际样品结果表明,QuEChERS方法应用于沉积物中PAHs的检测是可行的,适合批量沉积物样品中PAHs快速分析测定,具有较为广泛的应用前景。

表3 采用QuEChERS与索氏法测定的沉积物样品PAHs结果对比(n=3)
3 结论
本研究开发的QuEChERS方案:样品以乙腈浸泡过夜后,超声15 min,高速漩涡3 min,上清液浓缩后以无水MgSO4+PSA净化,HPLC-FLD检测。实验以沉积物标准样品SRM 1944和SRM 1941b来考察QuEChERS技术参数,并与索氏提取相比较,14种PAHs回收率比较接近,但QuEChERS方法精密度更高。优化后的QuEChERS方法可以大大提高批量沉积物中PAHs的分析测试效率。
[1] 刘虎威,肖宁宁,李润锴.河流沉积物中有机污染物的分析研究进展[J].中国环境监测,2001,17(5):12-16.
LIU Huwei,Xiao Ningning,Li Runkei,et al. Advances in analysis of organic pollutants in river sediment in China[J]. Environmental Monitoring in China,2001,17(5):12-16.
[2] 房丽萍,吴忠祥,王伟,等.河流沉积物多环芳烃标准样品的制备与定值[J].岩矿测试,2013,32(5):767-774.
FANG Liping,WU Zhongxian,WANG Wei,et al. Preparation and certification of river sediment reference material for polycyclic aromatic hydrocarbons[J]. Rock and Mineral Analysis,2013,32(5):767-774.
[3] 李利荣,王艳丽,高璟赟,等.中国表层水体沉积物中多环芳烃源解析及评价[J].中国环境监测,2013,29(6):92-98.
LI Llrong,WANG Yanli,GAO Jingyun,et al. Source and risk assessment of PAHs in surface sediments from rivers and lakes of China[J]. Environmental Monitoring in China,2013,29(6):92-98.
[5] 王新成,赵金,赵汝松,等.加速溶剂提取气-质联用分析土壤中的多环芳烃[J].中国环境监测,2014,30(3):144-148.
WANG Xincheng,ZHAO Jin,ZHAO Rusong,et al. Determination of polycyclic aromatic hydrocarbons in soils using accelerated solvent extraction and gas chromatography-mass spectrometry[J]. Environmental Pollution, 2014,30(3):144-148.
[6] 梁柳玲,邓超冰,廖平德,等.南宁城市内河水体和表层沉积物中多环芳烃分布特征[J].中国环境监测, 2012,28(5):67-70.
LIANG Liuling,DENG Chaobing,LIAO Pingde,et al. Distribution characteristics of PAHs in water and surface sediments from the rivers of Nanning City[J]. Environmental Pollution, 2012,28(5):67-70.
[7] MALISZEWSKA-KORDYBACH B, SMRECZAK B, KLIMKOWICZ-PAWLAS A, et al. Monitoring of the total content of polycyclic aromatic hydrocarbons (PAHs) in arable soils in Poland[J]. Chemosphere, 2008, 73(8): 1 284-1 291.
[8] 张茜,刘潇威,罗铭,等.快速溶剂(ASE)提取、凝胶渗透色谱(GPC)联合固相萃取(SPE)净化,高效液相色谱法测定土壤中的多环芳烃[J].环境化学,2011,30(4): 771-777.
ZHANG Qian,LIU Xiaowei,LUO Ming,et al.Determination of polycyclic aromatic hydrocarbons in soil by ASE-GPC-SPE purification and HPLC detection[J]. Environmental Chemistry,2011,30(4): 771-777.
[9] ANASTASSIADES M, LEHOTAY S J,TAJNBAHER D, et al. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and “dispersive solid-phase extraction” for the determination of pesticide residues in produce[J]. Journal of AOAC International, 2003, 86(2): 412-431.
[10] EN BS. Foods of Plant Origin-Determination of Pesticide Residues Using GC-MS and/or LC-MS/MS Following Acetonitrile Extraction/Partitioning and Clean-up by Dispersive SPE-QuEChERS-Method:15662-2008[S/OL].[2012-07-12]. http://esearch. cen. eu/esearch.
[11] KAO T H, CHEN S, CHEN C J, et al. Evaluation of analysis of Polycyclic Aromatic Hydrocarbons by the QuEChERS method and Gas Chromatography-Mass Spectrometry and their formation in poultry meat as affected by marinating and frying[J]. Journal of Agricultural and Food Chemistry, 2012, 60(6): 1 380-1 389.
[12] 罗辉泰,黄晓兰,吴惠勤,等.QuEChERS/液相色谱-串联质谱法同时测定鱼肉中 30 种激素类及氯霉素类药物残留[J].分析测试学报, 2011, 30(12): 1 329-1 337.
LUO Huitian,HUANG Xiaolan,WU Huiqin,et al. Simultaneous determination of 30 hormones and chloramphenicols residues in fish using QuEChERS sample preparation and Liquid Chromatography-Tandem Mass Spectrometry[J]. Journal of Instrumental Analysis, 2011, 30(12): 1 329-1 337.
[13] 梁林,潘金菊,刘伟.超高效液相色谱-串联质谱法同时测定玉米及土壤中烟嘧磺隆和2甲4氯残留[J]. 农药学学报,2012,14(6):659-663.
LIANG Lin,PAN Jinju,LIU Wei. Simultaneous determination of nicosulfuron and MCPA residues in corn and soil by ultraperformance liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Pesticide Science,2012,14(6):659-663.
[14] DANKYI E, GORDON C, CARBOO D, et al. Quantification of neonicotinoid insecticide residues in soils from cocoa plantations using a QuEChERS extraction procedure and LC-MS/MS[J]. Science of the Total Environment, 2014, 499: 276-283.
[15] 朱永哲,冯雅男,金正汉.超高效液相色谱-串联质谱法同时测定土壤中239种农药的残留量[J].色谱,2013,31(9):850-861.
ZHU Yongze,FENG Yanan, KIM Jeonghan. Determination of 239 pesticide residues in soil byultra performance liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Chromatography,2013,31(9):850-861.
[16] VULLIET E, BERLIOZ-BARBIER A, LAFAY F, et al. A national reconnaissance for selected organic micropollutants in sediments on French territory[J]. Environmental Science and Pollution Research, 2014, 21(19): 11 370-11 379.
[17] 沈小明,吕爱娟,沈加林.不同提取方法测定海洋沉积物中痕量PAHs的比较[J].环境化学,2010,29(6):1 177-1 178.
SHEN Xiaoming,LYU Aijuan,SHEN Jialin. Comparison of different extraction methods for the determination of trace PAHs in marine sediments[J].Environmental Chemistry,2010,29(6):1 177-1 178.
[18] USEPA.Determinative chromatographic separations:US EPA Mehtod 8000c[S/OL].[2011-06-05]. http://www.docin.com/p-215761701.html.
[19] 赵洁,何强,姚秉华,等.改进 QuEChERS-气相色谱-质谱法快速分析测定农用土壤中多环芳烃[J].分析试验室,2012,31(2):33-37.
ZHAO Jie,HE Qiang,YAO Binghua,et al. Rapid determination of polycyclic aromatic hydrocarbons in farmland soils by GC-MS coupled with modified QuEChERS[J]. Chinese Journal of Analysis Laboratory,2012,31(2):33-37.
[20] ALBINET A, TOMAZ S, LESTREMAU F. A really quick easy cheap effective rugged and safe (QuEChERS) extraction procedure for the analysis of particle-bound PAHs in ambient air and emission samples[J]. Science of the Total Environment, 2013, 450: 31-38.
Determination of 14 Polycyclic Aromatic Hydrocarbons in Sediment by HPLC Coupled with Optimized QuEChERS
LYU Aijuan, SHEN Xiaoming, SHI Lei, CAI Xiaohu, SHEN Jialin, HU Jingke
Nanjing Centre, China Geological Survey, Nanjing 210016, China
The preparation method for determination of 14 polycyclic aromatic hydrocarbons (PAHs) in sediment using reference materials SRM1944 and SRM1941b from the National Institute of Standards and Technology (NIST) by high performance liquid chromatographic (HPLC) coupled with modified QuEChERS was developed, and compared with Soxhlet extraction. Route for the optimized QuEChERS method was: Samples soaked with acetonitrile, ultrasonic extracted 15 minutes, vortex oscillated 3 minutes, and were salted out by NaCl and MgSO4, then the extraction solvent was cleaned up with PSA, analyzed by HPLC with fluorescence detector. The limits of detection for 14 PAHs under optimum conditions were in the range of 0.5-5.0 μg/kg. Recovery rates for PAHs by QuEChERS and Soxhlet extraction in SRM1944 and SRM1941b were ranged from 73.4%-104.9%, 71.9%-96.4% and 78.9%-109.3%, 80.9%-108.2%, with relative standard deviations 0.47%-3.45%, 0.87%-3.05% and 1.46%-10.3%, 1.27%-10.8%. Recovery rates of optimized QuEChERS were in agreement with Soxhlet extraction, but with higher precision. This method was applied in the determination of PAHs in marine sediment, and the results were close to Soxhlet extraction. The optimized QuEChERS method meets the requirement for the rapid determination of PAHs in batch sediment samples.
optimized QuEChERS; polycyclic aromatic hydrocarbons; sediment; HPLC
2015-10-28;
2016-02-25
地质大调查项目“持久性有机污染物实验技术与分析方法研究”(1212011120274)
吕爱娟(1981-),女,江苏常州人,硕士,工程师。
X833
A
1002-6002(2017)01- 0115- 06
10.19316/j.issn.1002-6002.2017.01.17

