湖南桃江病圃稻瘟病菌对24个水稻抗稻瘟基因的毒性分析
周 瑚, 任佐华, 虞选杰, 毛 锐,刘 翔, 张译允, 王恒沪, 刘二明*
(1. 湖南农业大学植物保护学院, 长沙 410128; 2. 植物病虫害生物学与防控湖南省重点实验室,长沙 410128; 3. 南方粮油作物协同创新中心, 长沙 410128)
湖南桃江病圃稻瘟病菌对24个水稻抗稻瘟基因的毒性分析
周 瑚1,2,3, 任佐华1,2, 虞选杰1,2, 毛 锐1,2,3,刘 翔1,2,3, 张译允1, 王恒沪1, 刘二明1,2,3*
(1. 湖南农业大学植物保护学院, 长沙 410128; 2. 植物病虫害生物学与防控湖南省重点实验室,长沙 410128; 3. 南方粮油作物协同创新中心, 长沙 410128)
稻瘟病是水稻生产上的重要病害,了解稻瘟病菌群体毒性组成是水稻抗病品种合理布局的重要基础。2012-2015年从湖南桃江病圃中不含已知抗瘟基因的水稻品种‘丽江新团黑谷’上成功分离出351个稻瘟病菌单孢菌株,在温室于水稻5叶期采用离体接种法测定了其对24个水稻抗稻瘟病单基因系的毒性,结果表明,病圃中稻瘟病菌以广谱强致病性的菌株为主,病菌对不同抗瘟基因的毒力频率在50.56%~96.67%之间,而不同年度间对24个抗性基因均具毒性的菌株出现频率在0~15%之间。对2015年的每2个抗瘟基因的联合毒力分析表明,基因两两搭配后的联合抗病系数最高、联合致病系数最低的组合是Pi-3*Pi-k(RAC=0.19, PAC=0.43)。
稻瘟病菌; 近等基因系; 毒力频率
水稻是全世界最重要的粮食作物之一,全球一半以上的人口以水稻为主食。由子囊菌Magnaportheoryzae引起的稻瘟病是影响水稻生产最严重的病害之一[1],选育和推广抗病品种是防止稻瘟病流行和危害最经济、有效和安全的策略,但多年生产实践表明,由于品种大面积推广造成的选择压力致使病菌新生理小种或毒性类型出现,水稻抗病品种往往大面积推广3年左右就可能丧失抗病作用[2-4]。因此,不断了解病菌的毒性组成和变化,对于抗病品种选育及合理布局极为重要。目前,在水稻及其近缘野生种中已鉴定出位于69个抗稻瘟病位点的84个主效基因,其中24个基因已被克隆[3]。国际水稻研究所(IRBL)与日本合作,利用中国提供的普感水稻品种‘丽江新团黑谷’(LTH)为轮回亲本与具有已知抗病基因的籼稻、粳稻品种多次回交育成了24个水稻抗稻瘟病单基因系[4],目前已广泛应用于基因聚合、病菌毒性分析和监测等研究,对抗病品种合理布局起到指导作用[5-6]。
湖南桃江病圃位于湖南省桃江县高桥镇梅水洞村,由于其具有良好的生态环境和稻瘟病发病条件,是国家水稻区域试验长江中游生态区抗稻瘟病鉴定基地,每年为全国科研、生产单位鉴定大量育种材料和生产品种。了解和监测该病圃稻瘟病菌群体的毒性组成对于抗病品种选育和大面积推广具有重要意义。本研究从该病圃栽种的‘LTH’上分离获得了351个稻瘟病菌单孢菌株,并测定了其对24个主要抗瘟基因的毒性,以期为水稻抗病育种、品种布局和病害控制提供依据。
1 材料与方法
1.1 供试菌株
供试稻瘟病菌单孢菌株于2012-2015年从湖南省益阳市桃江县稻瘟病病圃(N28°22′, E112°03′)内普感稻瘟病品种‘丽江新团黑谷’(LTH)的叶瘟标本上分离获得,共计351个,2012-2015年各年度分别分离获得100、89、120和42株。
1.2 供试水稻品种
普感稻瘟病品种‘LTH’,以及24个水稻抗稻瘟病单基因系(表1)原种由中国农业大学彭友良教授提供,湖南农业大学植物病原微生物实验室保存和繁殖。
1.3 孢子繁殖、孢子悬浮液制备、接种
将保存于高粱粒上的各稻瘟病菌单孢菌株用可溶性淀粉培养基26~28℃活化培养5~7 d[7],挑取菌块转接至番茄燕麦培养基,待菌基本长满整个培养皿时,首先用灭菌棉签打断菌丝,再加入无菌水洗培养皿上的菌丝,吸取洗下的菌液均匀涂布在新的番茄燕麦培养基上,置于28℃培养箱内光暗交替(L∥D=12 h∥12 h)进行产孢培养4 d左右。用添加1‰Tween-20的无菌水洗孢子,利用血球计数板将各孢子悬浮液的孢子浓度调节为2×105个/mL,以供接种[8]。
1.4 秧苗管理和接种
在肥沃的供试土壤中加入适量营养剂[9]备用。稻种催芽前可通过烘干晒种提高发芽率。待用种子用清水在室温环境下浸泡12 h后置于28℃的环境中定期换水催芽1~2 d,待芽长至1 cm左右时播种于育苗盘内。当水稻秧苗长至1叶1心、3叶1心及接种的前3 d,各追施一次氮肥。
接种前3 d将所需试验用品及试验接种房进行全方位的消毒处理。采用离体针刺接种法接种尚未完全展开的第5叶,在相对湿度100%、28℃环境下完全黑暗处理24 h,然后按正常的光暗交替周期培养。期间随时观察病斑的亲和反应型,4~7 d后记录发病情况并拍照。当接种叶段没有病斑或仅有黑褐色坏死斑,为抗病反应型;当病斑较大,病斑中央灰白色,边缘褐色或有黄色晕圈时,为感病反应型[10]。
1.5 叶瘟田间自然诱发鉴定
田间病圃叶瘟自然诱发鉴定试验地设在湖南省桃江县稻瘟病病圃。25个供试品种于5月中下旬采用条播[11]方式播种。田间分厢,对照品种‘LTH’作为诱发品种插植在每厢中间,两边随机排列待鉴定品种,试验共设3次重复。试验田块按照当地丰产栽培方式常规管理,不施用杀菌剂,根据当地虫害发生情况选用适当药剂正常防治虫害。在当年的6月下旬‘LTH’均匀发病,且病情稳定后(叶面布满典型病斑或枯死)进行田间叶瘟调查,按照湖南省地方标准DB 43/TXXX-2006,0~9级制调查病情,记录数据(其中0~3级为抗病,4~9级为感病)[12-13]。
1.6 病害调查数据分析
病菌菌株接种品种后引起感病反应记为毒性菌株,稻瘟病菌群体的毒力频率(virulence frequency,VF,%)=对测试水稻品种有毒性菌株数/接种菌株数×100;当VF≥70%时为病菌群体表现强毒力,50%≤VF<70%时为较强毒力,20%≤VF<50%时为中等毒力,VF<20%时为弱毒力[14]。
联合致病性系数(pathogenicity association coefficient, PAC)=(对供试2个Pi组合中菌具毒性的菌株数/测试总株数)×100%;联合抗病性系数(resistance association coefficient, RAC)=(对供试2个抗性基因均不具毒性的菌株数/测试总株数)×100%[15]。
2 结果与分析
2.1 351个单孢菌株对24个单基因系毒力表现
2012-2015年分离的351个单孢菌株对24个单基因系水稻品种的毒性测定结果(表1)表明,各年度病菌对24个抗稻瘟病基因的毒力频率都在50.56%以上,最高达96.67%。
从菌株毒力频率年度的结果看,病菌群体具最低、最高毒力频率的抗稻瘟基因在年度之间具有差异,2012年分别为Pi-zt(VF=56%),Pi-19(VF=92%);2013年分别为Pi-5(VF=50.56%),Pi-a(VF=77.53%);2014年分别为Pi-sh(VF=55%) 和Pi-kp(VF=96.67%);2015年则分别为Pi-3、Pi-20(VF=57.14%)和Pi-zt(VF=92.86%)。4年间病菌群体对抗瘟基因Pi-ta(VF=64.86%)的平均毒力频率最低;抗瘟基因Pi-11(VF=83.08%)平均毒力频率最高,其中抗瘟基因Pi-a、Pi-km和Pi-11的毒力频率连续4年都维持在70%以上。2012-2015年期间病菌对抗瘟基因Pi-ta的毒力频率表现最为稳定,而对Pi-ks、Pi-kp、Pi-zt、Pi-b、Pi-12等5个抗性基因的毒力频率变化较大,其中毒力频率逐渐增长的有Pi-zt、Pi-5、Pi-km和Pi-i等基因。
2012-2015年分离的351个单孢菌株对24个抗性基因均具毒性的菌株共有17株,占总菌数的4.84%;其中2012年对24个基因皆具毒性的菌株有15株,出现频率占当年总菌株数的15%;而2013年和2014年则没有对24个抗性基因皆具毒性的菌株;2015年对所有24个抗性基因皆具毒性的菌株仅有2株,占当年总菌数的4.76%,不同年度间对24个抗性基因均具毒性的菌株出现频率在0~15%之间。
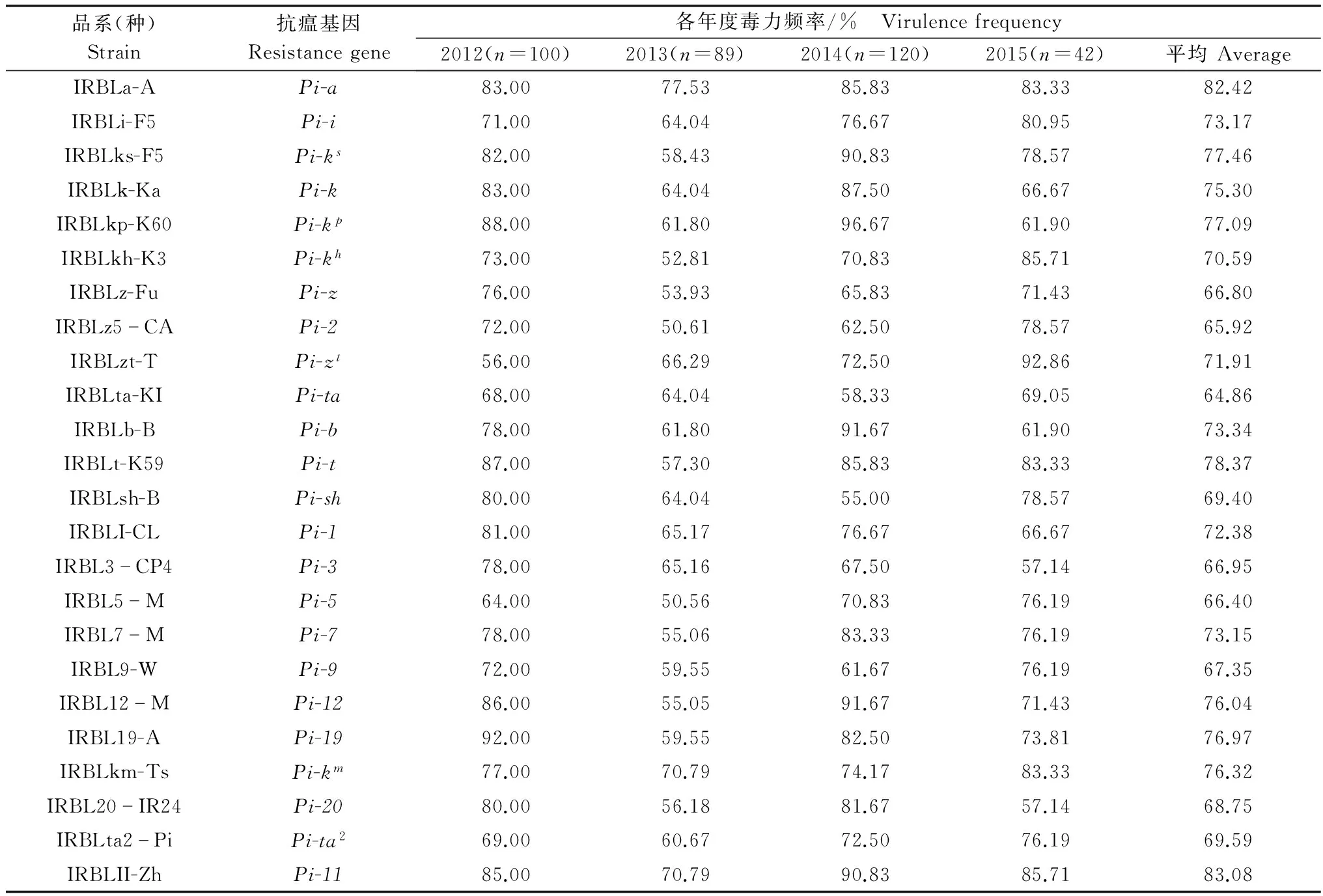
表1 不同年份稻瘟病菌菌株对24个抗瘟基因的毒力频率1)
1) 2012、2013、2014、2015代表年份,括号内的数字代表该年度分离的菌株数。 2012,2013,2014 and 2015 represent the year of investigation, the data in brackets represent the numbers of isolatedM.oryzaestrains in that year.
2.2 24个单基因系在病圃对叶瘟的抗性
2012年和2014年,将24个单基因系水稻种植在桃江病圃,当对照感病品种‘LTH’均匀发病时进行田间病圃鉴定,结果表明(表2),24个近等基因系水稻品种中绝大多数表现为感或高感,相对2012年,24个单基因系水稻材料在2014年对叶瘟的抗性程度有所下降;综合表1结果显示,各水稻材料在病圃叶瘟时期的抗性表现与室内离体接种鉴定的毒力频率存在一定的相关性,如2012年和2014年抗瘟基因Pi-a田间病圃叶瘟平均病级分别为6和7,其相应年度的毒力频率分别为83.00%和85.83%;各年度毒力频率较低且表现较稳定的抗瘟基因Pi-ta,其相应的叶瘟病级分别为5和6;同时毒力频率较高且表现较稳定抗瘟基因Pi-11,其相应的叶瘟病级分别为8和9;受自然环境影响抗瘟基因Pi-9、Pi-zt部分数据缺失,抗瘟基因Pi-12、Pi-19和Pi-20的田间病圃叶瘟平均病级与室内离体接种鉴定结果的变化规律尚不明确。

表2 24个单基因系水稻病圃叶瘟抗性鉴定结果1)
1) “-”表示因客观环境问题导致该项数据缺失。 “-”indicates that the data were missing because of the objective environmental factors.
2.3 2015年联合致病性系数和联合抗病性系数分析
2015年度菌株对不同抗瘟基因双基因组合的联合抗病性系数(RAC)(表3)分析结果表明,RAC相对较高的有Pi-3*Pi-kp(RAC=0.26),Pi-3*Pi-b(RAC=0.24),Pi-kp*Pi-b(RAC=0.21),Pi-k*Pi-12 (RAC=0.21),Pi-k*Pi-20 (RAC=0.21),Pi-12*Pi-20 (RAC=0.21);而联合致病性系数相对较高的有Pi-zt*Pi-a(PAC=0.79),Pi-zt*Pi-kh(PAC=0.79),Pi-zt*Pi-t(PAC=0.79),Pi-zt*Pi-11 (PAC=0.79),Pi-t*Pi-kh(PAC=0.76),Pi-zt*Pi-sh(PAC=0.76),Pi-zt*Pi-km(PAC=0.76)。
联合致病性系数高且联合抗病性系数低的抗瘟基因组合有Pi-zt*Pi-kh(0.79,0.00),Pi-zt*Pi-km(0.76,0.00),Pi-zt*Pi-a(0.79,0.02),Pi-zt*Pi-t(0.79,0.02),Pi-zt*Pi-11(0.79,0.00);联合致病性系数低且联合抗病性系数高的组合有Pi-3*Pi-k(0.43,0.19),Pi-3*Pi-1(0.43,0.19),Pi-20*Pi-b(0.36,0.17)。
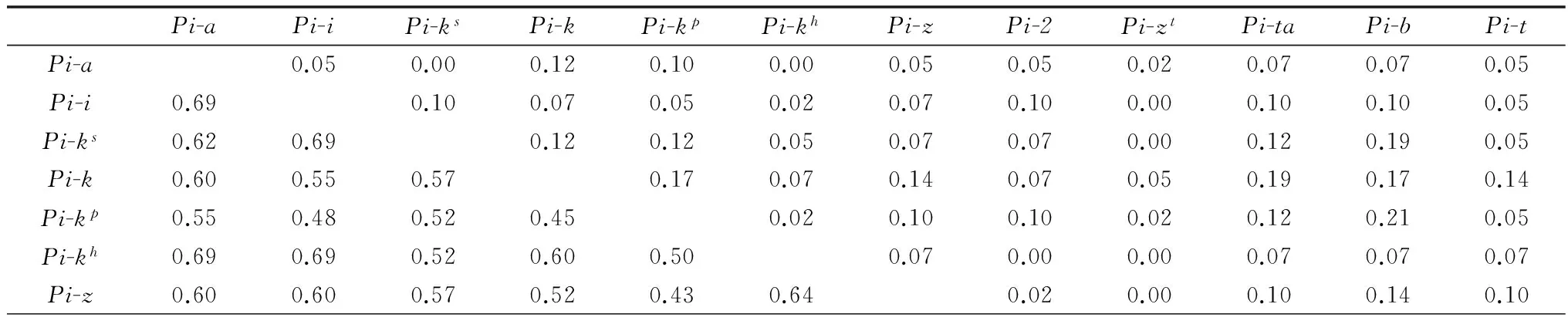
表3 2015年度水稻抗瘟基因的联合致病性系数和联合抗病性系数
续表3 Table 3(Continued)
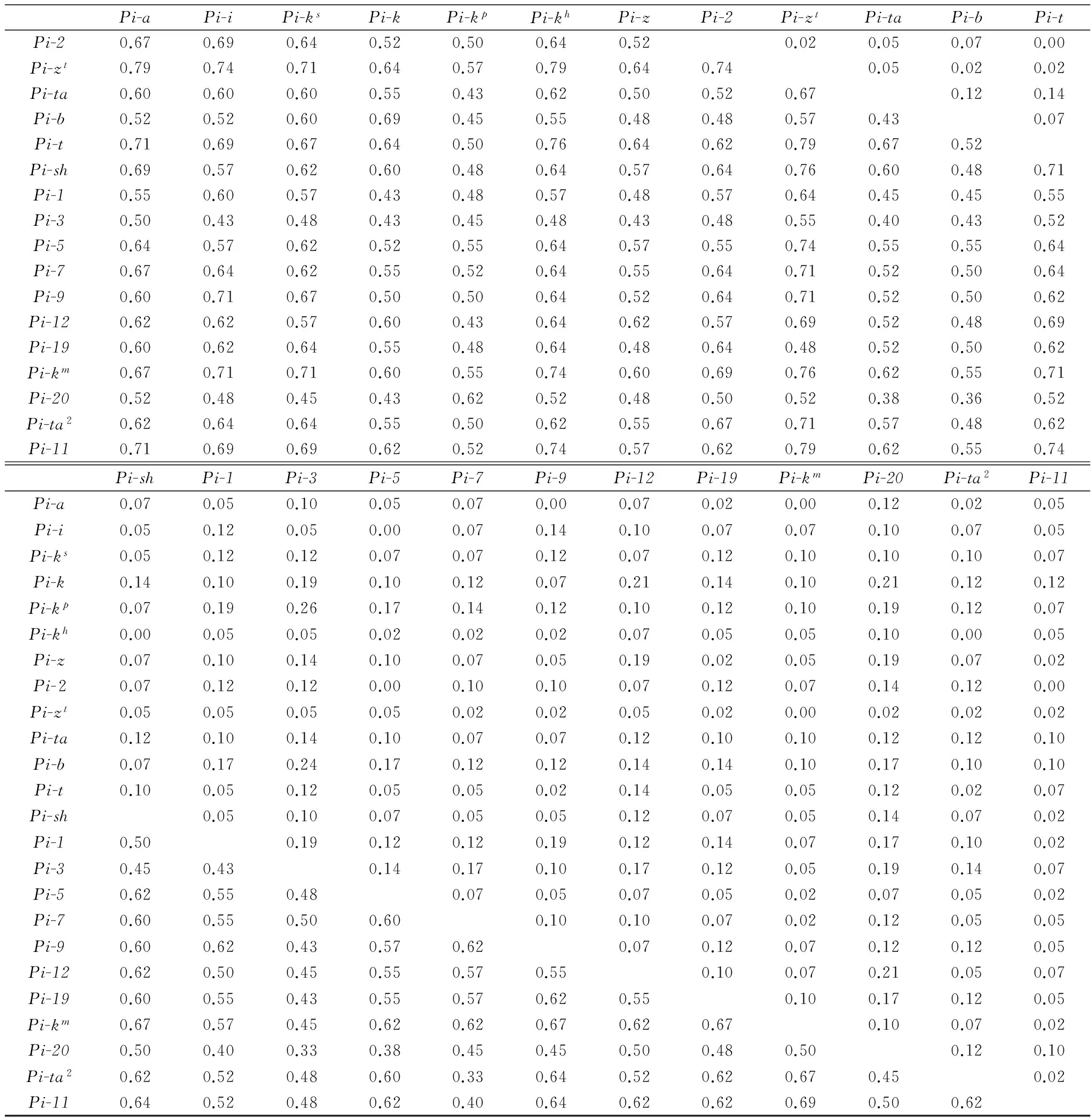
Pi-aPi-iPi-ksPi-kPi-kpPi-khPi-zPi-2Pi-ztPi-taPi-bPi-tPi-20.670.690.640.520.500.640.520.020.050.070.00Pi-zt0.790.740.710.640.570.790.640.740.050.020.02Pi-ta0.600.600.600.550.430.620.500.520.670.120.14Pi-b0.520.520.600.690.450.550.480.480.570.430.07Pi-t0.710.690.670.640.500.760.640.620.790.670.52Pi-sh0.690.570.620.600.480.640.570.640.760.600.480.71Pi-10.550.600.570.430.480.570.480.570.640.450.450.55Pi-30.500.430.480.430.450.480.430.480.550.400.430.52Pi-50.640.570.620.520.550.640.570.550.740.550.550.64Pi-70.670.640.620.550.520.640.550.640.710.520.500.64Pi-90.600.710.670.500.500.640.520.640.710.520.500.62Pi-120.620.620.570.600.430.640.620.570.690.520.480.69Pi-190.600.620.640.550.480.640.480.640.480.520.500.62Pi-km0.670.710.710.600.550.740.600.690.760.620.550.71Pi-200.520.480.450.430.620.520.480.500.520.380.360.52Pi-ta20.620.640.640.550.500.620.550.670.710.570.480.62Pi-110.710.690.690.620.520.740.570.620.790.620.550.74Pi-shPi-1Pi-3Pi-5Pi-7Pi-9Pi-12Pi-19Pi-kmPi-20Pi-ta2Pi-11Pi-a0.070.050.100.050.070.000.070.020.000.120.020.05Pi-i0.050.120.050.000.070.140.100.070.070.100.070.05Pi-ks0.050.120.120.070.070.120.070.120.100.100.100.07Pi-k0.140.100.190.100.120.070.210.140.100.210.120.12Pi-kp0.070.190.260.170.140.120.100.120.100.190.120.07Pi-kh0.000.050.050.020.020.020.070.050.050.100.000.05Pi-z0.070.100.140.100.070.050.190.020.050.190.070.02Pi-20.070.120.120.000.100.100.070.120.070.140.120.00Pi-zt0.050.050.050.050.020.020.050.020.000.020.020.02Pi-ta0.120.100.140.100.070.070.120.100.100.120.120.10Pi-b0.070.170.240.170.120.120.140.140.100.170.100.10Pi-t0.100.050.120.050.050.020.140.050.050.120.020.07Pi-sh0.050.100.070.050.050.120.070.050.140.070.02Pi-10.500.190.120.120.190.120.140.070.170.100.02Pi-30.450.430.140.170.100.170.120.050.190.140.07Pi-50.620.550.480.070.050.070.050.020.070.050.02Pi-70.600.550.500.600.100.100.070.020.120.050.05Pi-90.600.620.430.570.620.070.120.070.120.120.05Pi-120.620.500.450.550.570.550.100.070.210.050.07Pi-190.600.550.430.550.570.620.550.100.170.120.05Pi-km0.670.570.450.620.620.670.620.670.100.070.02Pi-200.500.400.330.380.450.450.500.480.500.120.10Pi-ta20.620.520.480.600.330.640.520.620.670.450.02Pi-110.640.520.480.620.400.640.620.620.690.500.62
3 讨论
本研究利用广谱感病且未含目前已知抗瘟基因品种‘LTH’种植在湖南桃江稻瘟病病圃,由于该病圃每年种植品种(系)在1 000份以上,其病圃稻瘟病菌遗传组成复杂,从‘LTH’分离得到的351个稻瘟病菌单孢菌株具有一定的代表性。总体看来,强致病力菌株群体为绝对优势种群,几乎无弱致病力菌株存在;其中2013年数据与其他三年区别略大,可能是当年桃江病圃主栽水稻品种不同,弱化了菌株致病力。
根据本次研究结果统计分析,2012-2015年湖南桃江地区没有对稻瘟病菌群体表现为较高抗性的抗瘟基因;赵正洪等[16]对2007-2008年所采集的菌株研究结果表明Pi-ta可作为湘北、湘东的抗源基因,Pi-3仅可作为湘东地区的抗源基因;杨小林[17]2009-2010年的试验表明湖北省内各稻区抗瘟基因Pi-kh、Pi-9、Pi-2对稻瘟病群体的叶瘟及穗颈瘟均有较强抗性,可以作为湖北省水稻抗性基因或抗源基因合理使用;根据朱昳[18]2012-2013年试验结果,抗瘟基因Pi-1、Pi-km可在湖北省各稻区广泛推广;何烈干(2010)[19]、张洁(2013)[20]、徐沛东(2014)[21]认为在江西地区Pi-k、Pi-2和Pi-zt是很好的广谱性抗瘟基因;熊如意等(2002)[22]认为当时在江苏田间主栽含有抗瘟基因Pi-b或Pi-k的水稻品种抗病性较强;杨秀娟等[23]2003-2006年测定了福建省5个主要稻区的稻瘟病菌菌株的致病性,认为抗瘟基因Pi-11、Pi-12、Pi-2、Pi-kh和Pi-km在福建省可作抗源使用。
随着稻瘟病菌致病力的增强,单基因系水稻品种抗性表现明显减弱,在今后的研究中仍然需要在湖南各个地区采集发病水稻分离单孢菌株,以测定其无毒基因的组成和分布,利用基因聚合方式培育含有多个抗瘟基因的水稻广谱抗性新品种[24]。余玲等[25]通过多次回交并结合分子标记辅助选择(MAS)的方法将抗瘟基因Pi-1和Pi-2聚合并成功导入粳稻品种‘徐稻3号’后,接种结果显示其叶瘟抗性频率提高了50%,穗瘟抗性表现为高抗水平,提高了品种的抗病性;杜太宗等[26]2007年测定了贵州8个地区菌株的致病力,通过MAS技术将稻瘟病抗性基因Pi-19和Pi-1聚合到受体材料‘金23B’中通过田间自然诱发鉴定发现基因聚合后水稻材料对叶瘟、穗颈瘟的抗性相对单个基因时的抗性有所提高;杨扬等[27]通过2012-2014连续三年的接种鉴定,表明抗瘟基因Pi-9分别与抗瘟基因Pi-zt、Pi-7、Pi-12联合搭配应用,联合抗病性系数均达到0.81以上,联合致病系数皆在0.06以下,在抗病育种中仍具有很好的利用价值。本研究2015年的联合毒力结果表明,最好的抗瘟基因聚合组合为Pi-3*Pi-k,Pi-3*Pi-1,Pi-20*Pi-b,但其实际应用效果有待进一步研究。
[1] Skamnioti P, Gurr S J. Against the grain: safeguarding rice from blast disease [J]. Trends in Biotechnology, 2009, 27(3): 141-150.
[2] Baker B, Zambryski P, Staskawicz B, et al. Signaling in plant microbe interactions [J]. Science, 1997, 276(5313): 726-733.
[3] 张银霞, 田蕾, 李培富. 宁夏自育水稻品种及部分引进品种的稻瘟病抗性基因分子标记检测[J]. 西北农业学报, 2016, 25(7): 989-996.
[4] Ling Zhongzhuan, Mew T V, Wang Jiulin, et al. Development of near-isogenic lines as international differentials of the blast pathogen [J].International Rice Research Notes,1995,20(1):13-14.
[5] 张海旺, 房文文, 刘翠翠, 等. 离体水稻叶片划伤接种鉴定稻瘟菌的致病型[J]. 植物保护, 2014, 40(5): 121-125.
[6] 凌忠专, 雷财林, 王久林. 稻瘟病菌生理小种研究的回顾与展望[J]. 中国农业科学, 2004, 37(12): 1849-1859.
[7] 刘翔, 任佐华, 陈娟芳, 等. 利用SSR分析湖南桃江病圃丽江新团黑谷上稻瘟病菌的遗传多样性[J]. 西南农业学报, 2015, 28(6): 2496-2500.
[8] 于苗苗, 戴正元, 潘存红, 等. 广谱稻瘟病抗性基因Pigm和Pi2的抗谱差异及与Pi-1的互作效应[J]. 作物学报, 2013, 39(11): 1927-1934.
[9] 刘翔, 任佐华, 陈娟芳, 等. 湖南省稻瘟病菌无毒基因鉴定[J]. 南方农业学报, 2016, 47(9): 1500-1505.
[10]Romao J, Hamer J E. Genetic organization of a repeated DNA sequence family in the rice blast fungus [J]. Proceedings of the National Academy of Sciences, USA, 1992, 89(12): 5316-5320.
[11]刘毅雄, 任佐华, 虞选杰, 等. 湖南推广杂交稻品种的稻瘟病抗性评价及不同评价指标的相关性分析[J]. 杂交水稻, 2014, 29(2):72-77.
[12]何烈干, 马辉刚, 肖叶青, 等. 江西省水稻品种对稻瘟病的抗性鉴定与评价[J]. 江西农业大学学报, 2015, 37(2):278-283.
[13]李小娟, 郭新华, 肖友伦, 等. 长江中下游稻区水稻区试品种稻瘟病的抗性评价[J]. 杂交水稻, 2009, 24(6): 59-61.
[14]周江鸿, 王久林, 蒋琬如, 等. 我国稻瘟病菌毒力基因的组成及其地理分布[J]. 作物学报, 2003, 29(5): 646-651.
[15]张国民, 马军韬, 肖佳雷, 等. 24个单基因系对黑龙江省优势菌群的抗性及联合抗病性分析[J]. 中国农学通报, 2010, 26(12): 233-237.
[16]赵正洪, 周政, 吴伟红, 等. 湖南稻瘟病菌生理小种的组成及其致病性[J]. 湖南农业大学学报(自然科学版), 2014, 40(2): 173-177.
[17]杨小林. 湖北省稻瘟病重发区病菌群体致病性分化及水稻抗瘟基因的遗传分析[D]. 武汉: 华中农业大学, 2012.
[18]朱昳. 湖北省稻瘟病菌无毒基因分析及水稻品种抗瘟基因型及田间抗性鉴定[D]. 武汉: 华中农业大学, 2014.
[19]何烈干. 江西省稻瘟病菌的致病性分化及无毒基于的组成[D]. 南昌: 江西省农业科学院, 2010.
[20]张洁.江西省稻瘟病菌的致病性分化和水稻主要抗瘟基因对江西省稻瘟病菌群体的抗性分析[D].南昌:江西农业大学, 2013.
[21]徐沛东.2012-2013年江西省稻瘟病菌的致病性分化和烯丙苯噻唑对水稻主要防御酶活性的影响[D].南昌:江西农业大学,2014.
[22]熊如意, 周益军, 白娟, 等. 2002年江苏省水稻稻瘟病菌致病性及遗传多样性研究[J]. 植物病理学报, 2005, 35(1): 93-96.
[23]杨秀娟, 阮宏椿, 杜宜新, 等. 福建省稻瘟病菌致病性及其无毒基因分析[J]. 植物保护学报, 2007, 34(4): 337-342.
[24]马军韬, 张国民, 辛爱华, 等. 水稻品种抗稻瘟病分析及基因聚合抗性改良[J]. 植物保护学报, 2016, 43(2): 177-183.
[25]余玲, 戴正元, 吴云雨, 等. 利用分子标记辅助选择提高江苏粳稻稻瘟病抗性[J]. 扬州大学学报(农业与生命科学版), 2014, 35(4):57-62.
[26]杜太宗, 余显贵, 朱速松, 等. 稻瘟病抗性基因Pi1与Pi9聚合材料的抗性鉴定[J]. 贵州农业科学, 2015, 43(4):35-38.
[27]杨扬,褚晋,何鹏飞,等.稻瘟病菌无毒基因Avr-Pi9在2个病圃中的动态变化[J].中国农学通报,2016,32(12):195-199.
(责任编辑:杨明丽)
Virulence ofMagnaportheoryzaeto 24 blast resistance genes inrice from the disease nursery at Taojiang, Hunan
Zhou Hu1,2,3, Ren Zuohua1,2, Yu Xuanjie1,2, Mao Rui1,2,3,Liu Xiang1,2,3, Zhang Yiyun1, Wang Henghu1, Liu Erming1,2,3
(1. College of Plant Protection, Hunan Agricultural University, Changsha 410128, China; 2. Hunan Provincial KeyLaboratory for Biology and Control of Plant Diseases and Insect Pests, Changsha 410128, China;3. Southern Regional Collaborative Innovation Center for Grain and Oil Crops in China, Changsha 410128, China)
Rice blast, caused byMagnaportheoryzae, is one of the most devastating diseases of rice. To understand the virulence composition of the pathogen fungus and hence provide the basis of rational deployment of resistant rice varieties, 351 isolates derived from single conidia ofM.oryzaewere obtained from a widely susceptible variety, i.e. ‘Lijiang Xintuan Heigu’ (LTH), planted in the disease nursery at Taojiang, Hunan. The virulence assay was conducted oninvitrosegments from the fifth leaves of 24 near-isogenic lines (NILs) of rice carrying single resistance genes against blast disease. The results showed that most isolates in the nursery had broad-spectrum virulence. The virulence frequency (VF) to 24 resistance genes varied from 50.56% to 96.67%. The frequencies of the isolates showing virulent to all of the 24 resistance genes varied from 0 to 15% in 2012-2015. According to the analysis of pathogenicity association coefficient (PAC) and resistance association coefficient (RAC) tested in 2015, the combination of two genes which had maximum RAC and minimum PAC werePi-3 *Pi-k, with the value of 0.19 and 0.43, respectively.
Magnaportheoryzae; near-isogenic line; virulence frequency
2016-08-04
2016-09-22
公益性行业(农业)科研专项(201203014);湖南省“十二五”重点学科(0904)
S 435.111
A
10.3969/j.issn.0529-1542.2017.03.028
* 通信作者 E-mail: ermingliu@163.com

