北疆沿天山北坡一带葡萄穗轴褐枯病病原菌的鉴定
杨 超, 张国丽, 任毓忠, 钟杨琼, 高祥雷,李 卓, 张亚平*, 李国英*
(1. 石河子大学生命科学学院, 石河子 832000; 2. 新疆农垦科学院生物技术研究所,石河子 832000; 3. 石河子大学农学院, 石河子 832000)
北疆沿天山北坡一带葡萄穗轴褐枯病病原菌的鉴定
杨 超1, 张国丽2, 任毓忠3, 钟杨琼3, 高祥雷3,李 卓3, 张亚平1*, 李国英3*
(1. 石河子大学生命科学学院, 石河子 832000; 2. 新疆农垦科学院生物技术研究所,石河子 832000; 3. 石河子大学农学院, 石河子 832000)
2015年在新疆沿天山北坡一带的‘夏黑’葡萄上,出现了一种果穗穗轴变褐、枯死、幼果萎缩的病害,部分果园发病率达到100%,减产30%~50%。为了查明其发病原因,采用常规组织分离法对发病的穗轴进行了病原分离和纯化,共获得104个链格孢属真菌Alternariaspp.菌株,选取其中10个代表性菌株,通过常规形态学鉴定、致病性测定及核糖体内转录间隔区ITS (ITS1/ITS4) 和组蛋白3基因序列分析,结果表明,引起该病害的病原有两个,分别是Alternariatenuissima和A.alternata,与国内大部分葡萄产区报道的A.viticola不同。
葡萄; 穗轴褐枯病; 病原鉴定; 链格孢菌
葡萄穗轴褐枯病(grapeAlternariarot)又称轴枯病,主要危害幼嫩的穗轴,使穗轴变褐枯死,导致花穗干枯脱落;也可危害幼果,在表面形成褐色至深褐色小型斑点,但不深入果肉组织。据国内外报道,该病主要由链格孢属Alternaria的一些真菌侵染所致。国外报道,在葡萄上侵染危害的链格孢属病原真菌有多种,主要包括A.alternata、A.tenuissima、A.vitis、A.viticola和A.viniferae[1-2],它们都是危害葡萄穗轴、果梗和叶片上的弱寄生菌。在国内,王克等[3]1986年首先在辽宁报道了由Alternaria属真菌引起的葡萄穗轴褐枯病,其病原为A.viticola。之后赵令川等在湖南长沙(1987-1988年)[4]、牛庆法在山东沂水(1990年)[5]、马俊义等在新疆哈密(2004年)[6]、何建群在云南宾川(2011年)[7]、张军利等在辽南(2011年)[8]等地葡萄园都相继发现该病,并将其病原鉴定为A.viticola。但是,也有人认为该病是由除A.viticola以外的其他链格孢菌引起。如1993年鹿世晋等[9]将青岛地区‘巨峰’系葡萄上发现的穗轴腐烂病病原鉴定为A.tenuissima。2009年马向云等[10]将湖南怀化市‘紫秋刺’葡萄穗轴褐枯病病原鉴定为A.alternata(Fr.)Keissler。《中国农作物病虫害》第2版中记录的葡萄穗轴褐枯病的病原为A.alternata[11]。
2014年张秋娥等[12]对葡萄穗轴褐枯病的症状、病原、发生规律及防治等的研究进行了综述。作者认为以往发表的关于该病病原鉴定的文献大多基于形态学特征,并未结合分子生物学特性。链格孢属的一些种,特别是小孢子组的一些种,由于分生孢子在结构和形态上的高度变异,加之其形态又比较相似,单凭形态学不能将其鉴定到种;而序列分析组蛋白3基因非常适合划定小孢子链格孢种,以此弥补形态学鉴定上的不足[13]。所以,必须结合分子生物学才能将链格孢属确切鉴定到种。
新疆是我国最重要的葡萄产区之一,北疆沿天山北坡一带又是新疆最重要的鲜食和酿酒葡萄的主要产区。但自2015年起,在新疆沿天山一带的石河子和博乐地区的‘夏黑’葡萄园,开花和幼果期葡萄穗轴褐枯病毁灭性发生,有些葡萄园果穗的发病率高达100%,个别果园甚至绝产;另外在‘弗蕾’葡萄品种上也发现有少量穗轴褐枯病症状,为此对该病的病原进行了研究。
1 材料与方法
1.1 病样采集
病样分别采集于石河子地区的石河子大学葡萄试验站、石河子总场、石河子地区143团,博乐地区81团、89团、86团和博乐市的达镇达西村等北疆沿天山北坡一带9个葡萄园,共采集具有典型穗轴褐枯病的病样135个。
1.2 方法
1.2.1 病原分离与纯化
将采集的具有典型症状的病害标本,按常规组织分离法在超净工作台上进行病原物的分离。分离前先将葡萄病样穗轴用流水冲洗干净,然后在葡萄穗轴的病健交界处切取0.7 cm左右的小段,放入0.1%的升汞中表面消毒20 s,无菌水冲洗3次,置于灭菌的无菌滤纸上吸去表面水分,接于马铃薯葡萄糖琼脂培养基(PDA)平板上,28℃条件下培养3~4 d,在PDA平板上进行单孢分离纯化[14],之后将纯化后的菌株接于PDA斜面培养基上,培养5 d后置4℃冰箱中储存备用。
1.2.2 病原菌的鉴定
1.2.2.1 病原的形态学鉴定
根据采集地点、葡萄品种、分离菌株的数量及颜色和形状,选取10个具有代表性的菌株,分别编号为1(来自石河子大学葡萄试验站)、2(来自石总场四分场)、3(来自石总场六分场)、4(来自143团)、5(来自石总场葡萄站)、6(来自89团)、7(来自81团)、8(来自86团)、9(来自86团园艺3连)、10(来自博乐市达镇达西村)。其中除6号样采自‘弗蕾’品种外,其他均采自‘夏黑’葡萄品种。在无菌条件下,分别将代表性菌株转接到马铃薯胡萝卜培养基(PCA)平板上,25℃恒温培养5 d,观察菌落的颜色并记录各菌落的形态特征。在光学显微镜下观察分生孢子、分生孢子梗的形态和颜色及分生孢子的形状和纵横隔膜数,测量分生孢子和喙胞的大小各50个。采用常规的玻片培养法[15],28℃下培养4 d,观察并记录分生孢子的着生状态并照相[16]。
1.2.2.2 分离菌株致病性测定
2016年5月在葡萄开花前按常规方法对分离物进行PDA平板培养,并配制2×106/mL的分生孢子悬浮液。然后从本院葡萄园的‘夏黑’品种上,采集健康的尚未开花的葡萄幼穗,用75%的乙醇进行表面消毒,无菌水冲洗3遍后,置于底部铺有一层无菌湿润滤纸的培养盒中供接种用。采用喷雾法接种(接种一次),即将配好的孢子悬浮液均匀喷洒到葡萄的幼穗上,以喷无菌水作为对照,定期观察并记录发病情况。发病后,按1.2.1方法进行再分离,确认再分离菌株与原接种菌株在形态上的一致性。
1.2.2.3 病原菌的分子生物学鉴定
将供试菌株转接到PDA平板上,活化培养5 d,收集菌丝。采用 BioFlux试剂盒法提取基因组DNA。参照王洪凯等[17]、Glass等[18]的研究方法,对供试菌株核糖体转录间隔区(ITS)和组蛋白3基因序列分别进行PCR扩增。ITS区引物(ITS1: 5′-TCCGTAGGTGAACCTGCGG-3′;ITS4:5′-TCCTCCGCTTATTGATATGC-3′)和组蛋白3基因引物(H3-1a: 5′-ACTAAGCAGACCGCCCGCAGG-3′;H3-1b: 5′-GCGG-GCGAGCTGGATGTCCTT-3′)由上海生物工程股份有限公司合成。PCR反应体系及条件参照王洪凯等[17]和Wang等[13]。产物经回收、连接和转化后,送交上海生物工程有限公司测序。
将供试菌株的ITS区和组蛋白序列分别在NCBI上进行BLAST比对和分析。应用 MEGA 5.0 软件中的临近法(neighbor-joining,NJ),构建基于rDNA-ITS和组蛋白3基因序列的系统发育树。
2 结果与分析
2.1 葡萄穗轴褐枯病的症状
据田间调查,该病的始发期为5月下旬即葡萄开花时,到6月中旬病害达到盛发期。和内地报道的穗轴褐枯病发生时间和症状基本一致。其主要特点是穗轴变褐枯死、果粒干瘪并脱落(图1a~b)。尤其在连续阴雨、温度较低的情况下该病蔓延迅速。由于葡萄穗轴和果柄发生病变,导致全部或部分幼果失水干瘪,严重影响产量。

图1 葡萄穗轴褐枯病田间症状Fig.1 Symptoms of grape Alternaria rot in field
2.2 病原菌分离
从石河子和博乐地区等9个葡萄园采集的135个典型穗轴褐枯病病样中成功分离出104个链格孢属真菌Alternariaspp.的菌株,分离率为77.04%。
2.3 葡萄穗轴褐枯病病原菌的鉴定
2.3.1 形态学鉴定
观察和测定10个具有代表性的链格孢菌菌株。基于形态特征,其中6个分离菌株在PCA平板上保湿培养5 d可形成长达5~15个孢子的分生孢子链,多数分生孢子长链无分支。菌落灰绿色至暗褐色。分生孢子梗单生或簇生,直立,分隔,淡褐色。分生孢子倒棍棒形、卵圆形或近椭圆形,淡褐色至暗褐色,具有0~3个纵隔膜,2~5个横隔膜,部分分生孢子分隔处略缢缩,大小(17.5~37.5)μm×(7.5~12.5)μm,平均25.0 μm×9.3 μm,短喙柱状,淡褐色。基于以上特征,将其初步鉴定为A.tenuissima(图2a、c、e)。另外4个菌株菌落深灰色,菌丝密集。分生孢子梗单生或簇生,直立或弯曲,有分隔,在其上部形成具短分支的孢子链。分生孢子近椭圆形、卵形或倒棍棒状,呈淡褐色至暗褐色,一般具0~3个纵隔膜,2~4个横隔膜。分生孢子表面光滑,一般2~8个串生在一起,单生较少,大小(17.5~40.0)μm×(5.0~12.5)μm,平均26.5 μm×9.1 μm,短喙圆柱形或锥形,褐色,大小(2.5~12.5)μm×(2.5~5.0)μm,部分转变为产孢细胞,可二次分支或产孢。将这些分离株初步鉴定为A.alternata(图2 b、d、f)。
2.3.2 病原菌的致病性测定
将供试的两种代表性菌株接种在健康的葡萄幼果果穗上,5 d后葡萄穗轴变褐枯死,幼果果实掉落(图3)。其症状与田间葡萄自然发病症状一致。用柯赫氏法则进行验证,从发病的穗轴上均分离到与接种菌相同的病原菌,说明供试菌株就是造成田间穗轴褐枯的病原菌。
2.3.3 分子生物学鉴定
分别用核糖体基因转录间隔区引物ITS1/ITS4和组蛋白引物H3-1a/H3-1b对供试的10个代表菌株进行PCR扩增和测序。rDNA-ITS区扩增结果均得到一个540 bp的片段(图4a)。在NCBI上进行BLAST比对,10个供试菌株的ITS序列与A.tenuissima(序列号HM051071、JX860514和KF494002)的同源性以及与A.alternata(序列号KJ739880和KJ526174)的同源性均达99%,无法确定10个供试菌株的归属。

图2 细极链格孢(a、c、e)和链格孢(b、d、f)菌落、分生孢子及着生方式Fig.2 Colonies, conidia and mode of production of Alternaria tenuissima (a, c, e) and A.alternata(b, d, f)

图3 接种葡萄穗轴发病情况Fig.3 Disease occurrence on the grape rachis after inoculation
用组蛋白3引物H3-1a/H3-1b对供试菌株进行PCR扩增,所得产物按大小分可为546 bp和440 bp两个组,通过1%琼脂糖凝胶电泳很容易区分(图4b)。序列比对和分析可知,这两组分别为A.tenuissima组(546 bp)和A.alternata组(440 bp)。其中1~6号菌株与A.tenuissima(序列号KF280523、KP701253和KP701267)的相似性达99%;7~10号菌株与A.alternata(序列号KF308982、KF997067和KF280540)的相似性达99%。

图4 病原菌ITS区(a)和组蛋白3基因(b)PCR扩增Fig.4 PCR amplification products of the ITS (a) and the partial coding sequence of histone 3 gene (b) of the pathogens
通过构建系统发育树,10个菌株的ITS序列与GenBank下载的菌株序列聚类分析结果(图5)显示,10个供试菌株与所有参与分析的菌株聚为一支。因此,用ITS区rDNA序列无法确定供试菌株与小孢子种A.alternata和A.tenuissima的分类地位。

图5 基于链格孢菌rDNA-ITS序列构建的10种菌株的系统发育树Fig.5 Phylogenetic tree of 10 isolates based on rDNA-ITS sequences of Alternaria spp.
而用组蛋白3基因很容易将10个供试菌株区分为两个类群,即A.alternata和A.tenuissima,其所有供试菌株与A.viticola、A.vitis等都不聚在一起(图6),再结合菌株形态学特征,可以确定分离到病原菌是A.alternata和A.tenuissima。这与其他地区报道的病原菌A.viticola和A.vitis有所不同。
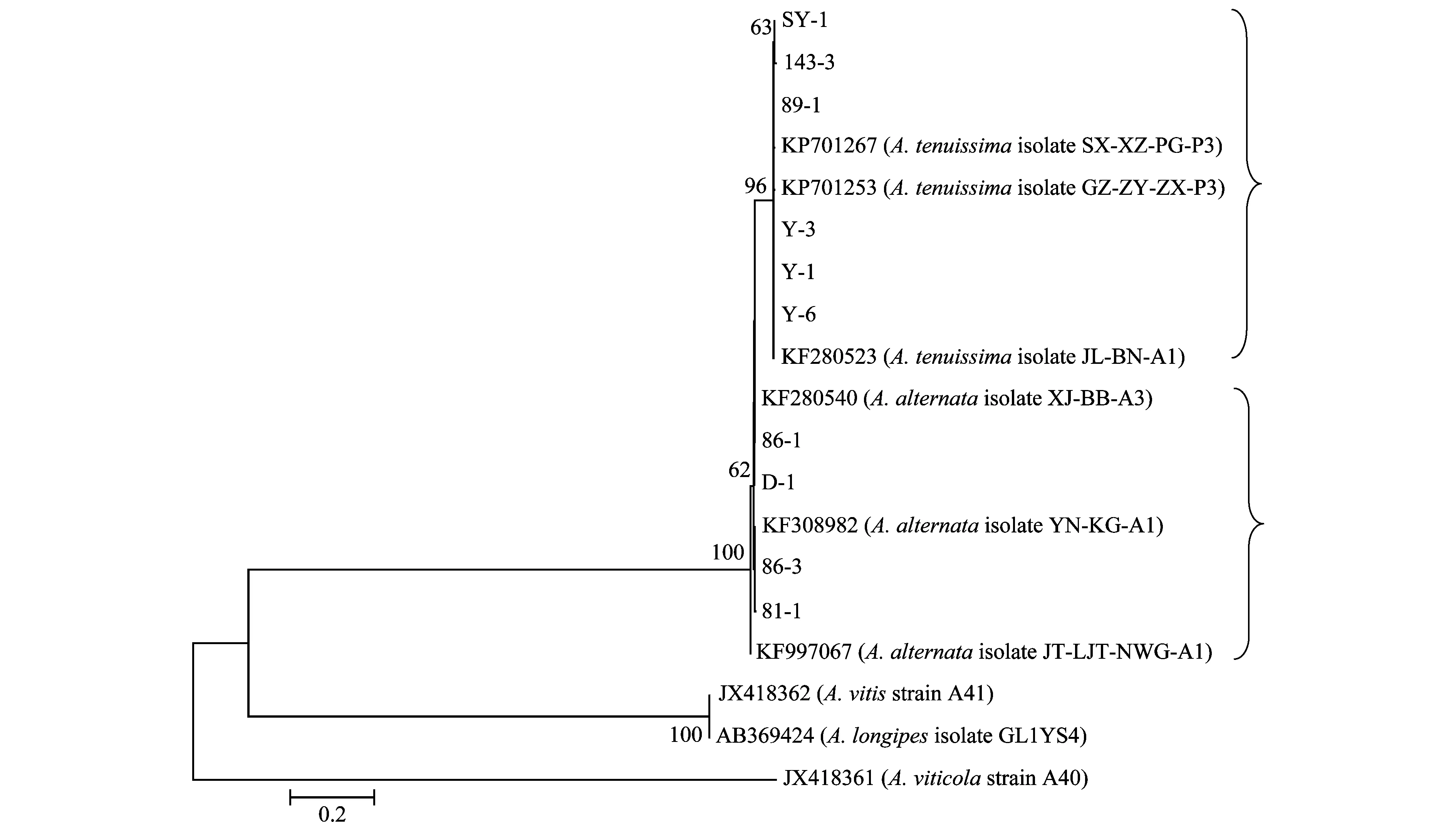
图6 基于链格孢菌组蛋白3基因序列构建的10种菌株的系统发育树Fig.6 Phylogenetic tree of 10 isolates based on histone 3 gene sequences of Alternaria spp.
3 讨论
通过研究查明,引起新疆石河子和博乐葡萄产区‘夏黑’品种上广泛发生的穗轴及果梗大量变褐枯死、果粒干枯、并导致毁灭性减产的病害,主要病原菌是细极链格孢A.tenuissima(以石河子地区为主)和链格孢A.alternata(以博乐地区为主)。在国内其他地区也有穗轴褐枯病由细极链格孢[9]和链格孢[10-11]侵染引起的报道。该病最易感染‘巨峰’系列品种,‘弗蕾’品种也有感染,但危害很轻。
对于细极链格孢和链格孢,其菌落特征、分生孢子梗和分生孢子的形态比较相似,分生孢子及着生方式没有明显区别,加之因受环境条件和多种基质的影响,分生孢子形态、大小变异幅度大,从形态特征上很难将它们准确区分开来。利用真菌核糖体内转录间隔区ITS,因序列之间的差异较小,也难以区别。 通过系统发育分析组蛋白3基因序列,能够更好地分辨出小孢子链格孢类群,从而弥补了rDNA序列分析的不足,这一研究结果与Wang等[13]对小孢子链格孢的研究所得结论比较一致。故组蛋白3基因序列分析可以作为研究链格孢分类鉴定的重要手段。据报道,葡萄穗轴褐枯病主要在葡萄开花前后发生,若此时阴雨连绵,气温偏低,易造成流行;该病发生与品种有密切的关系,一般‘巨峰’系品种发病较重;2015年在新疆天山北坡‘夏黑’葡萄品种上严重发生穗轴褐枯病,进一步验证了这一结论。另外,‘弗蕾’品种虽发病不重,但从其上也分离到该病病原菌。2004年马俊义等曾报道在新疆哈密葡萄园发生严重的穗轴褐枯病,‘无核白’、‘木纳格’和‘红地球’的发病指数分别为60.52、15.01和11.65,其病原为Alternariaviticola,故该病在新疆其他葡萄产区的病原种类发生情况有待继续调查和鉴定。鉴于该病在新疆沿天山北坡一带‘夏黑’葡萄上发生比较严重,在葡萄开花前后,特别是种植‘夏黑’葡萄较多的地区,应注意及时进行防治。
[1] Tao Wenchen, Zhang Wei, Yan Jiye, et al. A newAlternariaspecies from grapevine in China[J]. Mycological Progress, 2014, 13(4): 1119-1125.
[2] Polizzotto R, Andersen B, Martini M, et al. A polyphasic approach for the characterization of endophyticAlternariastrains isolated from grapevines [J]. Journal of Microbiological Methods, 2012, 88: 162-171.
[3] 王克, 姜启良, 白金铠. 辽宁省葡萄上发生-种新病害-葡萄穗轴褐枯病[J]. 沈阳农业大学学报, 1986,17(1): 81-83.
[4] 赵令川, 魏文娜, 朱晓湘. 湖南省葡萄穗轴褐枯病的发生与防治初报[J]. 葡萄栽培与酿酒, 1989(3): 34-38.
[5] 牛庆法.葡萄穗轴褐枯病调查初报[J].北方果树,1990(2): 39.
[6] 马俊义, 朱晓华, 赵林忠,等. 葡萄穗轴褐枯病初步研究[J]. 新疆农业科学, 2004, 41(5): 353-354.
[7] 何建群, 王程, 张玲. 宾川县鲜食葡萄真菌性病害种类及综合防控技术[J]. 植物医生, 2011, 24(2): 16-17.
[8] 张军利, 姚鹏, 邢维杰. 辽南‘巨峰’葡萄穗轴褐枯病的发生与防治[J]. 北方果树, 2011 (6): 38.
[9] 鹿世晋, 王佩圣, 姜瑞德. 葡萄幼穗轴腐病研究简报[J]. 植物病理学报, 1995, 25(2): 154.
[10]马向云, 张亚林. 紫秋刺葡萄穗轴褐枯病发生规律及防治措施[J]. 中国南方果树, 2009, 38(5): 68-69.
[11]中国农业科学院植物保护研究所. 中国农作物病虫害(第二版)[M]. 北京:中国农业出版社1979.
[12]张秋娥, 段胜男, 严进. 葡萄穗轴褐枯病研究进展[J]. 安徽农业科学, 2014, 42(4): 1006.
[13]Wang Taiyun, Zhao Juan, Sun Peng, et al. Characterization ofAlternariaspecies associated with leaf blight of sunflower in China [J]. European Journal of Plant Pathology, 2014, 140(2): 301-315.
[14]龚国淑, 徐琴, 张敏, 等. 一种简便的病原真菌单孢分离方法研究[J]. 玉米科学, 2010, 18(1): 126-127.
[15]方中达.植病研究方法[M].北京:农业出版社,1998:37,343-345.
[16]张天宇. 中国真菌志 第十六卷 链格孢属[M]. 北京: 科学出版社, 2003.
[17]王洪凯, 张天宇, 张猛. 应用5.8S rDNA及ITS区序列分析链格孢种级分类[J]. 菌物学报,2001, 20(2): 168-173.
[18]Glass N L, Donaldson G C.Development of primer sets designed for use with the PCR to amplify conserved genes from filamentous ascomycetes [J]. Applied and Environmental Microbiology, 1995, 61:1323-1330.
(责任编辑:田 喆)
Identification of the pathogens of grape spike-stalk brown along theTianshan Mountains
Yang Chao1, Zhang Guoli2, Ren Yuzhong3, Zhong Yangqiong3, Gao Xianglei3, Li Zhuo3, Zhang Yaping1, Li Guoying3
(1. College of Life Science, Shihezi University, Shihezi 832000, China; 2.Biotechnology Research Institute, Xinjiang Academy ofAgricultural Reclamation, Shihezi 832000, China; 3.College of Agriculture, Shihezi University, Shihezi 832000, China)
A grape disease which caused brown necrosis of the spike-stalk and fruit shrinkage was observed on ‘Summer Black’ grape along the Tianshan Mountains in Northern Xinjiang in 2015. The disease incidence in some orchards reached 100%, reducing yields by 30%-50%. One hundred and fourAlternariaspp. were isolated from diseased tissues to determine the causal agent of the disease. Ten representative isolates were selected for morphological observation, pathogenicity tests, comparison of internal transcribed spacer regions 1 and 4, and histone 3 nucleotide sequences. The results showed thatA.tenuissimaandA.alternatawere the causal pathogens of spike-stalk brown spot in grape. This was different from previous reports from other regions of China.
grape; spike-stalk brown spot; identification of pathogen;Alternariaspp.
2016-06-06
2016-09-16
公益性行业(农业)科研专项(201203035)
S 436.631.1
A
10.3969/j.issn.0529-1542.2017.03.022
* 通信作者 E-mail:lgyshzu@163.com; 510224419@qq.com

