巴氏新小绥螨对二斑叶螨的捕食功能及控制潜力研究
尚素琴, 刘 平, 陈耀年, 张新虎
(甘肃农业大学植物保护学院, 兰州 730070)
巴氏新小绥螨对二斑叶螨的捕食功能及控制潜力研究
尚素琴, 刘 平, 陈耀年, 张新虎*
(甘肃农业大学植物保护学院, 兰州 730070)
为明确巴氏新小绥螨Neoseiulusbarkeri对二斑叶螨Tetranychusurticae的捕食功能反应和对其种群的潜在控制能力,在实验室相对湿度85%±5%、光照L∥D=16 h∥8 h、5个温度梯度16、20、24、28℃和32℃下进行捕食功能反应和个体间干扰反应试验,并在25℃下研究了巴氏新小绥螨对二斑叶螨的种群控制能力。结果表明:在16~28℃温度范围内,巴氏新小绥螨对二斑叶螨各螨态的捕食功能反应均属于HollingⅡ型,随着温度升高,攻击系数、捕食能力、最大日均捕食量均升高,而处理时间缩短;28℃时捕食量达到最高,处理时间最短,当温度高于32℃时捕食量开始下降。二斑叶螨密度固定时,巴氏新小绥螨的平均捕食量随其自身密度的增加而逐渐降低,说明巴氏新小绥螨存在明显的相互干扰作用。巴氏新小绥螨对二斑叶螨种群的控制能力,随着益害比的增加,二斑叶螨种群数量显著下降,益害比在一定比值内时巴氏新小绥螨对二斑叶螨种群表现出明显的控制能力。其中当益害比为5∶30时二斑叶螨种群数量在第6天就能得到控制。
巴氏新小绥螨; 二斑叶螨; 捕食功能; 干扰作用; 控制潜力
二斑叶螨TetranychusurticaeKoch是世界性的大田和保护地作物上的一种重要害螨,能够为害蔬菜、水果、玉米、棉花和城市绿地植物及牧草等140科1 100多种植物[1-3]。目前其防治措施主要依赖杀虫(螨)剂,由于化学药剂的不合理使用, 二斑叶螨的抗药性极速上升, 明显降低了杀虫(螨) 剂的防治效果。巴氏新小绥螨Neoseiulusbarkeri(Hughes)隶属蛛形纲Arachnida蜱螨亚纲Acari寄螨目Parasitiformes植绥螨科Phytoseiidae,是一种优良的捕食性天敌[4]。因其发育历期短、自然死亡率低、产卵率高、扩散力强、多食性等优点,是叶螨和小型吸汁性害虫的理想生物防治天敌[5]。利用捕食螨来控制叶螨对环境无污染且持效期长[6-8]。
近年来,巴氏新小绥螨被认为是最好的生物防治天敌之一,国内基础研究相对成熟并已掌握规模化生产技术[9]。张辉元等在室内和田间评价了胡瓜钝绥螨对苹果全爪螨的控制效果,认为释放胡瓜钝绥螨能有效控制苹果全爪螨的种群增长[10]。张东旭在室内植株上研究了巴氏新小绥螨对西花蓟马和截形叶螨的控制作用,发现巴氏新小绥螨对这两种猎物及其混合物均有较强的搜寻能力且对两者都有较强的跟随能力,说明利用巴氏新小绥螨可以控制温室中的截形叶螨和西花蓟马[11]。
本试验测定了巴氏新小绥螨对二斑叶螨功能反应和个体间干扰反应,在此基础上进一步研究了巴氏新小绥螨对二斑叶螨种群的控制能力,旨在明确捕食者与猎物在不同益害比时捕食者对猎物的潜在控制能力,为巴氏新小绥螨的田间释放提供理论依据和参考。
1 材料与方法
1.1 供试虫源
巴氏新小绥螨由中国农业科学院植物保护研究所捕食螨研究组提供,置于(25±1)℃、RH 85%±5%智能型人工气候箱内以椭圆食粉螨AleuroglyphusovatusTroupeau饲养3~5代后备用。
二斑叶螨由甘肃农业大学植物保护学院农药学实验室提供,初样于2012年5月采自甘肃省兴隆山,经室内雌雄单系繁殖饲养获得,置于(25±l)℃,RH 70%±5%,光照周期L∥D=16 h∥8 h养虫室内饲养繁殖60余代。
1.2 试验方法
1.2.1 捕食功能反应
将直径7 cm的小培养皿倒扣在直径9 cm的培养皿里,在小培养皿上铺直径7 cm的滤纸,滤纸上放置大小适当的美国无架豇豆Vignasinensis(L.) Endl.叶片。用脱脂棉捻成棉棒浸湿,将叶片围住并裹住叶柄,以防叶片脱水干枯和防止巴氏新小绥螨与二斑叶螨逃逸,最后在大培养皿中加满水。
选取二斑叶螨的卵、若螨、雌成螨3个螨态,设3、6、9、12、15、18 头(粒) 6个密度梯度(处理),3次重复。每个处理再接入1头巴氏新小绥螨雌成螨(经24 h饥饿处理),24 h后观察并记录捕食情况。分别设置5个温度处理,观察巴氏新小绥螨在温度16、20、24、28和32℃,相对湿度(RH)75%~85%,光照L∥D=16 h∥8 h条件下的捕食情况。
1.2.2 捕食者个体间的干扰反应
每培养皿中放入40头二斑叶螨雌成螨,按1、3、5、7、9 头的密度接入巴氏新小绥螨雌成螨,设置16、20、24、28和32℃温度处理,相对湿度85%±5%,光照L∥D=16 h∥8 h,24 h后观察剩余二斑叶螨的数量,比较其结果。每处理设3次重复。
1.2.3 巴氏新小绥螨对二斑叶螨种群密度的影响
在每培养皿内引入处于产卵期的二斑叶螨雌成螨30头,然后分别引入处于产卵期的不同密度梯度的巴氏新小绥螨雌成螨,放入25℃、RH 85%±5%、光照L∥D=16 h∥8 h的人工气候箱中培养。设捕食螨密度梯度1、3、5头,对照未引入捕食螨。每处理3次重复,每天观察1次,记录益害螨种群消长情况。
1.3 数据分析方法
1.3.1 捕食功能反应
试验数据用Holling圆盘方程Na=aTN/(1+aThN)拟合[12],式中N为猎物初始密度,Na为猎物被捕食数量,a为瞬间攻击系数,T为捕食者发现猎物的时间(1 d),Th为处理时间,用a/Th值评价巴氏新小绥螨的捕食能力。
1.3.2 捕食者个体间的干扰反应
试验数据用Watt的干扰与竞争模型模拟,即:A=aX-b。式中X为巴氏新小绥螨密度,A为被捕食的二斑叶螨数量,a为在无竞争情况下的攻击率,b为种内竞争参数。
试验数据用Excel 2007处理,采用Duncan氏新复极差法分析差异显著性。
2 结果与分析
2.1 巴氏新小绥螨对二斑叶螨不同螨态的捕食功能反应
巴氏新小绥螨雌成螨在不同温度下对二斑叶螨不同螨态的功能反应均属于Holling Ⅱ型。20~28℃温度范围内捕食效率随温度升高而增高,28℃时的捕食效率最高,当温度高于32℃时捕食量开始下降。用Holling圆盘方程Na=aTN/(1+aThN)拟合功能反应数据见表1。
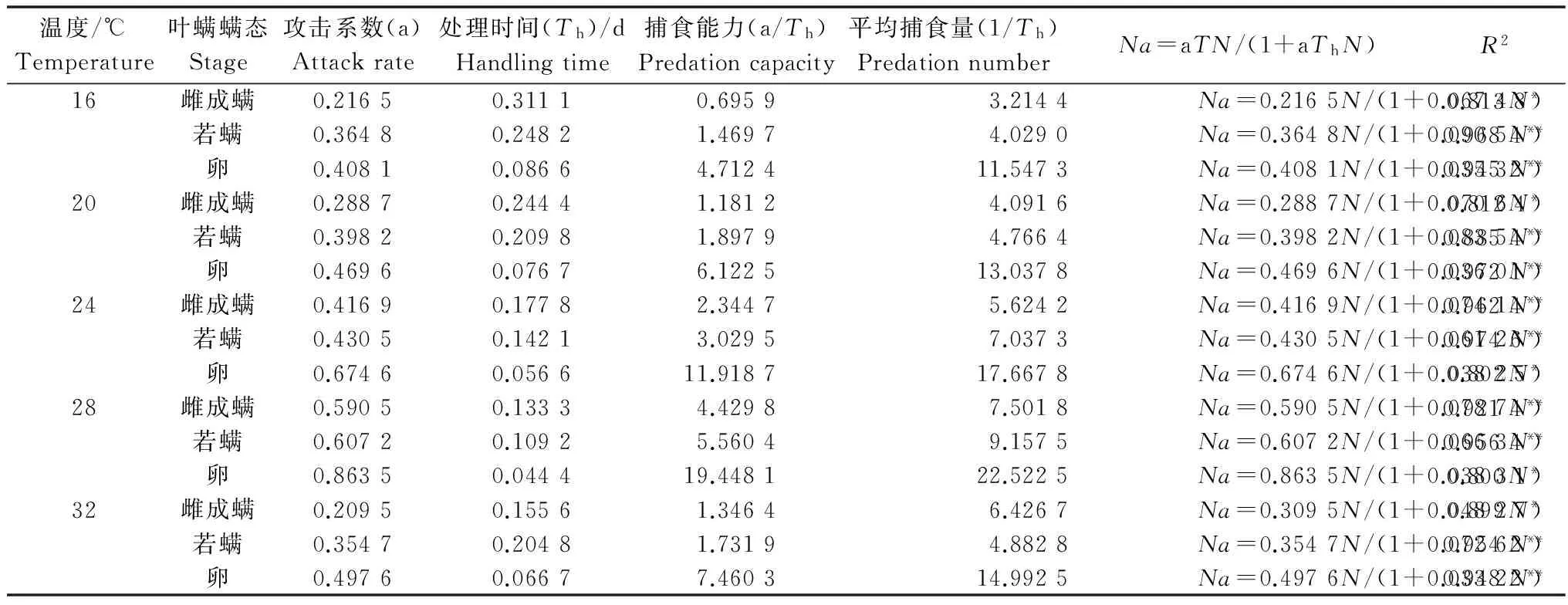
表1 巴氏新小绥螨捕食二斑叶螨各螨态的捕食功能反应1)
1)*P≤0.05,**P≤0.01(Duncan氏新复极差法)。*P≤0.05;**P≤0.01 (Duncan’s multiple range test).
从表1可知:在16~28℃范围内,巴氏新小绥螨雌成螨对二斑叶螨各螨态的平均捕食量、攻击系数均随温度升高而增大,处理时间随温度升高而缩短。当温度达到32℃时日捕食量、攻击系数开始减小,处理时间则相应增加。同一温度下,其捕食量和攻击系数依次为:卵>若螨>雌成螨;处理时间反之。
2.2 巴氏新小绥螨雌成螨自身密度的干扰反应
不同温度下巴氏新小绥螨雌成螨对自身密度的干扰反应结果见表2。
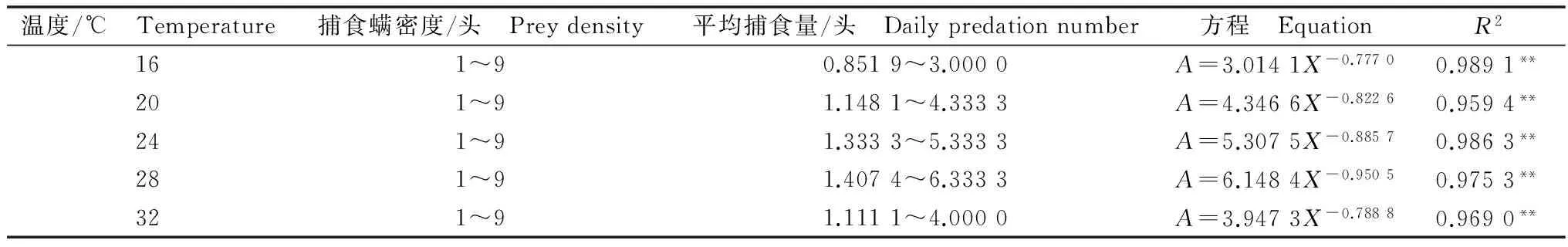
表2 不同温度对巴氏新小绥螨雌成螨干扰反应的影响1)
1)*P≤0.05,**P≤0.01(Duncan氏新复极差法)。*P≤0.05;**P≤0.01 (Duncan’s multiple range test).
从表2可知:在16~28℃范围内,温度升高,巴氏新小绥螨对二斑叶螨的攻击概率逐渐变大,种内竞争估计参数逐渐变大;温度达到32℃时攻击概率和种内竞争估计参数变小。每个温度下,二斑叶螨密度相同时,巴氏新小绥螨的平均捕食量随其自身密度的增加而逐渐减少,说明巴氏新小绥螨之间存在种内竞争和相互干扰的作用。
2.3 巴氏新小绥螨对二斑叶螨种群密度的影响
巴氏新小绥螨对二斑叶螨的种群密度的影响结果见图1。
当益害比为0∶30时,二斑叶螨前5 d种群平稳,第6天种群开始突增,第12天时达到最大为380.67头,第14天开始由于种内竞争加剧,种群数量开始下降;当益害比1∶30时,二斑叶螨种群密度从第5天开始迅速增长,第7天时达到最大为147.67头,比0∶30时下降了61%。而巴氏新小绥螨种群密度增长缓慢,第14天达到最大;当益害比分别为3∶30和5∶30时,二斑叶螨种群密度呈现先下降后增长再下降的趋势,其种群数量均在第5天开始增长,而后分别在第7天和第6天达到峰值,为71.67头和41.33头,分别比0∶30时下降了81%和89%,之后被巴氏新小绥螨所抑制,种群数量开始下降,在第16天和第15天时种群降至0。在这两个处理中巴氏新小绥螨的种群数量都明显增大,分别在第12天和第9天达到最大,当二斑叶螨的种群密度开始下降时,巴氏新小绥螨的种群密度也随之下降。
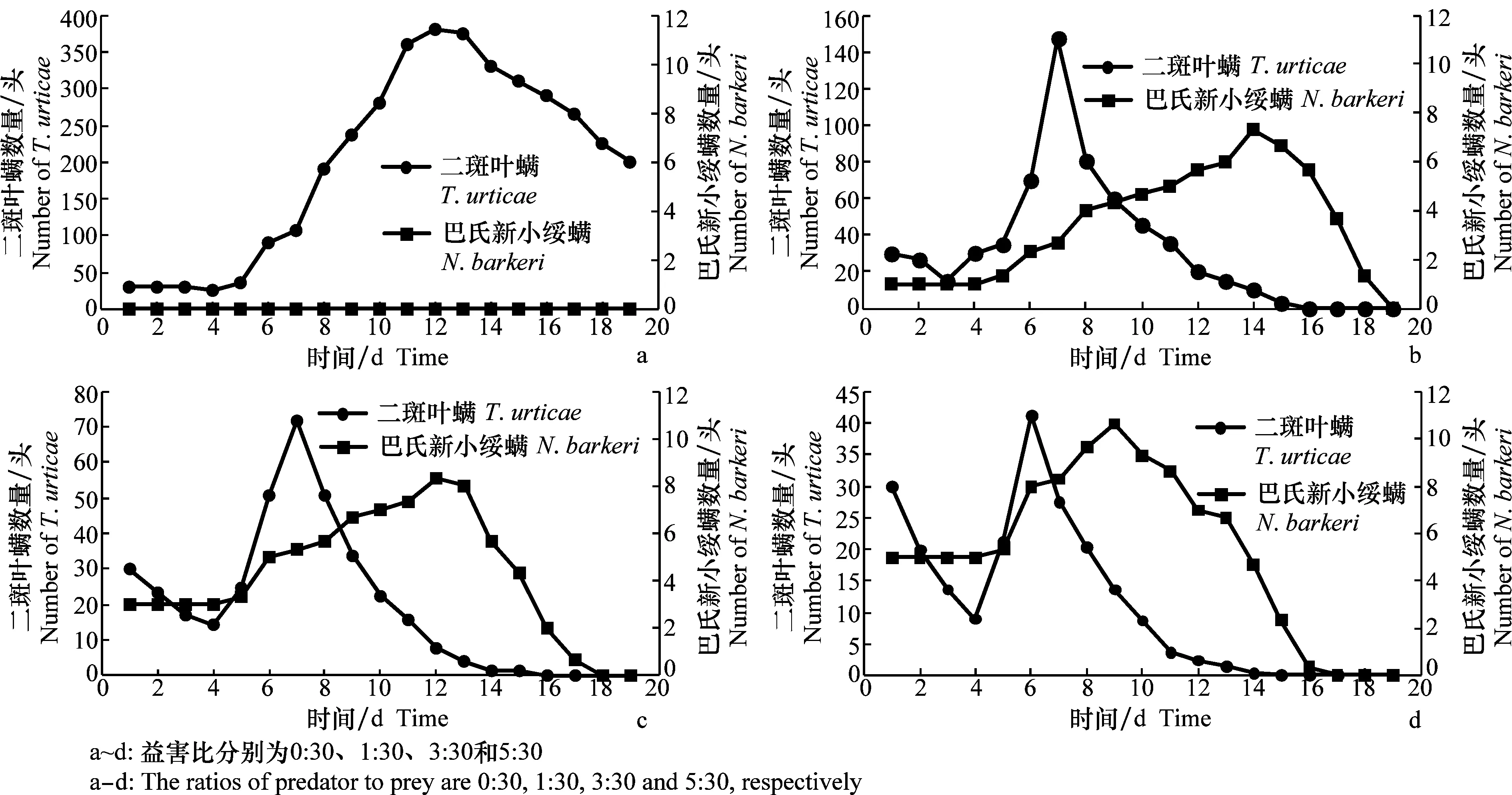
图1 不同益害比例下巴氏新小绥螨与二斑叶螨种群数量变化Fig.1 Dynamics of Neoseiulus barkeri and Tetranychus urticae populations at different ratios
3 结论与讨论
一个良好的生防资源捕食者必须具备以下特质[13-15]:良好的移动扩散能力,与猎物分布同一时空,良好的生殖能力,捕食量大,对猎物的高度特异性;独特的形态特征。同样,一个捕食者的价值评价必须根据其适应环境能力、功能和数值的反应,和时空同步的猎物[16]。捕食者的功能反应是捕食与被捕食系统种群动态的一个关键的因素[15]。
有关巴氏新小绥螨[17-23]的捕食功能反应,不同学者做了大量工作,结果与本文基本一致。罗育发等[24]还研究了不同饥饿状态的巴氏新小绥螨雌成螨对朱砂叶螨捕食功能的影响,结果显示功能反应均为HollingⅡ型,但模型上的各参数值发生了较大改变。
本试验中巴氏新小绥螨作为天敌捕食二斑叶螨的能力非常明显,同时温度对巴氏新小绥螨的捕食作用影响也很大。控制潜力方面,当益害比增大时二斑叶螨种群会出现一个明显的先下降再增长再到峰值。这是由于前期二斑叶螨雌成螨所产的卵尚未孵化,再加捕食螨的捕食,使其种群有一定比例的下降,当卵开始大量孵化以后,二斑叶螨的种群开始迅速增长,到中期捕食螨种群增大后对其控制作用开始明显,使其种群开始缓慢下降直至0。巴氏新小绥螨种群则比较稳定,当二斑叶螨开始迅速增长时其种群也开始增长,但增长速率没有二斑叶螨增长明显,到达峰值的时间比二斑叶螨迟,巴氏新小绥螨种群的增长相比于二斑叶螨种群有一定的滞后性。
因此,巴氏新小绥螨是二斑叶螨潜在的良好生物防治物。但在自然条件下,由于时间、地点及环境因子的不同,搜寻猎物的时间、猎物密度等均可能会影响到捕食者的捕食效率[25]。因此还有待进一步研究巴氏新小绥螨在自然状态下种群建立和对二斑叶螨的控制能力。
[2] 张廷伟, 沈慧敏, 钱秀娟, 等. 二斑叶螨刺吸胁迫对白三叶叶绿素含量和两种保护酶的影响[J]. 应用昆虫学报, 2013, 50(2): 395-400.
[3] Thomas van Leeuwen, Vontas J, Tsagkarakou A.Acaricide resistance mechanisms in the two-spotted spider miteTetranychusurticaeand other important Acari: a review [J]. Insect Biochemistry and Molecular Biology, 2010, 40(8): 563-572.
[4] 忻介六.农业螨类学[M]. 北京:农业出版社,1988:136.
[5] Nawal A H, Michael P P.Predatory mite help control thrips on floriculture crops [J]. California Agriculture, 1990, 44(6): 19-21.
[6] 方小端, 吴伟南, 刘慧, 等. 西方花蓟马的生物防治研究进展[J]. 中国生物防治学报, 2008, 24(4): 363-368.
[7] 张帆, 唐斌, 陶淑霞, 等. 中国植绥螨规模化饲养及保护利用研究进展[J]. 昆虫知识, 2005, 42(2): 139-143.
[8] 江高飞, 陈飞, 李晓娇, 等. 巴氏新小绥螨的研究进展[J]. 中国南方果树, 2012, 41(2):36-40.
[9] 徐学农, 吕佳乐, 王恩东. 捕食螨繁育与应用[J]. 中国生物防治学报, 2015, 31(5):647-656.
[10]张辉元, 马明, 董铁, 等. 胡瓜钝绥螨对苹果全爪螨的生物防治效果[J]. 应用生态学报, 2010 (1): 191-196.
[11]张东旭.利用巴氏新小绥螨防治西花蓟马和截形叶螨的研究[D]. 呼和浩特:内蒙古农业大学, 2012.
[12]吴坤君,盛承发,龚佩瑜.捕食性昆虫的功能反应方程及其参数的估算[J]. 昆虫知识, 2004,41(3): 267-269.
[13]McMurtry J A.The use of phytoseiids for biological control: progress and future prospects [C]∥Recent Advances in Knowledge of the Phytoseiidae: Proceedings of a Formal Conference of the Acarology Society of America Held at the Entomological Society of America Meeting,San Diego,1982:23-48.
[14]Huffaker C B, Messenger P S, DeBach P.The natural enemy component in natural control and the theory of biological control [M]∥Biological Control. Springer US, 1971: 16-67.
[15]Schenk D, Bacher S. Functional response of a generalist insect predator to one of its prey species in the field [J]. Journal of Animal Ecology, 2002, 71(3): 524-531.
[16]Fan Y, Petitt F L. Functional response ofNeoseiulusbarkeriHughes on two-spotted spider mite (Acari: Tetranychidae)[J]. Experimental & Applied Acarology, 1994, 18(10): 613-621.
[17]陈耀年, 汝阳, 尚素琴. 巴氏新小绥螨对二斑叶螨混合抗性品系和敏感品系的捕食功能[J].中国生物防治学报, 2016, 32(4): 428-433.
[18]宋树贤, 刘光华, 辛天蓉, 等. 巴氏新小绥螨对朱砂叶螨的捕食效能[J]. 南昌大学学报(理科版),2012,36(5):486-489.
[19]邹志文, 陈芬, 夏斌, 等. 几种钝绥螨ITS基因片段的序列分析[J]. 中国农业科学, 2011, 44(23):4945-4951.
[20]崔晓宁, 张亚玲, 沈慧敏, 等. 巴氏钝绥螨对截形叶螨的捕食作用[J]. 植物保护学报, 2011,38(6):575-576.
[21]尚素琴, 郑开福, 张新虎. 巴氏钝绥螨对二斑叶螨的捕食功能反应[J]. 植物保护学报, 2015 (3): 316-320.
[22]凌鹏, 夏斌, 李朋新, 等. 巴氏钝绥螨对柑桔全爪螨的捕食效能[J]. 蛛形学报,2008,17(1): 29-34.
[23]李朋新, 夏斌, 舒畅, 等. 巴氏钝绥螨对椭圆食粉螨的捕食效能[J]. 植物保护,2008, 34(3):65-68.
[24]罗育发,钟八莲.巴氏新小绥螨和尼氏真绥螨的耐饥能力及饥饿对其雌成螨捕食作用的影响[J].中国南方果树,2012,41(1):1-6.
[25]Kasap I, Atlihan R. Consumption rate and functional response of the predaceous miteKampimodromusaberransto two-spotted spider miteTetranychusurticaein the laboratory [J]. Experimental and Applied Acarology, 2011, 53(3): 253-261.
(责任编辑:田 喆)
Functional response and control potential ofNeoseiulusbarkeritoTetranychusurticae
Shang Suqin, Liu Ping, Chen Yaonian, Zhang Xinhu
(College of Plant Protection, Gansu Agricultural University, Lanzhou 730070, China)
To identify the functional response and control potential ofNeoseiulusbarkeritoTetranychusurticae, the predation of three stage (egg, nymph and female adult) ofT.urticaebyN.barkeriwas examined at five temperatures (16, 20, 24, 28 and 32℃) and RH (85±5)% under laboratory conditions. The results showed that the predatory functional response was fitted to Holling Ⅱ equation in 16-28℃, the attack index (a),a/Thvalue, and the maximum predatory number (1/Th) also increased, but the average treatment time reduced with increasing temperature. The maximum predatory number and the shortest treatment time achieved at 28℃. The predatory number reduced when temperature was above 32℃. When prey density was fixed, the predation rate decreased with increasing predator density. The results indicated that competition and self interference effect existed in the population ofN.barkeri. The population quantity ofT.urticaedecreased obviously with the increase in the ratio of predator to prey, and as the ratio of predator to prey changed within certain range, the predator showed good control capability to the prey. When the ratio was 5∶30, the population quantity ofT.urticaecould be controlled after 6 days.
Neoseiulusbarkeri;Tetranychusurticae; predatory function; interference; control of potential ability
2016-10-25
2016-12-09
公益性行业(农业)科研专项(200903032);甘肃省农牧厅生物技术专项(GNSW-2011-10)
S 476
A
10.3969/j.issn.0529-1542.2017.03.020
致 谢: 本试验所用捕食螨由中国农业科学院植物保护研究所捕食螨研究组提供,在此表示诚挚的感谢。
* 通信作者 E-mail:ndzxh@gsau.edu.cn

