不同新城疫疫苗对贵州三穗麻鸭的免疫效果比较
胡焱,嵇辛勤,2,阮涌,2,赵佳福,2,雷云,段志强,2*,刘秀梵
(1. 贵州大学动物科学学院,贵阳 550025;2. 贵州大学高原山地动物遗传育种与繁殖省部共建教育部重点实验室,贵阳 550025;3. 扬州大学农业部畜禽传染病学重点开放实验室,江苏扬州 225009)
不同新城疫疫苗对贵州三穗麻鸭的免疫效果比较
胡焱1,嵇辛勤1,2,阮涌1,2,赵佳福1,2,雷云1,段志强1,2*,刘秀梵3*
(1. 贵州大学动物科学学院,贵阳 550025;2. 贵州大学高原山地动物遗传育种与繁殖省部共建教育部重点实验室,贵阳 550025;3. 扬州大学农业部畜禽传染病学重点开放实验室,江苏扬州 225009)
为探讨不同新城疫(ND)疫苗对贵州三穗麻鸭的免疫效果,选用NDⅠ系活疫苗(CS2株)、Ⅳ系灭活疫苗(LaSota株)和重组基因Ⅶ型NDV灭活疫苗(A-Ⅶ株)分别对三穗麻鸭进行免疫实验,检测疫苗最小免疫剂量、免疫鸭的抗体滴度和消长规律,以及病毒感染免疫鸭后的排毒情况。结果显示,活疫苗CS2株、灭活疫苗LaSota株、灭活疫苗A-Ⅶ株的最小免疫剂量分别为1.0 mL/只、0.5 mL/只和0.2 mL/只;3种疫苗2次免疫要高于1次免疫产生的抗体滴度,但各免疫组不同免疫次数鸭的抗体滴度均在第60天达到高峰,其中以灭活疫苗A-Ⅶ株1次或2次免疫诱发的抗体滴度最高(分别为7.5log2和8.1log2),并且抗体持续期长,在免疫后第150天抗体水平仍能达到免疫保护要求;对免疫鸭的排毒检测发现,活疫苗CS2株免疫后的鸭持续排毒,灭活疫苗LaSota株免疫后的鸭排毒量少且时间短,而灭活疫苗A-Ⅶ株免疫后的鸭未检测到排毒。试验结果表明,重组基因Ⅶ型NDV灭活疫苗(A-Ⅶ株)在免疫剂量、免疫次数、免疫鸭的抗体滴度和持续时间,以及抑制免疫鸭排毒方面均明显优于传统ND疫苗。
新城疫病毒;三穗麻鸭;新城疫疫苗;免疫效果
自1926年首次确认新城疫(Newcastle disease, ND)以来,经过世界范围内的四次大流行,ND宿主范围明显扩大,迄今为止能自然或人工感染的禽类已超过250多种[1]。水禽被认为是新城疫病毒(Newcastle disease virus, NDV)的天然储存宿主,不同基因型的NDV均可从水禽中分离[2]。我国自1997年7月以来多个省份相继出现了鹅群和鸭群感染NDV并发病死亡的报道[3-4],且呈扩大流行趋势,改变了"传统一般认为NDV对水禽不致病"的观点。分子流行病学调查结果表明,感染并导致水禽发病死亡的主要是基因Ⅶ型NDV强毒株[5-6]。有研究表明,虽然有些NDV强毒株对家鸭的致病力不强,但是人工感染鸡或鹅后能造成严重的发病和死亡[7-9]。因此,要警惕家鸭携带的强毒NDV向鸡群或鹅群传播而对养殖业造成的威胁和损失。
三穗麻鸭是我国地方四大蛋系名鸭品种之一,目前三穗麻鸭产业已成为贵州省特色优势产业。本实验室前期对贵州省三穗麻鸭群进行了NDV流行病学调查和致病性研究,发现三穗麻鸭中主要流行基因Ⅶd亚型NDV,虽然这些分离株对鸡致病力强而对鸭不致病,但鸭在感染后的较长时间可通过喉头或泄殖腔向体外排毒[10],这与国内研究结果相一致[7-8]。我国当前控制鸡群和鹅群感染NDV的主要措施是ND疫苗免疫,但是否有必要对鸭群进行ND疫苗免疫尚存在争议。鉴于目前贵州省三穗麻鸭的规模化养殖不断扩大,且感染强毒NDV的三穗麻鸭可持续向环境排毒,有造成其它禽群接触感染的危险,因此有必要对三穗麻鸭群进行ND疫苗的免疫接种。本研究选取国内常用的NDⅠ系活疫苗(CS2株)、Ⅳ系灭活疫苗(LaSota株)和新型基因Ⅶ型NDV灭活疫苗(A-Ⅶ株)分别对三穗麻鸭进行免疫实验,检测疫苗最小免疫剂量、免疫鸭的抗体滴度和消长规律,以及强毒NDV感染免疫鸭后的排毒情况,旨在为生产上有效防控ND提供科学的参考依据。
1 材料与方法
1.1 材料
1.1.1 毒株 基因Ⅶ型鸭源NDV强毒株Duck/China/Guizhou/ZY/2014(简称ZY株)[10]由本实验室保存。将ZY株接种10日龄SPF鸡胚,收集24 h后死亡鸡胚尿囊液保存备用。
1.1.2 试验动物 SPF鸡胚购自北京梅里亚维通实验动物技术有限公司;1日龄健康三穗麻鸭购自贵州省三穗县兴绿洲农业发展有限公司。
1.1.3 试验疫苗 鸡ND活疫苗(CS2株)(批准文号:兽药生字(2016)150132073,商品化疫苗中病毒含量为105.5EID50/0.1 mL)、鸡ND灭活疫苗(LaSota株)(批准文号:兽药生字(2015)150132241,灭活前病毒含量为109.1EID50/0.1 mL)、重组NDV灭活疫苗(A-Ⅶ株)(批准文号:兽药生字(2015)150132231,灭活前病毒含量为108.5EID50/0.1 mL)购自青岛易邦生物工程有限公司。
1.1.4 抗原血清 鸡新城疫血凝抑制(HI)试验用抗原、鸡新城疫HI试验用阳性血清购自中国兽医药品监察所。
1.2 方法
1.2.1 疫苗免疫鸭的最小免疫剂量试验 将1日龄雏三穗麻鸭40只按相同饲养管理条件饲养至7日龄,随机抽取20只采血作首次免疫前新城疫HI抗体水平检测。采血后随机将40只雏鸭分成4组,10只/组,分别用3种ND疫苗按不同剂量(CS2:0.5 mL、1.0 mL、1.5 mL;LaSota:0.2 mL、0.5 mL、1.0 mL;A-Ⅶ:0.2 mL、0.5 mL、1.0 mL)进行颈部皮下注射,对照组不免疫。免疫后21 d,连同对照组采血分离血清,测定HI抗体效价。
1.2.2 疫苗免疫鸭的免疫持续期比较试验 将3种ND疫苗按最小免疫剂量通过颈部皮下注射方式分别免疫10只7日龄雏鸭,2周后加强免疫1次,各免疫组同时设10只不做加强免疫,仅监测HI抗体效价消长规律。另设10只作为不免疫对照。分别在免疫后的14、21、28、60、90、120、150 d采血,测定HI抗体效价。
1.2.3 免疫鸭的攻毒试验 将3种ND疫苗按最小免疫剂量通过颈部皮下注射方式分别免疫10只7日龄雏鸭,2周后各组选择5只鸭加强免疫1次,另外5只鸭不加强免疫,同时设5只不免疫鸭作为对照。在免疫后第21天,以0.5 mL ZY株新鲜病毒尿囊液原液分别对各组鸭进行腿部肌肉注射,在攻毒后的第3、5和7天分别采集鸭的喉头和泄殖腔拭子,处理后接种10日龄SPF鸡胚分离病毒,检测免疫鸭的排毒情况。
2 结果与分析
2.1 疫苗对鸭的最小免疫剂量测定 按照ND疫苗使用说明书,用不同剂量疫苗经颈部皮下注射免疫后21 d,均可诱导雏鸭产生不同程度的抗新城疫HI抗体,疫苗免疫剂量与HI抗体水平呈现正相关;在相同的疫苗免疫剂量(0.5或1.0 mL)时,LaSota组、A-Ⅶ组产生的抗体滴度显著高于CS2组(P<0.01)(表1)。有研究表明,免疫家禽的ND血清HI抗体效价与攻毒保护呈正相关,当血清HI抗体效价不低于1∶32时,可判定为免疫保护[11]。通过疫苗最小免疫剂量试验结果可以看出,CS2组、LaSota组、A-Ⅶ组使用剂量分别为1.0、0.5和0.2 mL/只时可达到免疫保护,为疫苗的最小免疫剂量。
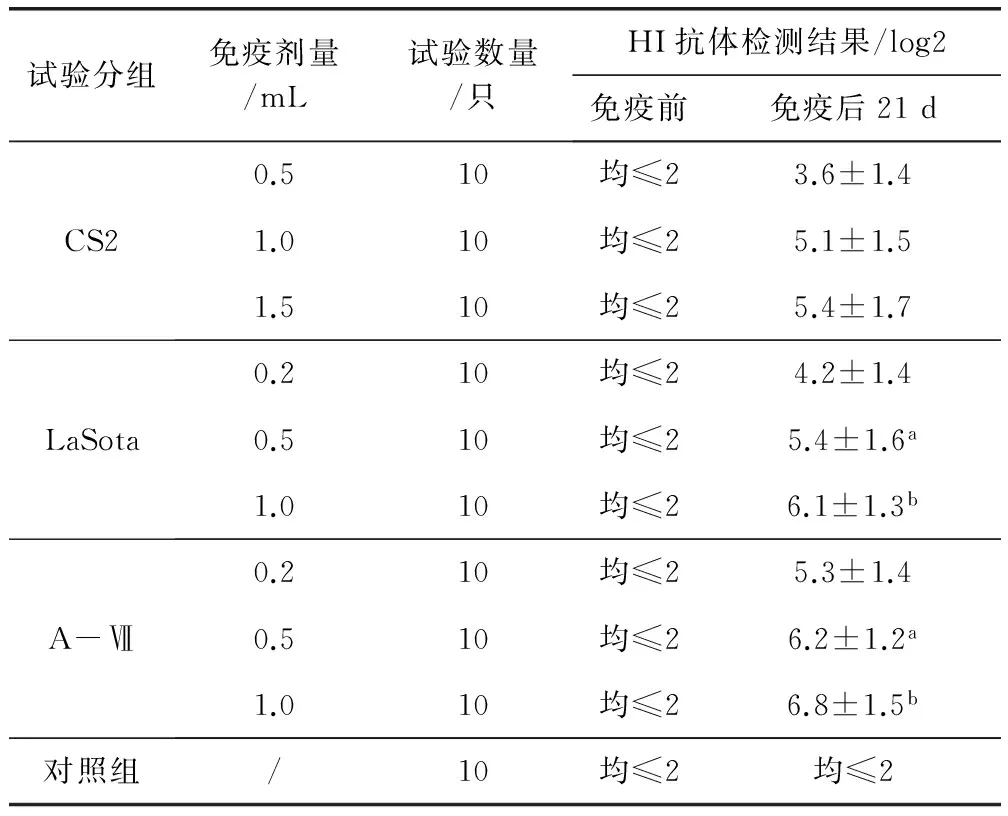
表1 新城疫疫苗免疫雏鸭的最小免疫剂量测定结果Tab 1 The minimum immune dosage of ND vaccines tested in ducks
2.2 疫苗对鸭的免疫持续期测定 由表2结果可见,3种ND疫苗免疫7日龄雏鸭后(CS2组和LaSota组按最小免疫剂量,A-Ⅶ组使用与LaSota组相同的免疫剂量),从14d至150d不同疫苗免疫产生的抗体水平整体呈先上升后下降的趋势,并且疫苗2次免疫要高于1次免疫所产生的抗体滴度;各免疫组不同免疫次数的鸭在第60天抗体滴度达到高峰,A-Ⅶ组产生的抗体滴度明显高于CS2组和LaSota组(P<0.01),但LaSota组和CS2组之间的抗体滴度差异不显著(P>0.05)。从3种疫苗的免疫效果和抗体持续期来看,A-Ⅶ组1次或2次免疫雏鸭后在第60天产生的平均抗体效价最高,分别为7.5log2和8.1log2,并且在免疫后的第150天平均抗体水平仍维持在1∶32左右,免疫效果明显优于CS2组和LaSota组。
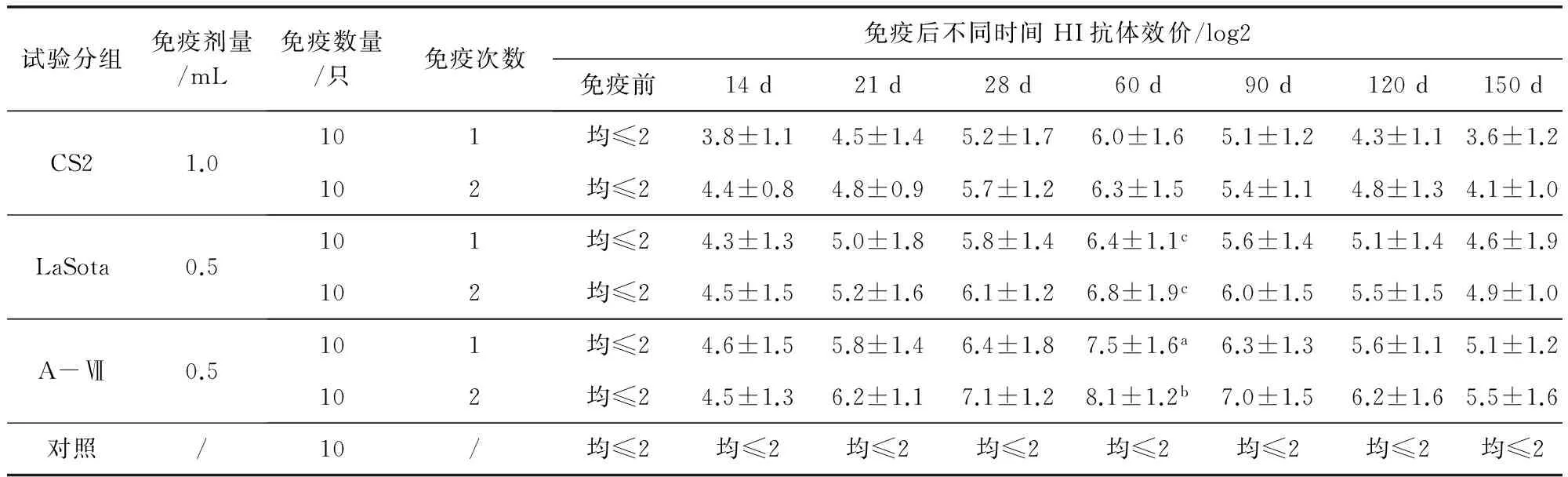
表2 新城疫疫苗免疫雏鸭的免疫持续期试验结果Tab 2 The persistent period of ND antibody in different vaccine-immunized ducks
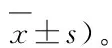
2.3 免疫鸭的排毒情况检测 对3种疫苗按不同免疫次数免疫鸭后第21天进行攻毒,检测免疫鸭的排毒情况。由表3可以看出,CS2组不同免疫次数的鸭在第3、5和7天鸭喉头和泄殖腔均存在排毒现象,并且排毒率高;LaSota组的个别免疫鸭喉头和泄殖腔存在排毒;A-Ⅶ组的免疫鸭不出现排毒。作为对照组,不免疫的鸭感染NDV后喉头和泄殖腔排毒率最高。
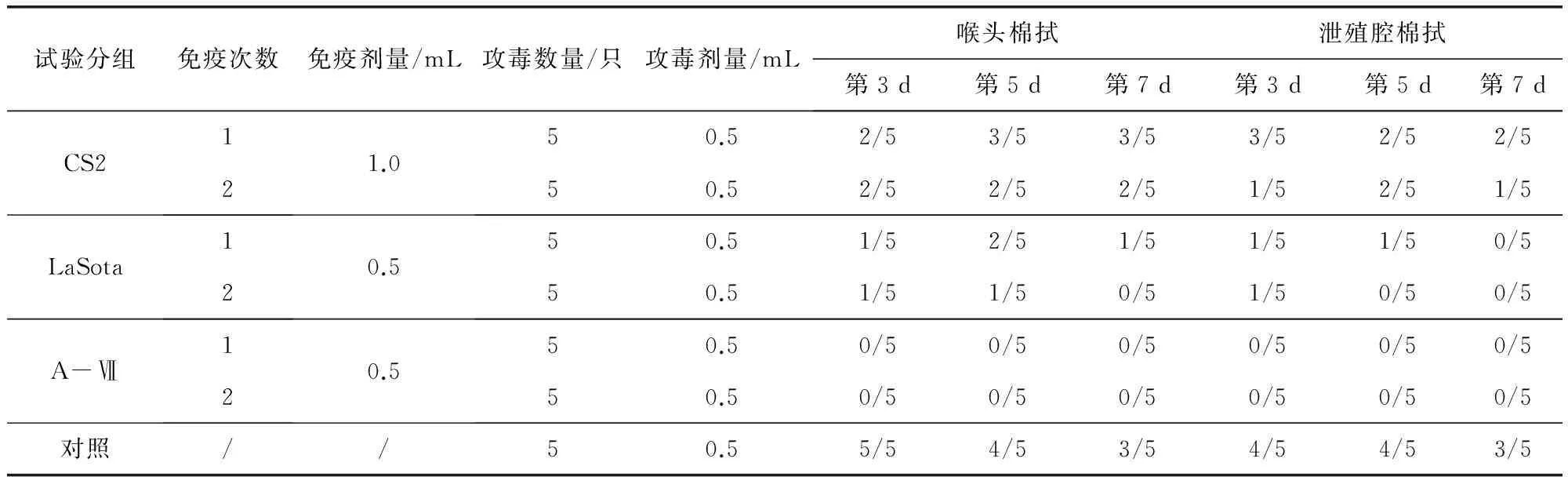
表3 免疫鸭攻毒后的排毒情况检测Tab 3 Detection of the virus shedding of immunized ducks
/表示不免疫
/ indicate nonimmunity
3 讨论与小结
越来越多的研究表明,水禽在NDV进化、传播和维持过程中发挥了重要作用[2, 12-13]。2001年Gould等[14]首次报道了澳大利亚当地水禽中的无致病性NDV毒株经过30年在鸡群中的循环感染变成了强毒株;2002年Yu等[15]和2015年Meng等[16]分别将水禽中分离的NDV弱毒株通过在鸡的气囊或脑内连续传代,短时间就产生了强毒NDV。以上结果说明,水禽中无致病性的NDV在自然条件下可以通过陆生禽类传播而产生强毒,只是相比人工感染需要更长的时间。水禽作为NDV的天然储存宿主,其感染发病和排毒情况也受到关注。目前研究证实我国流行的基因Ⅶ型NDV是主要病原,在家鹅中已成为地方流行,对家鸭的毒力也在逐渐增强,并且感染鸭群可长期向环境中排毒而感染其它鹅群或鸡群[8,10]。因此,加强对鸭源NDV的遗传进化研究和疫苗防控是保障家禽健康养殖的一个重要方面。
近年来,ND疫苗在世界范围内的广泛使用较好地控制了鸡群ND的发生,但水禽ND免疫还未受到重视。为研究不同ND疫苗对贵州三穗麻鸭的免疫效果,本实验选用国内常用的NDⅠ系活疫苗(CS2株)、Ⅳ系灭活疫苗(LaSota株)和新型基因Ⅶ型NDV灭活疫苗(A-Ⅶ株)分别对三穗麻鸭进行免疫,发现3种疫苗均能诱导鸭产生较高的抗体滴度,但重组NDV灭活疫苗(A-Ⅶ株)所需的免疫剂量低,1次或2次免疫诱发的抗ND HI抗体滴度最高,并且抗体持续期长,在免疫后第150天抗体滴度仍能达到免疫保护要求。在免疫禽群排毒研究方面,国内外研究表明:常用的疫苗株LaSota、Mukteswar、V4等虽然诱导产生的抗体能保护家禽,但不能防止免疫禽群中病毒的感染复制和排毒,当使用与流行株一致的NDV疫苗株才能显著降低免疫家禽的强毒感染率和排毒量[17-18]。本研究对3种ND疫苗免疫鸭后进行排毒检测,发现活疫苗CS2株免疫后的鸭喉头和泄殖腔持续排毒,灭活疫苗LaSota株免疫后的鸭排毒量少且时间短,而灭活疫苗A-Ⅶ株免疫后的鸭未检测到排毒。原因可能是由于CS2株诱导鸭产生的抗体水平低,并且与NDV流行株ZY株的遗传距离远,存在抗原性差异所致。这与Miller等[17]研究结果“当疫苗株与攻毒株为同一基因型时,疫苗株能有效减少禽体内病毒的携带量,并且疫苗株与流行毒株的遗传距离相近时,其诱导的免疫保护效果较为理想”相符。综上所述,重组NDV灭活疫苗(A-Ⅶ株)对贵州三穗麻鸭在免疫剂量、免疫次数、免疫后的抗体滴度和持续时间,以及抑制免疫鸭排毒方面均明显优于传统ND疫苗,这对选择合适的ND疫苗在贵州省鸭群中进行推广应用以及控制NDV在家禽中的流行提供了理论依据。
[1] Ganar K, Das M, Sinha S,etal. Newcastle disease virus: current status and our understanding [J]. Virus Research, 2014, 184:71-81.
[2] 刘秀梵. 家养水禽在A型流感病毒和新城疫病毒进化和疾病流行中的作用[J]. 中国家禽, 2007, 29(15):1-7.
Liu X F. The Role of Domestic waterfowl in the evolution and prevalence of influenza a virus and Newcastle disease virus[J]. China Poultry, 2007, 29(15):1-7.
[3] 刘华雷, 郑东霞, 孙承英, 等. 1997-2005年中国水禽新城疫分子流行病学特点分析[J]. 畜牧兽医学报, 2009, 40(1):145-148.
Liu H L, Zheng D X, Sun C Y,etal. Molecular epidemiology analysis of Newcastle disease outbreaks in waterfowl during 1997 to 2005 in China [J]. Acta Veterinaria et Zootechnica Sinica, 2009, 40(1):145-148.
[4] 丁壮, 尹仁福, 薛 聪, 等. 新城疫流行病学新特点及鹅源新城疫防控策略[J]. 中国兽医学报, 2015, 35(1):159-168.
Ding Z, Yin R F, Xue C,etal. The epidemiology characteristics of Newcastle disease and the prevention and control strategies of geese Newcastle disease virus[J]. Chinese Journal of Veterinary Science, 2015, 35(1):159-168.
[5] Liu X F, Wan H Q, Ni X X,etal. Pathotypical and genotypical characterization of strains of Newcastle disease virus isolated from outbreaks in chicken and goose flocks in some regions of China during 1985-2001[J]. Archives of Virology, 2003, 148(7): 1387-1403.
[6] Qin Z M, Tan L T, Xu H Y,etal. Pathotypical characterization and molecular epidemiology of Newcastle disease virus isolates from different hosts in China from 1996 to 2005 [J]. Journal of Clinical Microbiology, 2008, 46(2):601-611.
[7] 吴焕荣, 刁有祥, 李宏梅, 等. 鸭源副黏病毒的致病性试验[J]. 中国兽医学报, 2011, 31(1):36-39.
Wu H R, Diao Y X, Li H M,etal. Pathogenicity of duck paramyxovirus [J]. Chinese Journal of Veterinary Science, 2011, 31(1):36-39.
[8] 伊惠, 胡北侠, 杨少华, 等. 基因VII型新城疫病毒对鸭和SPF鸡致病性比较研究[J]. 畜牧兽医学报, 2013, 44(12):1982-1988.
Yin H, Hu B X, Yang S H,etal. Pathogenicity comparison of Newcastle disease virus isolates of genotype VII in ducks and SPF chickens [J]. Acta Veterinaria et Zootechnica Sinica, 2013,44(12):1982-1988.
[9] 鲁爱玲, 刁有祥, 崔京腾, 等. 鸭源新城疫病毒对鹅的致病性试验[J]. 中国兽医学报, 2014, 34(8):1239-1243.
Lu A L, Diao Y X, Cui J T,etal. Pathogenicity of duck Newcastle disease virus for geese[J]. Chinese Journal of Veterinary Science, 2014, 34(8):1239-1243.
[10]段志强, 许厚强, 嵇辛勤, 等. 贵州省鸭源新城疫病毒强毒株的遗传变异分析及致病性研究[J]. 畜牧兽医学报, 2016, 47(8):1623-1634.
Duan Z Q, Xu H Q, Ji X Q,etal. Genetic variation and pathogenicity analysis of virulent Newcastle disease viruses isolated from ducks in Guizhou province [J]. Acta Veterinaria et Zootechnica Sinica, 2016, 47(8):1623-1634.
[11]张春杰, 李婉涛, 程相朝, 等. 雏鸡新城疫母源抗体与首免日龄关系的再探讨[J]. 河南农业科学, 2002, (8):41-43.
Zhang C J, Li W T, Cheng X C,etal. Re-discussion on the relationship between the levels of ND maternal HI antibody and the first immunization age[J]. Journal of Henan Agricultural Sciences, 2002, (8):41-43.
[12]刘秀梵, 胡顺林. 新城疫病毒的进化及其新型疫苗的研制[J]. 中国兽药杂志, 2010, 44(1):12-18.
Liu X F, Hu S L. Evolution of Newcastle disease virus and the development of novel vaccines[J]. Chinese Journal of Veterinary Drug, 2010, 44(1):12-18.
[13]胡顺林, 刘秀梵. 新城疫病毒的进化[J]. 生命科学, 2016, 28(3):295-302.
Hu S L, Liu X F. The heredity and evolution of Newcastle disease virus[J]. Chinese Bulletin of Life Sciences, 2016, 28(3):295-302.
[14]Gould A R. Virulent Newcastle disease in Australia: molecular epidemiological analysis of viruses isolated prior to and during the outbreaks of 1998-2000[J]. Virus Research, 2001, 77(1):51-60.
[15]Yu S Q, Noriko K, Hiroshi I,etal. Generation of velogenic Newcastle disease viruses from a nonpathogenic waterfowl isolate by passaging in chickens[J]. Virology, 2002, 301(2):206-211.
[16]Meng C, Qiu X, Yu S,etal. Evolution of Newcastle disease virus quasispecies diversity and enhanced virulence after passage through chicken air sacs[J]. Journal of Virology, 2015, 90(4):2052-2063.
[17]Miller P J, Afonso C L. Antigenic differences among Newcastle disease virus strains of different genotypes used in vaccine formulation affect viral shedding after a virulent challenge[J]. Vaccine, 2007, 25(41):7238-7246.
[18]Hu S L, M H L, Liu X F,etal. A vaccine candidate of atte ̄nuated genotype VII Newcastle disease virus generated by reverse genetics[J]. Vaccine, 2009, 27(6): 904-910.
(编辑:李文平)
Comparison of the Immune Effect of Different Newcastle Disease Vaccines onSansui Sheldrake Ducks in Guizhou Province
HU Yan1, JI Xin-qin1,2, RUAN Yong1,2, ZHAO Jia-fu1,2, LEI Yun1, DUAN Zhi-qiang1,2*, LIU Xiu-fan3*
(1. College of Animal Science, Guizhou University, Guiyang 550025, China; 2. Key Laboratory of Animal Genetics, Breeding and Reproduction in thePlateau Mountainous Region, Ministry of Education, Guizhou University, Guiyang 550025, China; 3. Key Laboratory of Animal Infectious Diseases ofMinistry of Agriculture, Yangzhou University, Yangzhou , Jiangsu 225009, China)
DUAN Zhi-qiang, E-mail: zqduan@gzu.edu.cn; LIU Xiu-fan, E-mail: xfliu@yzu.edu.cn
To explore the immune effect of different Newcastle disease (ND) vaccines on Sansui Sheldrake ducks, ND live vaccine (CS2 strain), inactivated vaccine (LaSota strain) and recombinant genotype Ⅶ inactivated vaccine (A-Ⅶ strain) were used to inoculate 7-day-old ducks. The minimum immune dosage of vaccines, the dynamic regularity of antibody titers, and the virus shedding of immunized ducks were evaluated. Results showed that the minimum immune dosage of three vaccines was 1.0 mL, 0.5 mL and 0.2 mL, respectively. Although the antibody level induced by the vaccines with two immune times was higher than one immune time, the antibody titer of immunized ducks all reached a peak at 60 days post-immunization. However, both one and two immunization times of A-Ⅶ strain vaccine induced the highest antibody titer than other vaccines, which were 7.5log2 and 8.1log2, respectively. Meanwhile, the antibody persistent period of A-Ⅶ strain vaccine reached 150 days, which could still provide immunoprotection. Virus shedding experiment indicated that A-Ⅶ strain vaccine could absolutely suppress the virus shedding. These results demonstrated that recombinant genotype Ⅶ NDV inactivated vaccine (A-Ⅶ strain) is superior to the traditional ND vaccines in the aspects of the immune dosage, the immunization time, the titer and persistent period of antibody, and the inhibition of virus shedding.
Newcastle disease virus; Sansui Sheldrake duck; Newcastle disease vaccine; immune effect
10.11751/ISSN.1002-1280.2017.5.01
教育部"促进与美大地区科研合作与高层次人才培养项目"(教外司美[2014]2029号);贵州省省校合作计划项目(黔科合LH字[2014]7669号)
胡 焱,硕士研究生,从事家禽疫病免疫机理研究。
段志强,E-mail: zqduan@gzu.edu.cn;刘秀梵,E-mail: xfliu@yzu.edu.cn
2016-11-23
A
1002-1280 (2017) 05-0001-06
S855.3

