2型糖尿病和糖调节异常患者胰岛α、β细胞功能的变化*
王小娟,关秀军,邓斌,高凌
(1.湖北省武汉市第八医院 内科,湖北 武汉 430010;2.武汉大学人民医院 内分泌科,湖北 武汉430060)
2型糖尿病和糖调节异常患者胰岛α、β细胞功能的变化*
王小娟1,关秀军1,邓斌1,高凌2
(1.湖北省武汉市第八医院 内科,湖北 武汉 430010;2.武汉大学人民医院 内分泌科,湖北 武汉430060)
目的 探讨2型糖尿病(T2DM)和糖调节异常(IGR)患者胰岛α、β细胞功能的变化。方法选取2014年4月-2016年4月在该院就诊的T2DM和IGR患者120例。其中,T2DM患者68例(T2DM组),IGR患者52例(IGR组),同时选取健康体检者40例作为对照组,观察各组空腹状态下胰岛素稳态模型分泌指数(HOMA-β)、胰岛素稳态模型胰岛素抵抗指数(HOMA-IR)水平。结果T2DM组血糖、胰高血糖素和游离脂肪酸分别为(8.70±0.73)mmol/L、(210.11±40.14)nmol/L和(0.89±0.21)mmol/L,与IGR组比较,差异有统计学意义(P<0.05),T2DM组高于IGR组;T2DM组胰岛素水平与对照组比较,差异有统计学意义(P<0.05);IGR组胰岛素水平与对照组比较,差异有统计学意义(P<0.05);T2DM组HOMA-IR为0.83(0.42,1.10),与IGR组、对照组比较,差异有统计学意义(P<0.05);而HOMA-β为(3.61±0.72),与对照组比较,差异有统计学意义(P<0.05);各组空腹胰高血糖素与HOMA-IR水平呈正相关(P<0.05),与HOMA-β呈负相关(P< 0.05);T2DM组和IGR组空腹胰高血糖素与游离脂肪酸呈正相关(P<0.05);口服葡萄糖耐量试验30、60、90和120 min时T2DM组胰岛素水平与IGR组、对照组比较,差异有统计学意义(P<0.05),IGR组与对照组比较,差异有统计学意义(P<0.05);口服葡萄糖耐量试验30、60、90和120 min时T2DM组胰高血糖素水平与IGR组、对照组比较,差异有统计学意义(P<0.05),IGR组与对照组比较,差异有统计学意义(P<0.05)。结论T2DM和IGR患者胰岛α、β细胞分泌异常,其中胰高血糖素和游离脂肪酸水平升高,且与HOMA-IR和HOMA-β水平有相关性。
2型糖尿病;糖调节异常;胰高血糖素;游离脂肪酸;胰腺α、β细胞
2型糖尿病(type 2 diabetes mellitus,T2DM)为内分泌疾病[1-2]。T2DM的长期发生、发展可导致心血管病变、视网膜病变,以及糖尿病肾病等的发生[3-4]。胰岛β细胞的功能变化在T2DM的发生、发展中发挥重要的调控作用,但迄今为止对于胰岛α细胞的功能变化研究不足[5-6]。胰岛α细胞功能异常导致的胰高血糖素的过度分泌是促进胰岛素抵抗和胰岛β细胞功能衰竭的重要因素之一,可加剧胰岛α细胞功能障碍的发生[7-8]。本研究重在探讨T2DM和糖调节异常(impaired glucose regulation,IGR)患者胰岛α、β细胞功能变化,为揭示T2DM的发病机制,以及后续治疗提供理论参考。
1 资料与方法
1.1 一般资料
选取2014年4月-2016年4月在湖北省武汉市第八医院就诊的T2DM和IGR患者120例。其中T2DM患者68例(T2DM组),IGR患者52例(IGR组)。同时选取健康者体检者40例作为对照组。纳入标准:①T2DM、IGR诊断符合中华医学会关于糖尿病的诊治指南[9];②年龄18~60岁;③所有对象知情同意并签署同意书。排除标准:①成人迟发性自身免疫性糖尿病;②合并有肿瘤等严重疾病;③对照组对象有一级亲属糖尿病家族史。
1.2 检测方法
清晨采集空腹静脉血,分离血清后,置入-20℃冰箱冷冻保存待测,采集标本后1周内检测血糖、胰岛素、胰高血糖素、游离脂肪酸及C肽,相关指标测定采用电化学发光全自动免疫分析仪(i2000,美国雅培公司),检测试剂盒购自福建新大陆生物技术有限公司。具体检测方法参照试剂盒说明书,试剂盒内配有质控血清或质控标准品,所有操作严格按照操作说明书完成。
胰岛素抵抗和胰岛素敏感指标的计算按照中华医学会制定的标准进行计算[10],胰岛素稳态模型分泌指数(insulin homeostasis model secretion index,HOMA-β)(CP)=0.27×FCP/(FPG-3.5),胰岛素稳态模型胰岛素抵抗指数(insulin homeostasis model insulin resistance index,HOMA-IR)(CP)=1.5+FPG× FCP/2800。
1.3 口服葡萄糖耐量试验
受试者在5 min内饮入300 ml含5 g葡萄糖的饮用水(儿童按1.75 g/kg体重给葡萄糖,计算口服葡萄糖用量至75 g葡萄糖),喝糖水后0.5、1.0和2.0 h分别静脉取血1次,并留取尿液做尿糖定性试验。各点血糖均超过正常值为糖尿病,1点超过正常值而未达到糖尿病诊断标准为糖耐量异常。
1.4 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,多组间比较用重复测量设计的方差分析,两两比较用LSD-t检验;非正态分布资料以M(P25,P75)表示,组间比较用秩和检验;相关分析用Pearson或Spearman相关分析;计数资料以率表示,用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 一般资料
3组一般资料比较,差异无统计学意义(P>0.05)。见表1。
2.2 各组患者空腹状态下血糖、胰岛素、胰高血糖素及游离脂肪酸的比较
空腹状态下,T2DM组和IGR组血糖、胰高血糖素及游离脂肪酸与对照组比较,差异有统计学意义(P<0.05),T2DM组和IGR组血糖、胰高血糖素及游离脂肪酸高于对照组,其中T2DM组血糖、胰高血糖素及游离脂肪酸与IGR组血糖、胰高血糖素及游离脂肪酸比较,差异有统计学意义(P<0.05),T2DM组高于IGR组。T2DM组胰岛素水平与对照组比较,差异有统计学意义(P<0.05),T2DM组胰岛素水平低于对照组;而IGR组胰岛素水平与对照组比较,差异有统计学意义(P<0.05),IGR组胰岛素水平高于对照组。见表2。
2.3 3组患者HOMA-IR和HOMA-β水平比较
T2DM组HOMA-IR水平与IGR组和对照组比较,差异有统计学意义(P<0.05),T2DM组HOMA-IR水平高于IGR组和对照组;而T2DM组HOMA-β水平与对照组比较,差异有统计学意义(P<0.05),T2DM组HOMA-β水平低于对照组。见表3。
2.4 空腹胰高血糖素与HOMA-IR、HOMA-β的相关性
T2DM组患者空腹胰高血糖素与HOMA-IR呈正相关(r=0.602,P=0.003),与HOMA-β呈负相关(r=-0.712,P=0.012)。IGR组患者空腹胰高血糖素与 HOMA-IR呈正相关(r=0.524,P=0.021),与HOMA-β呈负相关(r=-0.731,P=0.022)。对照组患者空腹胰高血糖素与HOMA-IR呈正相关(r= 0.551,P=0.011),与HOMA-β呈负相关(r=-0.716,P=0.010)。
2.5 空腹胰高血糖素与游离脂肪酸的相关性
Pearson相关分析显示,T2DM组和IGR组空腹胰高血糖素与游离脂肪酸呈正相关(r=0.548和0.533,P=0.001和0.000),对照组空腹胰高血糖素与游离脂肪酸无相关性(r=0.017,P=0.562)。
2.6 口服葡萄糖耐量试验中胰岛素水平的变化
T2DM组、IGR组及对照组30、60、90和120min的胰岛素水平比较,采用重复测量数据的方差分析,结果:①不同时间点的胰岛素水平有差异(F=23.281,P=0.000);②T2DM组、IGR组及对照组的胰岛素水平有差异(F=45.832,P=0.000);③T2DM组、IGR组及对照组的胰岛素水平变化趋势有差异(F=26.843,P=0.000)。见表4。
2.7 口服葡萄糖耐量试验中胰高血糖素水平的变化
T2DM组、IGR组及对照组30、60、90和120 min的胰高血糖素比较,采用重复测量数据的方差分析,结果:①不同时间点的胰高血糖素水平有差异(F= 20.094,P=0.000);②T2DM组、IGR组及对照组胰高血糖素比水平有差异(F=55.382,P=0.000)。③T2DM组、IGR组及对照组胰高血糖素水平趋势有差异(F=27.102,P=0.000)。见表5。
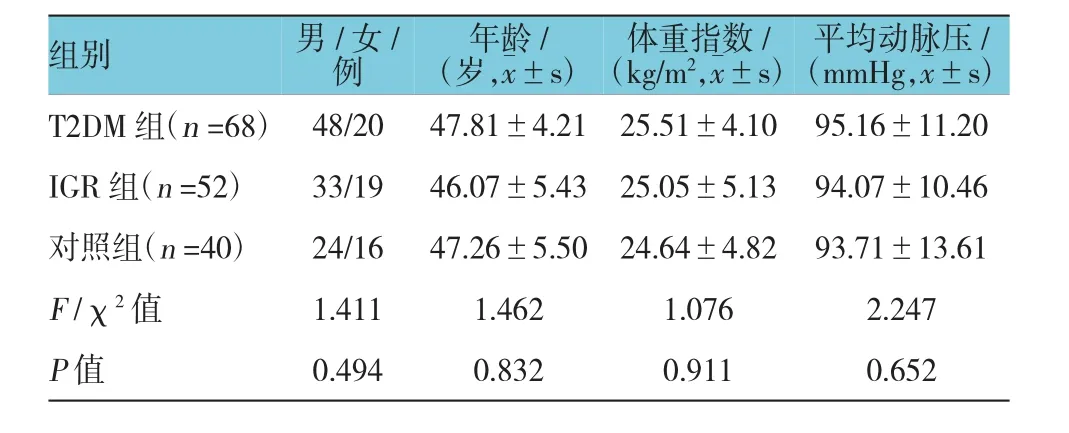
表1 3组一般资料比较
表2 3组患者空腹状态下血糖、胰岛素、胰高血糖素、及游离脂肪酸水平比较 (±s)
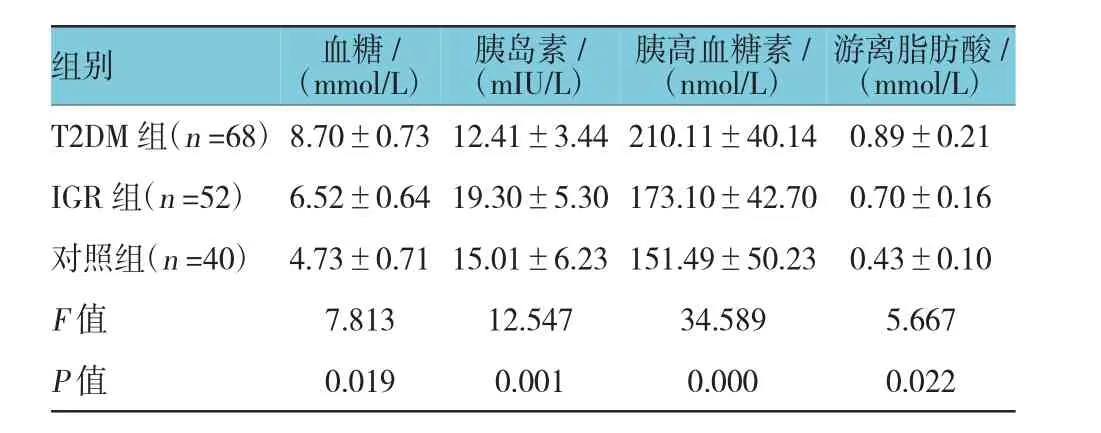
表2 3组患者空腹状态下血糖、胰岛素、胰高血糖素、及游离脂肪酸水平比较 (±s)
游离脂肪酸/(mmol/L)T2DM组(n=68)8.70±0.73 12.41±3.44 210.11±40.14 0.89±0.21 IGR组(n=52) 6.52±0.64 19.30±5.30 173.10±42.70 0.70±0.16对照组(n=40) 4.73±0.71 15.01±6.23 151.49±50.23 0.43±0.10 F值 7.813 12.547 34.589 5.667 P值 0.019 0.001 0.000 0.022组别 血糖/(mmol/L)胰岛素/(mIU/L)胰高血糖素/(nmol/L)
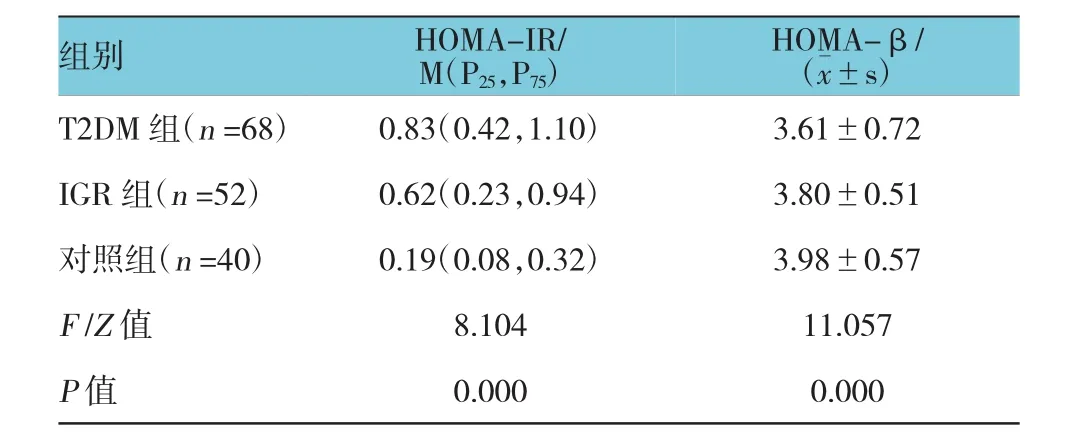
表33 组患者HOMA-IR和HOMA-β水平比较
表4 口服葡萄糖耐量试验中胰岛β细胞晚相分泌功能(±s)
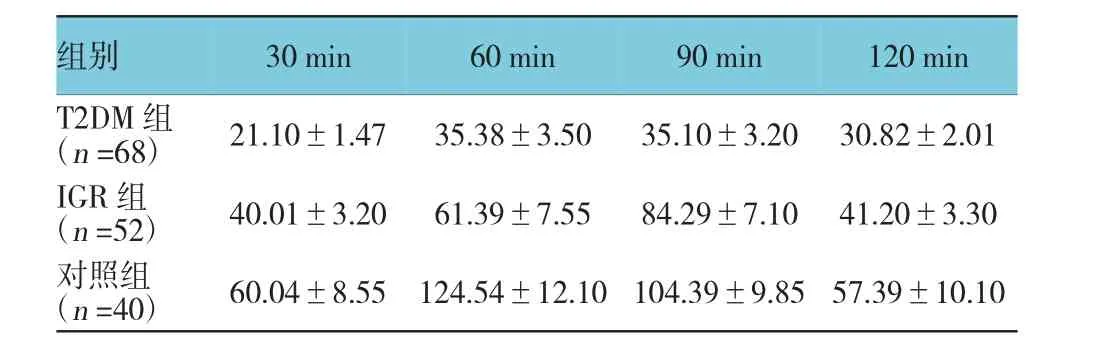
表4 口服葡萄糖耐量试验中胰岛β细胞晚相分泌功能(±s)
组别30 min 60 min 90 min 120 min T2DM组(n=68) 21.10±1.47 35.38±3.50 35.10±3.20 30.82±2.01 IGR组(n=52) 40.01±3.20 61.39±7.55 84.29±7.10 41.20±3.30对照组(n=40) 60.04±8.55 124.54±12.10 104.39±9.85 57.39±10.10
表5 口服葡萄糖耐量试验中胰岛α细胞晚相分泌功能(±s)
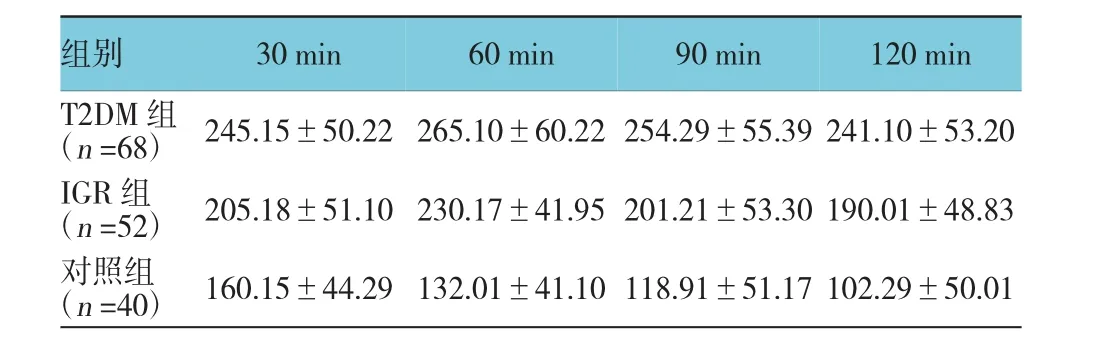
表5 口服葡萄糖耐量试验中胰岛α细胞晚相分泌功能(±s)
组别30 min 60 min 90 min 120 min T2DM组(n=68) 245.15±50.22 265.10±60.22 254.29±55.39 241.10±53.20 IGR组(n=52) 205.18±51.10 230.17±41.95 201.21±53.30 190.01±48.83对照组(n=40) 160.15±44.29 132.01±41.10 118.91±51.17 102.29±50.01
3 讨论
遗传易感基因、饮食习惯等因素均可促进T2DM的发生、发展。近几年来,在生活水平的提高的同时,高能量的因素摄入及缺乏体育锻炼等,导致我国部分地区的T2DM发生率>1.0%[10-11]。长期的血糖代谢障碍可导致大、中血管内皮细胞的损伤,促进冠状动脉粥样硬化、脑血管疾病的发生。在对T2DM发病机制的研究过程中,一般认为各种原因导致的胰岛β细胞功能衰竭和胰岛素高抵抗水平,是促进患者血糖调控异常的主要因素。然而在T2DM体内往往伴随着明显的高胰高血糖素症,高胰高血糖素与患者的空腹血糖水平具有一定的相关性[12-13],提示胰高血糖素可能参与到T2DM的发生、发展过程中。
胰高血糖素是由胰岛α细胞分泌,多种氨基酸组成的蛋白结构,其羧基末端含有多个重复的丝氨酸结构区域。胰高血糖素能够促进肝糖原分解和糖异生,使血糖明显升高,促进脂肪分解和脂肪酸氧化,为糖异生提供原料。胰高血糖素及胰岛素间存在着相互平衡及相互制约的关系,而血清中过高的胰高血糖素水平可以加剧胰岛β细胞膜的局部氧化应激损伤,促进磷脂酰肌醇3-激酶/蛋白激酶B信号通路介导的细胞凋亡和损伤,同时高胰高血糖素导致的免疫紊乱可以加剧胰岛β细胞分泌的胰岛素的减少[14-18]。另外,胰高血糖素促进脂肪分解的过程中产生的游离脂肪酸,可以通过影响氧化呼吸链过程中腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)的合成障碍,导致胰岛β细胞膜上ATP依赖的主动转运机制异常,促进胰岛β细胞生理功能丧失[19-21]。已有研究探讨在IGR和T2DM患者中,HOMA-IR、Homa-β的变化,但对于胰高血糖素及血清游离脂肪酸的研究不足,本研究在该基础上进一步探讨两者的相关性[22-23]。
本研究发现,在IGR和T2DM患者中均存在明显的空腹血糖调节异常,在正常组、IGR及T2DM患者中,空腹血糖逐渐上升,血糖调节异常逐渐加剧。虽然在IGR和T2DM患者中,胰岛素的分泌逐渐减少,但IGR组患者的胰岛素水平反而高于糖尿病组,考虑在在IGR发生、发展过程中,主要的病理机制为胰岛素抵抗的增加,此时胰岛β细胞内分泌功能正常,负反馈调节机制促进胰岛素的高分泌状态。HOMA-IR是评估胰岛素抵抗的指标,HOMA-β是评估残存胰岛β功能细胞的指标,随着病情的加剧,HOMA-IR逐渐上升,HOMA-β逐渐下降,胰岛素抵抗更为明显,胰岛素内分泌功能逐渐衰竭。随着空腹血糖调节异常的加剧,血清胰高血糖素呈现逐渐上升的趋势,血清游离脂肪酸也明显上升。胰高血糖素通过介导胰岛β细胞膜表面的PPAR受体,加剧氧自由基对于β细胞膜的损伤,同时胰高血糖素可以诱导CD4+T淋巴细胞毒性作用,促进β细胞的凋亡。而脂肪细胞分解过程中产生的游离脂肪酸,不仅导致胰岛内分泌细胞的ATP能量利用障碍,同时可以拮抗胰高血糖素介导的胰岛素的分泌,共同促进T2DM的发生、发展。VIGNESHWARAN[24]KAZIERAD等[25]学者通过回顾性分析43例IGR和45例T2DM患者的临床资料,发现胰高血糖素在IGRH和T2DM中可分别上升25%和36%,与本研究的结论较为一致,并认为控制胰高血糖素能够改善胰岛素抵抗,提高胰岛素受体的敏感性。相关性分析也发现,胰高血糖素水平越高,患者的胰岛素抵抗越为严重,残存胰岛素的功能越低,同时游离脂肪酸与胰高血糖素同样具有一致性的表达趋势。在正常人群中,并未发现两者的相关性,提示在正常人群中胰高血糖素主要表现为生理性的升高,不具有病理意义。
综上所述,胰高血糖素、血清游离脂肪酸在IGR和T2DM患者中均存在异常高表达,两者与糖尿病患者的胰岛素抵抗指数、胰岛素敏感指数关系密切。对于胰岛α细胞功能异常介导的胰高血糖素的研究,能够为临床上高胰岛素抵抗患者的治疗提供新的途径。
[1]杜雅芹,成旭东.DPP-4抑制剂(西格列汀)对糖尿病前期人群的治疗效果与安全性分析[J].现代仪器与医疗,2015,22(5):61-63.
[2]REN X,CHEN Z A,ZHENG S,et al.Association between triglyceride to HDL-C Ratio(TG/HDL-C)and insulin resistance in chinese patients with newly diagnosed type 2 diabetes mellitus[J]. PLoS One,2016,11(4):545-551.
[3]PHANSE M A,PATIL M J,ABBULU K.Synthesis,characterization and evaluation of the suppression of insulin resistance in Type-Ⅱ diabetes mellitus animals by treatment with metal complex[J].Saudi J Biol Sci,2016,23(3):420-425.
[4]MOJTO V,RAUSOVA Z,CHRENOVA J,et al.Erratum to: Short-term glucagon stimulation test of C-peptide effect on glucose utilization in patients with type 1 diabetes mellitus[J].Med Biol Eng Comput,2016,54(3):559-562.
[5]MAMMEN J,VADAKKEKUTTICAL R J,GEORGE J M,et al.Effect of non-surgical periodontal therapy on insulin resistance inpatients with typeⅡ diabetes mellitus and chronic periodontitis,as assessed by C-peptide and the homeostasis assessment index[J].J Investig Clin Dent,2016,24(6):90-93.
[6]MAGRI C J,FAVA S,GALEA J.Prediction of insulin resistance in type 2 diabetes mellitus using routinely available clinical pa rameters[J].Metabolic Syndrome Clinical Researc,2016,24(6): 90-93.
[7]詹琳,袁琼,占海霞,等.GLP-1R/SIRT1通路参与高糖诱导PC12细胞衰老[J].中国药理学通报,2015,24(11):21-23.
[8]杨华,杨晓东,饶丽华,等.糖代谢异常患者血清脂肪细胞脂肪酸结合蛋白的变化及其临床意义[J].中国糖尿病杂志,2016,24(4): 309-312.
[9]陈伟,姬秋和.《中国糖尿病医学营养治疗指南》的更新与发展[J].中华糖尿病杂志,2015,26(2):65-67.
[10]尉耘翠,祝茸,夏丽莉,等.超重及肥胖人群中不同胰岛素抵抗计算指数准确性评价[J].山东医药,2015,25(46):14-16.
[11]LOTFY M,KALASZ H,SZALAI G,et al.Recent progress in the use of glucagon and glucagon receptor antago-nists in the treatment of diabetes mellitus[J].Open Med Chem J,2014,8(4): 28-35.
[12]徐涛,石梅,邱云霞,等.胰高血糖素与2型糖尿病及糖调节异常的相关性研究[J].中国中药杂志,2014,39(12):2356-2363.
[13]熊周怡,张振.胰高血糖素样肽-1分泌调控机制的研究进展[J].广东医学,2015,32(18):2910-2912.
[14]秦铭,袁艳群,吴桂平,等.胎球蛋白A、脂肪细胞型脂肪酸结合蛋白及游离脂肪酸与中老年人2型糖尿病的相关性[J].广东医学, 2014,26(2):274-277.
[15]潘佳秋,郭晓闻,张超,等.新诊断2型糖尿病患者血清β抑制蛋白2与游离脂肪酸水平变化及其与胰岛素抵抗的关系研究[J].中国全科医学,2014,32(23):2700-2703.
[16]成玮,邓云,黄勤,等.口服谷氨酰胺对2型糖尿病患者血浆胰高血糖素样肽-1分泌的影响[J].东南大学学报(医学版),2015,22(2): 196-202.
[17]ARORA T,CHEN M Z,OMAR O M,et al.An investigation of the associations among sleep duration and quality,body mass index and insulin resistance in newly diagnosed type 2 diabetes mellitus patients[J].Ther Adv Endocrinol Metab,2016,7(1): 3-11.
[18]AHREN B,GALSTYAN G,GAUTIER J F,et al.Postprandial glucagon reductions correlate to reductions in postprandial glucose and glycated hemoglobin with lixisenatide treatment in type 2 diabetes mellitus:a post hoc analysis[J].Diabetes Ther,2016, 26(6):90-93.
[19]贺晓磊,高宇.脂肪酸合成酶在胰岛素抵抗与肿瘤关系中的研究进展[J].中国老年学杂志,2014,22(24):7150-7152.
[20]GUO X,YANG Q,DONG J,et al.Tumour risk with once-weekly glucagon-like peptide-1 receptor agonists in type 2 diabetes mellitus patients:a systematic review[J].Clin Drug Investig, 2016,36(6):433-441.
[21]OHKIT,ISOGAWA A,TODA N,etal.Effectivenessof ipragliflozin,a sodium-glucose co-transporter 2 inhibitor,as a second-line treatment for non-alcoholic fatty liver disease patients with type 2 diabetes mellitus who do not respond to incretin-based therapies including glucagon-like peptide-1 analogs and dipeptidylpeptidase-4 inhibitors[J].Clin Drug Investig, 2016,36(4):313-319.
[22]陈诚,蒋艳敏,卜瑞芳.胰高血糖素样肽1受体激动剂作用机制及其临床应用进展[J].山东医药,2015,26(44):99-101.
[23]JINNOUCHI H,SUGIYAMA S,YOSHIDA A,et al.Liraglutide, a glucagon-like peptide-1 analog,increased insulin sensitivity assessed by hyperinsulinemic-euglycemic clamp examination in patients with uncontrolled type 2 diabetes mellitus[J].J Diabetes Res,2015,25(4):706-707.
[24]VIGNESHWARAN B,WAHAL A,AGGARWAL S,et al.Impact of sleeve gastrectomy on type 2 diabetes mellitus,gastric emptying time,glucagon-like peptide 1 (GLP-1),ghrelin and leptin in non-morbidly obese subjects with bmi 30-35.0 kg/m: a prospective study[J].Obes Surg,2016,22(4):102-104.
[25]KAZIERAD D J,BERGMAN A,TAN B,et al.Effects of multiple ascending doses ofthe glucagon receptor antagonist, PF-06291874,in patients with type 2 diabetes mellitus[J].Diabetes Obes Metab,2016,26(5):45-47.
(童颖丹 编辑)
Functional changes of pancreatic islet α and β cells in patients with type 2 diabetes mellitus and impaired glucose regulation*
Xiao-juan Wang1,Xiu-jun Guan1,Bin Deng1,Ling Gao2
(1.Department of Internal Medicine,the Eighth Hospital of Wuhan,Wuhan,Hubei 430010, China;2.Department of Endocrinology,the People's Hospital of Wuhan University,Wuhan,Hubei 430060,China)
ObjectiveTo investigate the changes of pancreatic islet α and β cell function in patients with type 2 diabetes mellitus (T2DM)and impaired glucose regulation (IGR).MethodsFrom April 2014 to April 2016,120 patients with T2DM and IGR were selected in our hospital including 68 patients with T2DM (T2DM group)and 52 patients with IGR (IGR group),40 healthy persons were selected as control group. Insulin homeostasis model secretion index (HOMA-β)and insulin homeostasis model insulin resistance index (HOMA-IR)under fasting state were observed in each group.ResultsIn the T2DM group,blood glucose, glucagon and free fatty acid were significantly higher than those the IGR group (P<0.05).The insulin level in the T2DM group was significantly lower than that of the control group,and the insulin level in the IGR group was higher than that in the control group (P<0.05).HOMA-IR in the T2DM group was significantlyhigher than that of the IGR group and the control group,and the HOMA-β in the T2DM group was significantly lower than that of the control group (P<0.05).In each group fasting pancreatic glucagon was positively correlated HOMA-IR (P<0.05),and negatively correlated with HOMA-β (P<0.05).In the T2DM group and the IGR group fasting pancreatic glucagon and free fatty acids were positively correlated(P<0.05). At 30,60,90 and 120 min of the OGTT experiment the insulin level in the T2DM group was lower than that in the IGR group and the control group,while the insulin level in the IGR group was lower than that in the control group (P<0.05).At 30,60,90 and 120 min of OGTT experiment the glucagon level in the T2DM group was higher than that in the IGR group and the control group,while the glucagon level in the IGR group was higher than that in the control group (P<0.05).ConclusionsIn the patients with IGR and T2DM, the secretion of islet α and β cells is abnormal wherein the glucagon and free fatty acid levels are significantly increased,the glucagon level is correlated with HOMA-IR and HOMA-β.
type 2 diabetes mellitus;impaired glucose regulation;glucagon;free fatty acid;pancreatic α and β cells
R587.1
A
10.3969/j.issn.1005-8982.2017.09.023
1005-8982(2017)09-0108-05
2016-07-19
国家自然科学基金(No:81170767)

