结肠癌患者肿瘤微环境中T细胞亚群与肿瘤细胞转移的关系*
李宝龙,刘轲,计鹏飞,万晓晨
(1.浙江省宁波明州医院 普通外科,浙江 宁波 315100;2.浙江医院 检验科,浙江 杭州 310030)
结肠癌患者肿瘤微环境中T细胞亚群与肿瘤细胞转移的关系*
李宝龙1,刘轲1,计鹏飞1,万晓晨2
(1.浙江省宁波明州医院 普通外科,浙江 宁波 315100;2.浙江医院 检验科,浙江 杭州 310030)
目的探讨结肠癌患者肿瘤微环境中T细胞亚群与肿瘤细胞转移的关系。方法前瞻性收集该院收治的结肠癌患者89例,所有患者行结肠癌切除术,收集术中肿瘤标本,检测肿瘤组织中CD4+T细胞、CD8+T细胞和调节性T细胞。分析CD4+T细胞、CD8+T细胞及调节性T细胞与患者临床特征关系。结果随着TNM分期的增加,CD4+T细胞和调节性T细胞增加,CD8+T细胞降低(P<0.05)。高分化、中分化及低分化患者调节性T细胞分别为(6.59±1.87)%、(7.27±1.81)%和(8.12±1.92)%,差异有统计学意义(P<0.05)。合并淋巴结转移患者CD4+T细胞增高,CD8+T细胞降低,调节性T细胞升高(P<0.05)。腺癌、黏液癌期未分化癌调节性T细胞分别为(6.82±1.88)%、(7.28±1.82)%和(8.22±1.91)%,差异有统计学意义(P<0.05)。结论肿瘤微环境中T细胞亚群失衡与肿瘤细胞的转移相关,调节微环境中T细胞水平或可改善患者临床预后。
结肠癌;肿瘤微环境;T细胞;转移
结肠癌是中老年人最常见的恶性肿瘤之一,可发生于结肠的任何部位,早期常无明显症状或仅有便血、贫血等非特异性表现,是导致患者死亡的重要原因[1]。导致结肠癌患者预后不良的最主要危险因素是肿瘤细胞的转移,由于结肠癌早期不易被发现,因此确诊时部分患者已伴有局部淋巴结甚至远处转移[2-4]。近年来研究发现,肿瘤的转移与免疫系统相关,T细胞免疫功能失衡的患者更容易发生转移。2016年SUNDSTROM等[5]研究发现,调节性T细胞可以通过影响腺苷的活性,抑制细胞毒性T细胞进入肿瘤微环境,进而抑制机体免疫系统对肿瘤细胞的杀伤作用。SON等[6]动物实验显示,调节性T细胞敲除后的肺癌和结肠癌小鼠,放疗对肿瘤细胞的杀伤作用得到加强。免疫在肿瘤发生、发展中的作用为肿瘤治疗提供一个新方向。然而,目前关于结肠癌患者肿瘤微环境中T细胞亚群与肿瘤细胞转移的关系尚无相关报道。另外CARETHERS等[7]研究显示,不同种族的结肠癌肿瘤微环境中CD8+T细胞浸润情况不同。因此探讨我国结肠癌人群中肿瘤微环境中T细胞浸润情况及其临床意义,具有十分重要的临床意义。
1 资料与方法
1.1 一般资料
前瞻性选取2015年1月-2016年1月浙江省宁波明州医院收治的结肠癌患者。纳入标准:①结肠癌;②在本院确诊并接受手术治疗;③年龄18~65岁;④同意参与本研究。排除标准:①肝肾等脏器功能不全;②合并急性或慢性感染性疾病;③6个月内曾发生心肌梗死、脑梗塞等重大心血管疾病;④合并其他肿瘤;⑤系统性红斑狼疮等免疫性疾病;⑥甲状腺功能不全;⑦12个月内曾接受分子生物治疗、化疗或放疗等特殊治疗;⑧6个月内曾接受免疫调节剂治疗;⑨合并创伤等其他重大疾病。研究期间,根据纳入标准和排除标准,共纳入结肠癌患者89例,其中男性51例,女性38例。TNM分期:Ⅱ期34例,Ⅲ期39例,Ⅳ期16例;肿瘤细胞分化程度:高分化21例,中分化45例,低分化23例。肿瘤直径2.6~9.8 cm,平均肿瘤直径(5.48±1.87)cm。55例合并淋巴结转移,腺癌55例,黏液癌18例,未分化癌16例。本研究中所有患者知情同意并签署知情同意书,本研究通过医院伦理委员会批准。
1.2 观察指标
收集患者术中肿瘤标本,检测肿瘤标本中CD4+T细胞、CD8+T细胞和调节性T细胞。术中留取肿瘤组织,取据肿瘤边缘>1 cm的组织制作成细胞悬液,加入相关单克隆抗体后使用Epics XL型流式细胞仪(美国Beckman Coulter公司)检测T细胞亚群。同时收集患者年龄、性别、TNM分期、肿瘤分化程度、肿瘤直径、肿瘤组织类型及淋巴结转移等临床特征。分析不同临床特征患者T细胞亚群差异。
1.3 统计学方法
数据分析采用SPSS 22.0统计软件,计量资料以均数±标准差(±s)表示,用t检验或方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 不同性别肿瘤微环境中T细胞亚群相对水平比较
男性和女性肿瘤微环境中CD4+T细胞、CD8+T细胞及调节性T细胞水平比较,经t检验,差异无统计学意义(P>0.05)。见表1。
2.2 不同年龄肿瘤微环境中T细胞亚群相对水平比较
年龄≥50岁与<50岁人群肿瘤微环境中CD4+T细胞、CD8+T细胞及调节性T细胞水平比较,经t检验,差异无统计学意义(P>0.05)。见表2。
2.3 不同TNM分期肿瘤微环境中T细胞相对水平比较
表1 不同性别肿瘤微环境中T细胞亚群相对水平比较(%,±s)
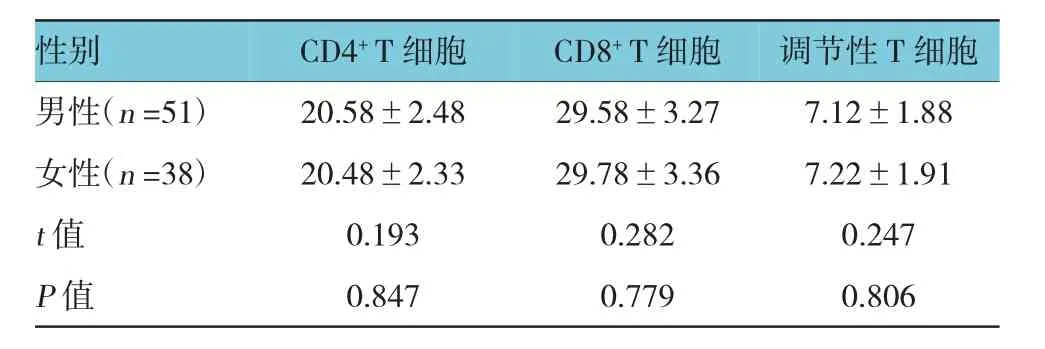
表1 不同性别肿瘤微环境中T细胞亚群相对水平比较(%,±s)
性别调节性T细胞男性(n=51) 20.58±2.48 29.58±3.27 7.12±1.88女性(n=38) 20.48±2.33 29.78±3.36 7.22±1.91 t值 0.193 0.282 0.247 P值 0.847 0.779 0.806 CD4+T细胞CD8+T细胞
表2 不同年龄肿瘤微环境中T细胞亚群相对水平比较(%,±s)
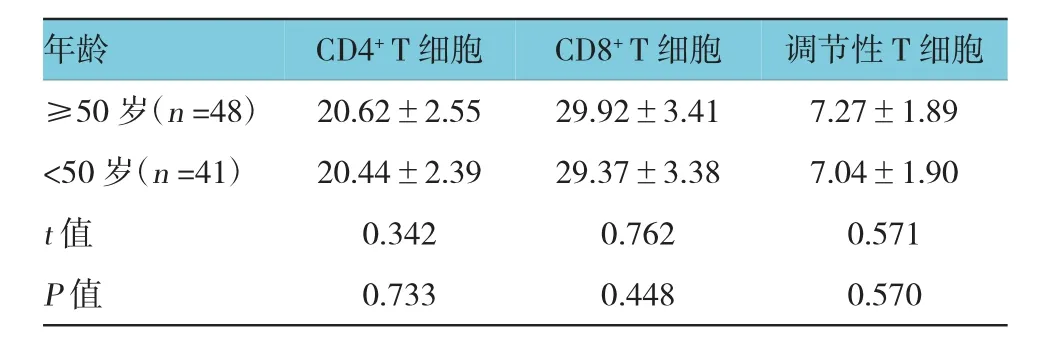
表2 不同年龄肿瘤微环境中T细胞亚群相对水平比较(%,±s)
年龄调节性T细胞≥50岁(n=48) 20.62±2.55 29.92±3.41 7.27±1.89 <50岁(n=41) 20.44±2.39 29.37±3.38 7.04±1.90 t值 0.342 0.762 0.571 P值 0.733 0.448 0.570 CD4+T细胞CD8+T细胞
不同TNM分期肿瘤微环境中CD4+T细胞、CD8+T细胞及调节性T细胞水平比较,经方差分析,差异有统计学意义(P<0.05),随着TNM分期增加,CD4+T细胞和调节性T细胞水平升高,CD8+T细胞水平降低。见表3。
2.4 不同肿瘤细胞分化程度肿瘤微环境中T细胞亚群相对水平比较
高分化、中分化和低分化患者调节性T细胞水平比较,经方差分析,差异有统计学意义(P<0.05)。肿瘤细胞分化程度与肿瘤微环境中T细胞亚群无关(P>0.05)。见表4。
2.5 不同肿瘤直径肿瘤微环境中T细胞亚群相对水平比较
直径≥5 cm与<5 cm患者的CD4+T细胞和CD8+T细胞及调节性T细胞水平比较,经t检验,差异无统计学意义(P>0.05)。见表5。
2.6 不同淋巴结转移肿瘤微环境中T细胞亚群相对水平比较
有无淋巴结转移患者的CD4+T细胞、CD8+T细胞及调节性T细胞水平比较,经t检验,差异有统计学意义(P<0.05),合并淋巴结转移的患者CD4+T细胞增高,CD8+T细胞降低,调节性T细胞升高。见表6。
2.7 不同肿瘤细胞病理类型肿瘤微环境中T细胞亚群相对水平比较
腺癌、黏液癌和未分化癌调节性T细胞水平比较,经方差分析,差异有统计学意义(P<0.05)。不同肿瘤细胞病理类型的患者CD4+T细胞和CD8+T细胞水平比较,经方差分析,差异无统计学意义(P>0.05)。见表7。
表3 不同TNM分期肿瘤微环境中T细胞相对水平比较(%,±s)
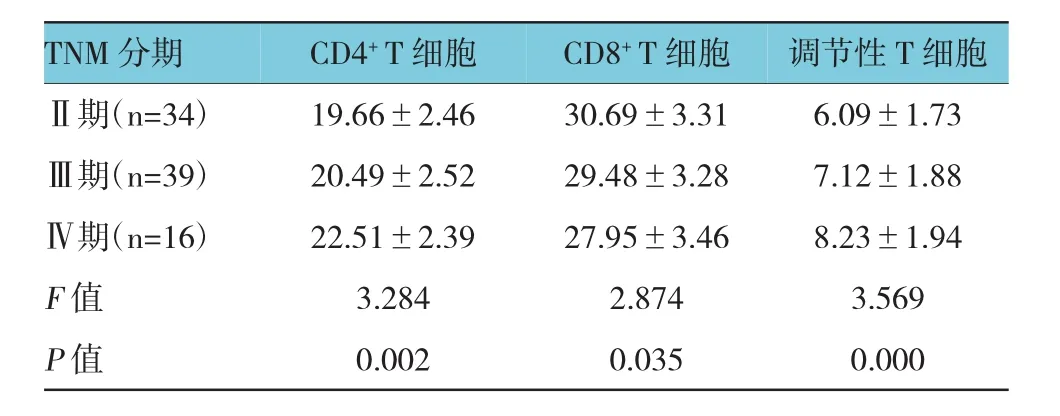
表3 不同TNM分期肿瘤微环境中T细胞相对水平比较(%,±s)
TNM分期 调节性T细胞Ⅱ期(n=34) 19.66±2.46 30.69±3.31 6.09±1.73 CD4+T细胞CD8+T细胞Ⅲ期(n=39)Ⅳ期(n=16)20.49±2.52 22.51±2.39 29.48±3.28 27.95±3.46 7.12±1.88 8.23±1.94 F值 3.284 2.874 3.569 P值 0.002 0.035 0.000
表4 不同肿瘤细胞分化程度肿瘤微环境中T细胞亚群相对水平比较 (%,±s)
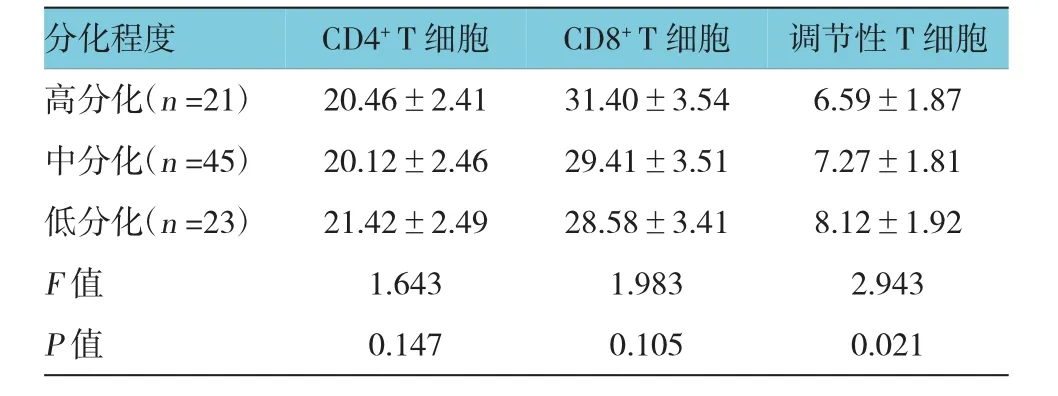
表4 不同肿瘤细胞分化程度肿瘤微环境中T细胞亚群相对水平比较 (%,±s)
分化程度 调节性T细胞高分化(n=21) 20.46±2.41 31.40±3.54 6.59±1.87 CD4+T细胞CD8+T细胞中分化(n=45)低分化(n=23)20.12±2.46 21.42±2.49 29.41±3.51 28.58±3.41 7.27±1.81 8.12±1.92 F值 1.643 1.983 2.943 P值 0.147 0.105 0.021
表6 不同淋巴结转移肿瘤微环境中T细胞亚群相对水平比较 (%,±s)
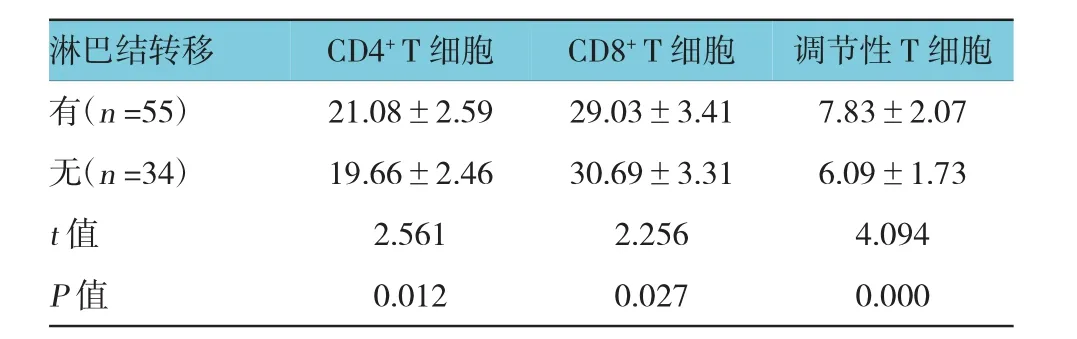
表6 不同淋巴结转移肿瘤微环境中T细胞亚群相对水平比较 (%,±s)
淋巴结转移 调节性T细胞有(n=55) 21.08±2.59 29.03±3.41 7.83±2.07无(n=34) 19.66±2.46 30.69±3.31 6.09±1.73 t值 2.561 2.256 4.094 P值 0.012 0.027 0.000 CD4+T细胞CD8+T细胞
表7 不同肿瘤细胞病理类型肿瘤微环境中T细胞亚群相对水平比较 (%,±s)
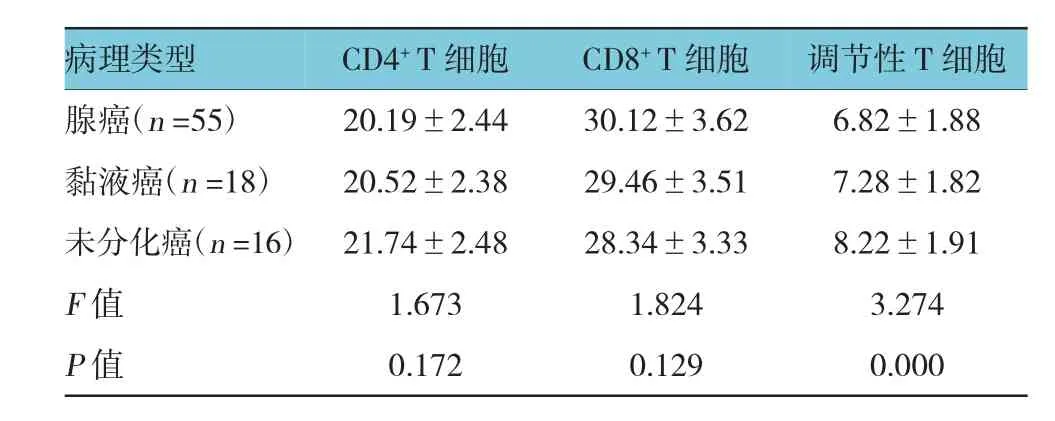
表7 不同肿瘤细胞病理类型肿瘤微环境中T细胞亚群相对水平比较 (%,±s)
病理类型 调节性T细胞腺癌(n=55) 20.19±2.44 30.12±3.62 6.82±1.88黏液癌(n=18) 20.52±2.38 29.46±3.51 7.28±1.82未分化癌(n=16) 21.74±2.48 28.34±3.33 8.22±1.91 F值 1.673 1.824 3.274 P值 0.172 0.129 0.000 CD4+T细胞CD8+T细胞
3 讨论
结肠癌好发于中老年人,可发生肝、肺转移,是威胁中老年人的一个重大疾病之一[8-9]。随着研究的发展,免疫系统在肿瘤发生、发展中的作用越来越受到重视,同时也为肿瘤的治疗提供新的方向。T细胞免疫在介导机体对肿瘤细胞的杀伤作用中起到关键作用。2017年SHARP等[10]研究显示,转移的结肠癌患者体内Th17细胞增加,Th17细胞可以促进肿瘤细胞对免疫系统的耐受。CARETHERS等[7]研究显示,不同种族的结肠癌肿瘤微环境中CD8+T细胞浸润情况不同。因此,很有必要探讨我国人群中结肠癌肿瘤微环境中T细胞亚群的表达水平及临床意义。CD4+T细胞、CD8+T细胞及调节性T细胞是T细胞亚群中的重要细胞。CD4+T细胞在抑炎因子的作用下,分化为调节性T细胞,主要介导肿瘤细胞对免疫系统的耐受。CD8+T细胞可以在促炎因子的作用下分化为细胞毒性T细胞,可以加强机体对肿瘤细胞的杀伤作用[11-12]。本研究结果显示,随着TNM分期的增加,CD4+T细胞和调节性T细胞增加,而CD8+T细胞水平降低(P<0.05)。表明TNM分期越高的患者,机体对肿瘤细胞的杀伤作用更弱。高分化、中分化及低分化患者调节性T细胞分别为(6.59±1.87)%、(7.27± 1.81)%和(8.12±1.92)%,差异有统计学意义,表明肿瘤细胞分化程度为低分化的患者对肿瘤细胞的杀伤作用较差。本研究结果还显示,合并淋巴结转移的患者CD4+T细胞和调节性T细胞水平升高,而CD8+T细胞水平降低,表明合并淋巴结转移的患者对肿瘤细胞的杀伤作用较差。未分化癌其恶性程度较腺癌和黏液癌高,临床预后较差[13]。本研究同样显示,未分化癌患者调节性T细胞水平较高。TNM分期高、肿瘤分化程度为低分化、淋巴结转移和未分化癌均是肿瘤细胞转移和预后不良的征象,说明结肠癌患者肿瘤微环境中T细胞亚群与肿瘤细胞的转移有关。SUNDSTROM等[5]研究也证实,结肠癌患者调节性T细胞水平升高,进而抑制效应性T细胞进入肿瘤微环境中,从而促进肿瘤的生长。2014年我国学者张利利等[17]研究同样表明,结肠癌患者外周血中调节性T细胞水平异常增高,且与患者临床分期有关。但该实验是研究患者外周血中免疫力,而本研究是探讨肿瘤微环境中T细胞免疫、肿瘤微环境中T细胞数量和功能对肿瘤的发生、发展的意义。
表5 不同肿瘤直径肿瘤微环境中T细胞亚群相对水平比较 (%,±s)
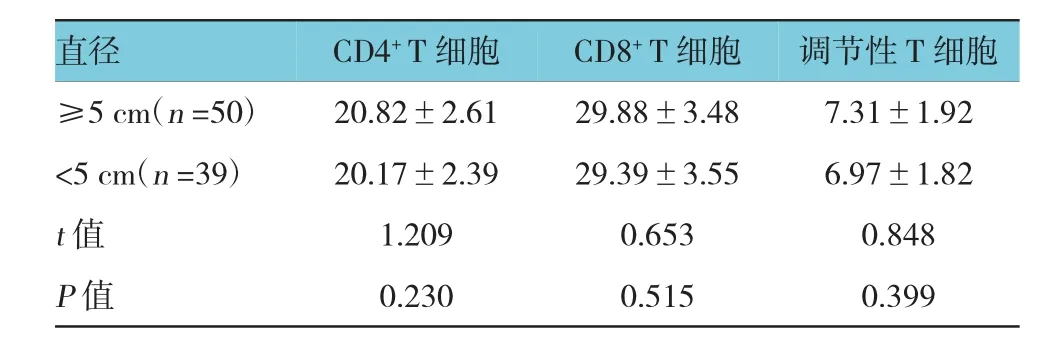
表5 不同肿瘤直径肿瘤微环境中T细胞亚群相对水平比较 (%,±s)
直径调节性T细胞≥5 cm(n=50) 20.82±2.61 29.88±3.48 7.31±1.92 <5 cm(n=39) 20.17±2.39 29.39±3.55 6.97±1.82 t值 1.209 0.653 0.848 P值 0.230 0.515 0.399 CD4+T细胞CD8+T细胞
综上所述,肿瘤微环境中T细胞亚群失衡与肿瘤细胞的转移相关,调节微环境中T细胞水平或可改善患者临床预后。
[1]GARCIA-LOPEZ S.Inflammatory bowel disease in Digestive disease week 2016:advances in epidemiology,follow-up,treatment monitoring,optimisation and individual tailoring,and colon cancer prevention[J].Gastroenterol Hepatol,2016,39 Suppl 1:29-35.
[2]OMAR H A,MOHIUDDIN M,SHARIF A.Colon cancer presenting as a testicular metastasis[J].Transl Gastroenterol Hepatol, 2016,1:89.
[3]BAE S U,HAN Y D,CHO M S,et al.Oncologic outcomes of colon cancer patients with extraregional lymph node metastasis: comparison of isolated paraaortic lymph node metastasis with resectable liver metastasis[J].Ann Surg Oncol,2016,23(5):1562-1568.
[4]KIM G E,LEE J S,PARK M H,et al.Metastasis associated in colon cancer 1 predicts poor outcomes in patients with breast cancer[J].Anal Quant Cytopathol Histpathol,2015,37(2):96-104.
[5]SUNDSTROM P,STENSTAD H,LANGENES V,et al.Regulatory T cells from colon cancer patients inhibit effector T-cell migration through an adenosine-dependent mechanism[J].Cancer Immunol Res,2016,4(3):183-193.
[6]SON C H,BAE J H,SHIN D Y,et al.Combination effect of regulatory T-cell depletion and ionizing radiation in mouse models of lung and colon cancer[J].Int J Radiat Oncol Biol Phys, 2015,92(2):390-398.
[7]CARETHERS J M,MURALI B,YANG B,et al.Influence of race on microsatellite instability and CD8+T cell infiltration in colon cancer[J].PLoS One,2014,9(6),DOI:10.1371/journal.pone. 0100461.
[8]OLIVEIRA A G,CURADO M P,KOECHLIN A,et al.Incidence and mortality from colon and rectal cancer in midwestern brazil[J]. Rev Bras Epidemiol,2016,19(4):779-790.
[9]UKEGJINI K,ZADNIKAR M,WARSCHKOW R,et al.Baseline mortality-adjusted survival in colon cancer patients[J].Langenbecks Arch Surg,2016,401(5):633-641.
[10]SHARP S P,AVRAM D,STAIN S C,et al.Local and systemic Th17 immune response associated with advanced stage colon cancer[J].J Surg Res,2017,208:180-186.
[11]OSINSKA I,STELMASZCZYK-EMMEL A,POLUBIEC-KOWNACKA M,et al.CD4+/CD25 high/FoxP3+/CD127-regulatory T cells in bronchoalveolar lavage fluid of lung cancer patients[J]. Hum Immunol,2016,DOI:10.1371/journal.pone.27474372.
[12]李姝君,吴艳霞,陈华林,等.非小细胞肺癌患者CD4+CD29+T细胞含量与复发及生存期的关系 [J].南方医科大学学报,2016, 36(9):1215-1220.
[13]FOK K L,CHUNG C M,YI S Q,et al.STK31 maintains the undifferentiated state of colon cancer cells[J].Carcinogenesis, 2012,33(11):2044-2053.
[14]MORRISON D S,PARR C L,LAM T H,et al.Behavioural and metabolic risk factors for mortality from colon and rectum cancer:analysis of data from the asia-pacific cohort studies collaboration[J].Asian Pac J Cancer Prev,2013,14(2):1083-1087.
[15]HUANG B,FENG Y,ZHU L,et al.Smaller tumor size is associated with poor survival in stageⅡ colon cancer:an analysis of 7719 patients in the SEER database[J].Int J Surg,2016, 33(Pt A):157-163.
[16]BAKKER I S,SNIJDERS H S,GROSSMANN I,et al.High mortality rates after nonelective colon cancer resection:results of a national audit[J].Colorectal Dis,2016,18(6):612-621.
[17]张利利,赵英政,张彩凤,等.Th17及CD4+CD25+调节性T细胞在结肠癌患者外周血中的表达[J].中国现代医学杂志,2014,24(11): 59-62.
(童颖丹 编辑)
Correlations between T cell subsets in tumor microenvironment and tumor cell metastasis in patients with colon cancer*
Bao-long Li1,Ke Liu1,Peng-fei Ji1,Xiao-chen Wan2
(1.Department of General Surgery,Mingzhou Hospital of Ningbo,Ningbo,Zhejiang 315100, China;2.Clinical Laboratory,Zhejiang Hospital,Hangzhou,Zhejiang 310030,China)
ObjectiveTo investigate the relationships between T cell subsets in tumor microenvironment and tumor cell metastasis in patients with colon cancer.MethodsA total of 89 patients with colon cancer in our hospital were enrolled.All patients underwent resection of colon cancer.The tumor specimens were collected.CD4+T cells,CD8+T cells and regulatory T cells in the tumor tissues were detected,and their correlations with clinical features of colon cancer patients were studied.ResultsWith the increase of TNM staging,CD4+T cells and regulatory T cells increased,and CD8+T cells decreased(P<0.05).The regulatory T cells of the patients with well-differentiated,moderately-differentiated and poorly-differentiated colon cancers were (6.59±1.87)%, (7.27±1.81)%and (8.12±1.92)%respectively,and the differences were statistically significant (P<0.05).CD4+T cells and regulatory T cells were increased,while CD8+T cells were decreased in the patients with lymph node metastasis (P<0.05).The regulatory T cells of adenocarcinoma,mucinous carcinoma and undifferentiated carcinoma were (6.82±1.88)%, (7.28±1.82)% and (8.22±1.91)% respectively,and the differences were statistically significant (P<0.05).ConclusionsThe imbalance of T cell subsets in tumor microenvironment is related to the metastasis of tumor cells,therefore regulation of the T cells in the microenvironment could improve the prognosis.
colon cancer;tumor microenvironment;T cell;metastasis
R735.35
A
10.3969/j.issn.1005-8982.2017.09.018
1005-8982(2017)09-0087-04
2016-02-10
2014年浙江省医药卫生一般研究计划(No:2014KYA003)

