PPARγ1基因转染对缺血再灌注心肌细胞凋亡的作用和影响
刘永平,魏来,陈文雁,孔高茵
(湖南省人民医院 麻醉医学中心,湖南 长沙 410005)
PPARγ1基因转染对缺血再灌注心肌细胞凋亡的作用和影响
刘永平,魏来,陈文雁,孔高茵
(湖南省人民医院 麻醉医学中心,湖南 长沙 410005)
目的 探讨心肌细胞过表达过氧化物酶体增殖物激活受体γ1(PPARγ1)基因对缺血再灌注损伤导致细胞凋亡的作用和影响。方法30只SD大鼠随机分为SHAM组、MIRI组、PPARγ1组,每组10只。SHAM组和MIRI组经冠状动脉转染携带绿色荧光蛋白的腺病毒载体(Ad-EGFP),PPARγ1组转染携带PPARγ1基因的腺病毒载体(Ad-PPARγ1)至心肌组织。稳定3 d后,SHAM组只过线,不接扎;MIRI组和PPARγ1组行心肌缺血再灌注损伤(缺血30 min,再灌注120 min)。电镜下观察各组心肌的超微结构变化,Western blot检测B淋巴细胞瘤-2基因(Bcl2)和Bcl2相关X蛋白(Bax),DNA断裂的原位末端标记法观察心肌细胞凋亡情况。结果缺血再灌注后,电镜下MIRI组心肌细胞结构损伤最严重,心肌纤维排列紊乱,有断裂和溶解现象,线粒体肿胀,结构模糊,部分嵴断裂溶解;PPARγ1组结构损伤较MIRI组减轻。与SHAM组比较,MIRI组Bcl2/Bax比值下降(P<0.05),PPARγ1组无明显变化(P>0.05);与MIRI组比较,PPARγ1组Bcl2/Bax比值上升(P<0.05)。MIRI组和PPARγ1组的心肌细胞凋亡数目较SHAM组升高(P<0.05);MIRI组高于PPARγ1组(P<0.05)。结论过表达PPARγ1基因能通过抗氧化应激、减少细胞凋亡来保护缺血再灌注心肌。
心肌缺血再灌注损伤;过氧化物酶体增殖物激活受体γ1;细胞凋亡
心肌缺血再灌注损伤(myocardial ischemia reperfusion injury,MIRI)是指缺血心肌在恢复血液灌注后,其细胞结构损伤及细胞功能障碍进一步加重的现象。临床上十分常见,如心肺复苏术、冠状动脉溶栓术、冠状动脉支架植入术、体外循环下心内直视手术等,尽早恢复受损心肌的血液灌注是临床上抢救的首要目标,但其带来的再灌注损伤早就引起学者的重视,大量的研究发现,细胞凋亡参与MIRI是MIRI重要的病理生理机制之一。随着对MIRI机制的深入研究,运用基因治疗的方法防治MIRI成为近年来众多学者的研究热点[1-3]。过氧化物酶体增殖物激活受体γ1(peroxisom eproliferator-activated receptor γ1,PPARγ1)是由配体激活的转录因子,其激活对调节体内的多种病理生理过程有重要作用。有研究认为,匹格列酮(PPARγ配体)通过抗氧化、抑制炎症因子表达等,对缺血再灌注心肌具有保护作用[4-5]。
1 材料与方法
1.1 实验动物及分组
选取健康成年雄性SD大鼠30只,月龄2~3个月,体重200 g~250 g,由湖南斯莱克景达公司提供。大鼠随机分为SHAM组、MIRI组、PPARγ1组,每组10只。SHAM组:转染携带绿色荧光蛋白的腺病毒载体(Ad-EGFP,上海吉凯基因技术有限公司提供)0.1 ml,滴度1×109PFU/ml,3 d后开胸,冠状动脉左前降支只过线,不结扎;MIRI组:转染Ad-EGFP 3 d后,结扎左前降支30 min,再灌注120 min;PPARγ1组:转染携带PPARγ1的腺病毒载体(PPARγ1,上海吉凯基因技术有限公司提供)0.1 ml,滴度1×109PFU/ml,3 d后结扎左前降支30 min,再灌注120 min。
1.2 复制动物模型
基因转染过程参照文献[6-7]。大鼠麻醉后固定,气管插管控制呼吸,开放尾静脉输液,接生理记录仪记录并分析心电图的变化。左胸部消毒、铺巾后,胸骨左缘3、4肋间进胸,打开心包,暴露心脏,分离主、肺动脉根部并在其下方过1根10号线;将线拉紧阻断主、肺动脉,同时心尖部用27号针头注入0.1 ml各组相应试剂至左心室腔,10 s后将线松开,通过心脏的跳动,使试剂通过冠状动脉循环进行充分的心肌分布,期间密切观察心脏的变化,如心跳无异常及心脏无明显出血后,充分膨肺并关胸。术毕,呼吸稳定后拔管。MIRI模型参照文献[8-9]。采用阻断大鼠冠状动脉左前降支复制MIRI模型。基因转染建立3 d后,用同样的方法麻醉、固定、控制呼吸、监测,原切口开胸,以6-0线于左心耳下缘2 mm处连同心大静脉一起结扎左前降支,结扎线以下心肌组织变紫,心电图呈现ST段弓背抬高为结扎成功的标志,结扎30 min,再灌注120 min。
1.3 指标检测
实验末立即开胸取心,4℃冷生理盐水中漂洗,取部分缺血区心肌组织,浸入2.5%戊二醛中,4℃冰箱保存,为电镜提供材料;取部分缺血区心肌组织,10%多聚甲醛固定,常规脱水、石蜡包埋、切片,DNA断裂的原位末端标记法 [terminal dexynucleotidyl transferase(TdT)-mediated dUTP nick end labeling,TUNEL]测凋亡;余心肌缺血组织按Western blot检测制成组织匀浆,测B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl2)和B淋巴细胞瘤-2基因相关X蛋白(B-cell lymphoma-2 associated X protein,Bax)含量。
1.4 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,用单因素方差分析,两两比较用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 电镜结果
2.1.1 SHAM组 心肌纤维排列整齐,肌小节各带清晰,线粒体包膜完整、分布均匀,基质均匀致密、嵴清晰完整。见图1。
2.1.2 MIRI组 心肌明显水肿,心肌纤维排列紊乱,有断裂和溶解现象,明暗带不清,线粒体肿胀,结构模糊,部分嵴断裂溶解。见图2。
2.1.3 PPARγ1组 心肌轻度水肿,肌丝排列尚整齐,明暗带尚清楚,线粒体轻度肿胀,部分嵴断裂溶解。见图3。
2.2 心肌细胞凋亡
正常细胞核为蓝色,凋亡细胞核为棕黄色。采用凋亡指数(凋亡指数=凋亡阳性细胞核数/总细胞核数×100%)来反映和比较各组心肌细胞凋亡整体情况。SHAM组、MIRI组、PPARγ1组大鼠心肌细胞凋亡指数分别为(1.7±0.4)%、(22.5±2.1)%和(14.8±1.6)%,经单因素方差分析,差异有统计学意义(F=7.331,P=0.003),SHAM组大鼠心肌细胞几乎无凋亡;与SHAM组比较,MIRI组和PPARγ1组大鼠心肌细胞凋亡增多(t=17.359和10.946,P=0.000);与MIRI组比较,PPARγ1组大鼠心肌细胞凋亡减少(t=6.412,P=0.000)。见图4~6。
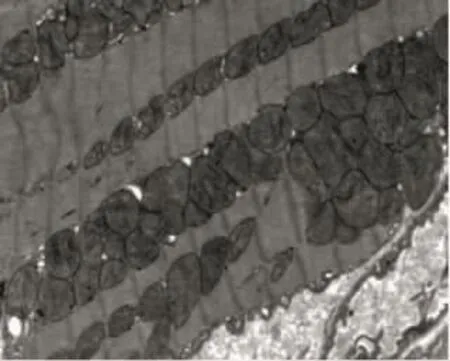
图1 SHAM组电镜结果(×8 000)

图2 PPARγ1组电镜结果(×8 000)

图3 MIRI组电镜结果(×8 000)

图4 SHAM组凋亡细胞(×200)

图5 MIRI组凋亡细胞(×200)

图6 PPARγ1组凋亡细胞 (×200)
2.3 各组大鼠心肌Bcl2、Bax蛋白表达水平变化
各组大鼠心肌Bcl2、Bax蛋白变化,经单因素方差分析,差异有统计学意义(P<0.05)。MIRI组Bcl2蛋白表达水平与SHAM组比较,经LSD-t检验,差异无统计学意义(t=1.069,P=0.295);MIRI组Bax蛋白表达水平、Bcl2/Bax比值与SHAM组比较,经LSD-t检验,差异有统计学意义(t=7.064和4.339,P= 0.000),MIRI组Bax蛋白表达水平上升,Bcl2/Bax比值下降。
PPARγ1组Bcl2、Bax蛋白表达水平与SHAM组比较,经LSD-t检验,差异有统计学意义(t=4.189和3.279,P=0.000和0.003),PPARγ1组Bcl2、Bax蛋白表达水平上升;PPARγ1组 Bcl2/Bax比值与SHAM组比较,经LSD-t检验,差异无统计学意义(t= 0.205,P=0.839)。
PPARγ1组Bcl2、Bax蛋白表达水平及Bcl2/Bax比值与MIRI组比较,经LSD-t检验,差异有统计学意义(t=5.258、3.785和 4.135,P=0.000、0.001和0.000),PPARγ1组Bcl2表达上调,Bax表达下调,Bcl2/Bax比值上升。见附表。
附表 各组Bcl2、Bax蛋白表达变化 (n=10,±s)
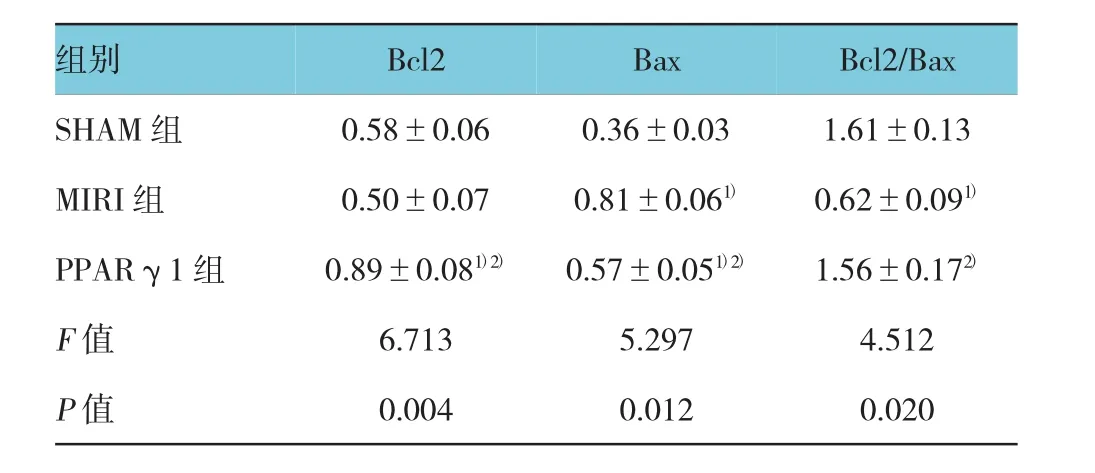
附表 各组Bcl2、Bax蛋白表达变化 (n=10,±s)
注:1)与SHAM组比较,P<0.05;2)与MIRI组比较,P<0.05
组别Bcl2/Bax SHAM组 0.58±0.06 0.36±0.03 1.61±0.13 MIRI组 0.50±0.07 0.81±0.061) 0.62±0.091)PPARγ1组 0.89±0.081)2) 0.57±0.051)2) 1.56±0.172)F值 6.713 5.297 4.512 P值 0.004 0.012 0.020 Bcl2Bax
3 讨论
有研究发现,细胞凋亡在MIRI的发展过程中扮演着重要角色,可能是MIRI发病机制中的重要环节之一[10]。细胞凋亡是一种受基因调控的程序性细胞死亡,细胞凋亡的过程非常复杂,Bcl2家族对细胞凋亡的调控具有很重要的作用。Bcl2家族蛋白的主要作用靶点位于线粒体膜上,在细胞凋亡过程中起着“主开关”作用[11]。Bcl2/Bax比值对调控细胞凋亡具有重要的意义。HOCHHAUSER等[12]研究发现,与野生型小鼠相比,Bax基因敲除的小鼠心肌梗死28 d后发现其左室舒张末期压和收缩末期内径下降,肌酸激酶与乳酸脱氢酶下降,心肌梗死面积变小,其抗凋亡效应起到心肌保护的作用。DAS等[13]研究发现,心肌细胞在缺血的病理生理过程中,其Bcl2/Bax比值决定细胞的生存或死亡。
PPAR是核受体超家族成员,有多种亚型,其中PPARγ是近年来最受关注的亚型,依赖配体激活,其活化后在转录水平调控多种细胞增殖、侵袭、分化和凋亡。PPARγ的配体包括天然配体和合成配体两类:①天然配体有15-脱氧前列腺素J2(15d-PGJ2)等;②而合成配体包括罗格列酮、吡咯列酮、环格列酮和曲格列酮等。PPARγ配体保护心肌的文献报告很多,然而不同化学结构其发挥保护作用的机制并不一样[14-16]。与罗格列酮比较,15d-PGJ2能激活PPARα、PPARγ,上调血红素加氧酶-1的表达,抑制NFκB、细胞间黏附分子-1、P选择素、巨噬细胞趋化蛋白1、诱导型一氧化氮合酶的表达,从而发挥心肌保护作用。LI等[17]研究发现,PPARγ通过抑制促炎介质基因的转录,从而在各种炎症损伤进程及炎症诱导的细胞凋亡中发挥重要的作用。REN等[18]研究发现,双氧水H2O2通过下调心肌细胞Bcl2蛋白而诱导凋亡,罗格列酮通过上调Bcl2而抵抗H2O2的氧化应激;Bcl2沉默后过表达PPARγ,心肌细胞对氧化应激敏感性增强,从而证明PPARγ能够通过上调Bcl2而对抗氧化应激,减少凋亡。
本研究发现,心肌在经历缺血再灌注后,心肌细胞超微结构发生明显改变,表现为心肌水肿明显,心肌纤维排列紊乱,有断裂和溶解现象,明暗带不清,线粒体肿胀,结构模糊,部分嵴断裂溶解;而PPARγ1组损伤明显减轻,表现为心肌轻度水肿,肌纤维排列尚整齐,明暗带尚清楚,线粒体轻度肿胀,部分嵴断裂溶解,说明过表达PPARγ1能明显减轻心肌细胞超微结构的改变。TUNEL法测凋亡显示,MIRI组有大量的心肌细胞凋亡,PPARγ1组则明显减少;而Bcl2/Bax的结果表明,与SHAM组比较,MIRI组降低;PPARγ1组无明显变化;与MIRI组比较,PPARγ1组回升(P<0.05),这表明心肌在发生I/R损伤后,很多心肌细胞发生凋亡,然而过表达PPARγ1能明显减少心肌细胞凋亡的发生,对心肌细胞起到保护作用。众所周知,MIRI机制复杂,冠状动脉转染PPARγ1基因抑制细胞凋亡的机制可能是冠状动脉转染PPARγ1基因后,导致PPARγ1基因在心肌过度表达,激活线粒体Bcl2/Bax通路,通过上调Bcl2/ Bax比值从而实现抑制细胞凋亡的作用。
MIRI是一个复杂的病理生理过程,涉及到氧自由基、钙超载、能量代谢障碍、中性粒细胞、细胞凋亡等因素,迄今尚无很好的防治手段。基因治疗针对的是异常基因本身,是对疾病根源的治疗,给疾病的预防和治疗带来新的希望,具有重要的医学价值,目前在心血管,癌症、自身免疫性疾病、传染性疾病等领域已是研究热点。本研究发现,过表达PPARγ1基因能通过抑制细胞凋亡,减轻心肌细胞结构的改变而起到心肌保护的作用。基因治疗作为一种全新的治疗手段,随着各种安全、高效、特异、可控的病毒和非病毒载体不断被研发,新的目的基因不断被扩展,基因治疗必将发挥着越来越重要的作用。
[1]B魣譙EZ B,HEUSCH G,OVIZE M,et al.Evolving therapies for myocardial ischemia/reperfusion injury[J].Journal of the American College of Cardiology,2015,65(14):1454-1471.
[2]ONG S B,SAMANGOUEI P,KALKHORAN S B,et al.The mitochondrial permeability transition pore and its role in myocardial ischemia reperfusion injury[J].Journal of Molecular Cellular Cardiology,2015,78:23-34.
[3]SIVARAMAN V,YELLON D M.Pharmacologic therapy that simulates conditioning for cardiac ischemic/reperfusion injury[J]. Journal of Cardiovascular Pharmacology Therapeutics,2014,19(1): 83-96.
[4]申琳,王浩,叶平.吡格列酮对大鼠缺血/再灌注心肌过氧化物酶体增殖物受体γ辅激活因子lα表达的影响[J].南方医科大学学报,2014(2):197-200.
[5]赵德福.吡格列酮对大鼠脑缺血再灌注的保护作用[J].辽宁医学院学报,2016,37(3):25-32.
[6]KASPAR B K,ROTH D M,LAI N C,et al.Myocardial gene transfer and long-term expression following intracoronary delivery of adeno-associated virus[J].J Gene Med,2005,7(3):316-324.
[7]杨昭云,徐军美,姜金玉,等.人白细胞介素-10和Bcl-2基因重组腺病毒经冠状动脉转染大鼠心肌的可行性[J].中华麻醉学杂志, 2006,26(11):1001-1004.
[8]THIBAULT H,GOMEZ L,DONAL E,et al.Acute myocardial infarction in mice:assessment of transmurality by strain rate imaging[J].Am J Physiol,2007,293(1):H496-H502.
[9]BHINDI R,WITTING P K,MCMAHON A C,et al.Rat models of myocardial infarction pathofenetic insights and clinical relevance[J].Throm Haemost,2006,96(5):602-610.
[10]赵文峰,高建芝,张金盈.心肌缺血再灌注损伤时细胞凋亡的信号转导通路[J].新乡医学院学报,2015,32(4):18-22.
[11]QIN F,YAN C,PATEL R,et al.Vitamins C and E attenuate apoptosis,betaadrenergic receptor desensitization,and sarcoplasmic reticular Ca2+ATPase down-regulation after myocardial infarction[J].Free Radic Biol Med,2006,40(10):1827-4293.
[12]HOCHHAUSER E,CHEPORKO Y,YASOVICH N,et al.Bax deficiency reduces infarct size and improves long-term function after myocardial infarction[J].Cell Biochem Biophys,2007,47(1): 11-20.
[13]DAS D K,MAULIK N.Mitochondrial function in cardiomyocytes:target for cardioprotection[J].Curr Opin Anaesthesiol, 2005,18(1):77-82.
[14]高夏青,薛凌.罗格列酮对兔心肌缺血再灌注所伤保护机制的研究[J].中国现代应用药学,2014,31(3):265-270.
[15]ZHANG J,LI X X,BIAN H J,et al.Inhibition of the activity of Rho-kinase reduces cardiomyocyte apoptosis in heartischemia/reperfusion via suppressing JNK mediated AIF translocation[J].Clin Chim Acta,2009,401(1-2):76-80.
[16]王峰,梁贵友,刘达兴,等.罗格列酮对心肌缺血再灌注损伤大鼠胰岛素抵抗及炎性因子、内皮素-1的影响[J].中国生化药物杂志,2014,34(9):75-77.
[17]LI Y,WU J,YAN C,et al.Correlation of PPARγ and NF-kB expression with arsentic induced hepatic fibrosis in rats[J]. World J Gastroenterol,2010,18(36):3848-3856.
[18]REN Y,SUN C,SUN Y,et al.PPAR gamma protects cardiomyocytes against oxidative stress and apoptosis via Bcl-2 upregulation[J].Vascul Pharmacol,2009,51(2/3):169-174.
(童颖丹 编辑)
Effects ofPPARgamma 1 gene transfection on apoptosis of cardiomyocytes after ischemia reperfusion
Yong-ping Liu,Lai Wei,Wen-yan Chen,Gao-yin Kong
(Department of Anesthesiology,Hunan Provincial People's Hospital, Changsha,Hunan 410005,China)
ObjectiveTo explore the effect and influence of over-expression of peroxisome proliferatoractivated receptor γ1(PPARγ1)gene on the apoptosis of myocardial cells after ischemia reperfusion.MethodsThirty SD rats were randomly divided into three groups(10 in each group),i.e.group A(sham group),group B(myocardial ischemia-reperfusion group)and group C (PPARγ1gene group).Myocardial tissues were transfected with recombinant adenovirus vector mediated enhanced green fluorescent protein (Ad-EGFP)via coronary artery in the groups A and B.Myocardial tissues were transfected with recombinant adenovirus vector mediatedPPARγ1gene(Ad-PPARγ1)in the group C.In the group A the coronary artery was crossed through with a line without ligation;while myocardial ischemia-reperfusion injury(ischemia 30 min,reperfusion 120 min) was induced in the groups B and C three days later.Under electron microscope the changes of the myocardial ultrastructures were observed.Bcl-2 and Bax expressions in the heart were detected by Western blot. TUNEL method was used to measure myocyte apoptosis.ResultsAfter ischemia and reperfusion,the cardiomyocytes in the group B were injuried most seriously under electron microscope;the myocardial fibers were arranged irregularly,ruptured and dissolved;the mitochondria were swellon with fuzzy structure and partialcristae fragmentation and dissolution.The subcellular structure damage in the group C was milder than that of the group B.Compared with the group A,Bcl-2/Bax ratio decreased significantly in the group B (P<0.05),but had no significant change in the group C (P>0.05).Compared with the group B,Bcl-2/Bax ratio in the group C increased significantly (P<0.05).The number of apoptotic cardiomyocytes in the groups B and C was significantly larger than that in the group A (P<0.05).The number of myocardial apoptosis in the group B was significantly larger than that in the group C(P<0.05).ConclusionsOver-expression ofPPARγ1gene can protect myocardial tissues from ischemia reperfusion injury by reducing oxidative stress and cell apoptosis.
myocardial ischemia-reperfusion injury;peroxisome proliferator-activated receptorγ1;cell apoptosis
R542.2
A
10.3969/j.issn.1005-8982.2017.09.005
1005-8982(2017)09-0025-05
2016-01-28
孔高茵,E-mail:konggaoyin@sina.com

