诱导化疗与巩固化疗治疗Ⅲ期NSCLC患者的疗效评价
付金平,晋发,潘巍,涂燕玲,徐乐,陈惠,张秀伟
(南京医科大学附属江宁医院 1.放疗科,2.呼吸内科,江苏 南京 211100)
诱导化疗与巩固化疗治疗Ⅲ期NSCLC患者的疗效评价
付金平1,晋发2,潘巍1,涂燕玲1,徐乐1,陈惠1,张秀伟2
(南京医科大学附属江宁医院 1.放疗科,2.呼吸内科,江苏 南京 211100)
目的探讨诱导化疗和巩固化疗联合同步放化疗对无法行手术切除的Ⅲ期非小细胞肺癌(NSCLC)患者的疗效。方法选取NSCLC患者104例,随机分为诱导化疗组与巩固化疗组,各52例。诱导化疗组患者首先接受2个周期的化疗,后给予同步放化疗;巩固化疗组患者首先接受同步放化疗,随后给予2个周期的化疗。对两组患者进行3年的随访,评价并记录两组患者的不良反应发生率、肿瘤缓解和进展情况、中位生存期和中位无进展生存期(PFS)。结果诱导化疗组与巩固化疗组患者血液系统不良反应发生率比较,差异无统计学意义(P>0.05),非血液系统不良反应中肾损伤、周围神经损伤及肺炎的发生率比较,差异无统计学意义(P>0.05),巩固化疗组的食管炎发生率较高,差异有统计学意义(P<0.05)。诱导化疗组与巩固化疗组患者完全缓解、部分缓解、维持稳定、进展率比较,差异无统计学意义(P>0.05),治疗后3年内巩固化疗组患者中位生存期与诱导化疗组比较,差异有统计学意义(P<0.05),两组患者的中位PFS比较,差异无统计学意义(P>0.05)。结论以铂类化疗药物为基础的诱导或巩固化疗联合同步放化疗治疗晚期NSCLC切实可行,相比巩固化疗,诱导化疗联合同步放化疗可能使患者具有更长的中位生存期。
肺癌,放疗,化疗,同步放化疗
约30%非小细胞肺癌(non-smallcelllungcancer,NSCLC)患者在确诊时即为不可切除的Ⅲ期病变。目前对这部分患者的标准治疗方案为以铂类化疗药为基础的化疗联合胸部放疗[1-2]。有研究表明,联合放化疗技术优于单纯的放疗,而且发现同步放化疗效果优于顺序进行的放疗和化疗[3-4]。在同步放化疗前使用诱导性化疗或在其后使用巩固性化疗可能减少肿瘤转移的发生。本文评价了接受2种治疗方案患者的缓解率、不良反应及生存期,以期比较诱导化疗和巩固化疗的疗效。
1 资料与方法
1.1 研究对象
选取2013年10月-2015年12月在南京医科大学附属江宁医院接受治疗的有组织学诊断依据的非小细胞肺癌患者104例,随机分为诱导化疗组和巩固化疗组,各52例。其中,诱导化疗组男性36例,女性16例;年龄(58.13±10.04)岁。巩固化疗组男性32例,女性30例;年龄(61.94±11.70)岁。两组患者均为ⅢAN2或ⅢB期患者,无法采用手术切除肿瘤,无胸膜或锁骨上淋巴结受累。两组各患者均满足以下条件:体能评分为0或1分,体重减轻<10%,年龄18~70岁,肝肾功能正常,造血功能正常,血红蛋白≥9.5 g/dl,肺功能指标达标(1秒用力呼气容积> 40%预计值,PaO2>60 mmHg)。所有患者未合并活动性感染,不稳定的心血管疾病,外周神经系统疾病和精神障碍。
1.2 治疗方法
1.2.1 诱导化疗组 入院后,患者首先接受2个周期的化疗,化疗方案为在第1天和第22天给予顺铂80 mg/m2和紫杉醇175 mg/m2;4周后给予同步放化疗,同步放化疗方案为同时进行的胸部放疗和每周方案化疗,化疗方案为多西他赛30 mg/m2。
1.2.2 巩固化疗组 入院后,患者接受同步放化疗,同步放化疗方案同诱导化疗组;随即给予2个周期巩固化疗,化疗方案为在第1天和第22天给予顺铂75 mg/m2和紫杉醇175 mg/m2。两组患者接受的化疗药物剂量按照患者的血细胞计数、神经毒性及肾功能状态进行调整。
1.2.3 放疗方法 患者接受三维立体适形放疗技术,每天2 Gy剂量照射原发灶和受累淋巴结,每周5 d,共6.5周,33次总剂量为66 Gy。计划靶区为大体肿瘤体积(gross tumor volume,GTV)加上边缘1.5 cm的区域,不包括预防性淋巴结照射。对于诱导化疗有效而肿瘤体积减少的患者,GTV选取为诱导化疗前的肿瘤体积,对脊髓区域任何部位的最大照射剂量≤46 Gy。参考剂量体积直方图预防肺损伤,V20,V30≤30%,20%的总肺体积。放疗过程中,因放疗相关损伤而被迫中断放疗>14 d的患者退出本研究,但仍参与生存分析。两组中食管炎>1级的患者接受药物治疗。
1.3 评价指标
所有患者在治疗前后均接受实验室检查、胸片、纤维支气管镜、胸部与脑部、腹部CT平扫、骨扫描、肺功能测定。治疗过程中每周检测全血细胞计数,在每个化疗周期和同步放化疗过程中,每周对患者肿瘤和治疗相关临床症状进行评价。
在全部治疗结束8周后,采用实体瘤的反应评价标准(response evaluation criteria in solid tumors,RECIST)评价两组患者的完全缓解、部分缓解、维持稳定及进展人数。在治疗后的3年内,对所有患者进行电话随访。如有患者死亡,记录死亡时间;如有患者失访,记录最后一次与患者联系时间;记录两组患者中位生存期和中位无进展生存期。其中无进展生存期定义为随机化至第1次肿瘤进展事件的间隔时间(局部或远处进展或死亡);评价并记录各患者放化疗的不良反应,不良反应分级参照美国国立癌症所的通用毒性判定标准V2.0(>3级为不良反应)和肿瘤放疗工作组表进行评价;放射损伤分级按照LENT-SOMA评分系统评分[5-6]。
1.4 统计学方法
数据分析采用SPSS 17.0统计软件,计量资料以均数±标准差(±s)表示,用t检验;计数资料以率(%)表示,用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 基本资料
诱导化疗组患者的年龄、性别、肿瘤组织学分型、肿瘤分期与巩固化疗组比较,经t或χ2检验,差异无统计学意义(P>0.05)。见表1。
2.2 两组患者不良反应发生率比较
两组患者血液系统不良反应发生率比较,差异无统计学意义(P>0.05);两组非血液系统不良反应中肾损伤、周围神经损伤及肺炎的发生率比较,差异无统计学意义(P>0.05);诱导化疗组食管炎发生率为7.69%(4/52),巩固化疗组为25.00%(13/52),经χ2检验,差异有统计学意义(P<0.05),巩固化疗组食管炎发生率高于诱导化疗组。见表2。
2.3 两组患者治疗效果比较
两组患者完全缓解、部分缓解、维持稳定及进展率比较,差异无统计学意义(P>0.05),治疗后3年内两组患者中位生存期比较,经χ2检验,差异有统计学意义(P<0.05),诱导化疗组患者的中位生存期高于巩固化疗组。两组患者的中位无进展生存期比较,差异无统计学意义(P>0.05)。见表3。

表1 两组患者基本资料 (n=52)
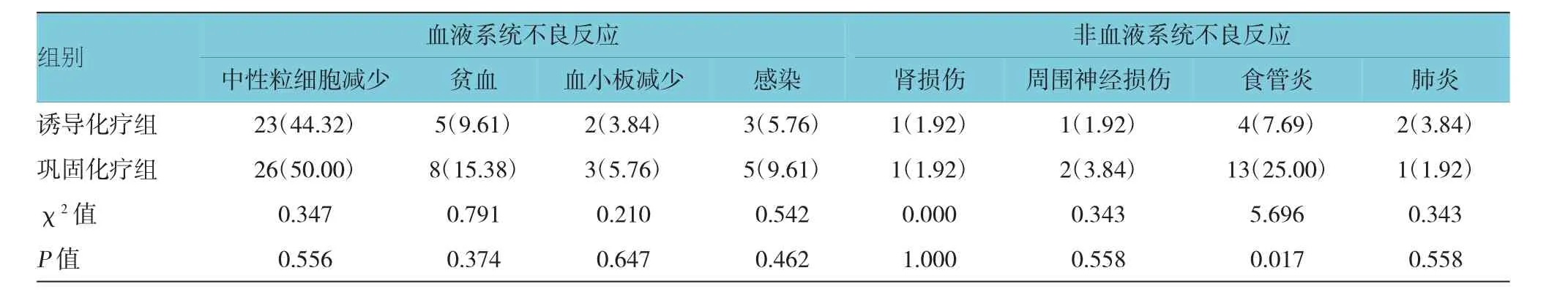
表2 两组患者不良反应发生率比较 [n=52,例(%)]

表3 两组患者治疗效果比较 (n=52)
3 讨论
NSCLC占全部肺癌患者的80%,一部分患者在确诊时已经丧失手术时机。Ⅳ期NSCLC未治者平均生存4~6个月,化疗可延长生命6~12个月。对于局部进展期NSCLC,放疗和化疗的联合治疗已成为标准疗法[7]。本实验对患者治疗后进行3年的生存期随访,发现两组中位生存期比较,差异有统计学意义,巩固化疗组患者中位生存期低于诱导化疗组。而两组中位无进展生存期比较,差异无统计学意义,这可能是因为诱导化疗可在短时期内减少肿瘤负荷,并减轻由于肿瘤引起的各种临床症状,改善血供,提高放疗敏感性所致。但有研究指出,诱导化疗方案可能因为化疗的不良反应和肿瘤进展,使患者难以继续接受随后的同步放化疗,反而使接受诱导化疗患者的生存期下降[8]。按此观点,放疗是局部进展NSCLC的主要治疗组成部分,诱导化疗的使用则需进一步商榷。
已有一些关于同步放化疗最佳时机的随机对照研究证实,某些细胞毒药物如紫杉类的多西他赛或紫杉醇与放疗联合具有互补作用[9-10]。多西他赛能够诱导肿瘤细胞发生凋亡,紫杉醇可使对放射抵抗的乏氧细胞发生再氧合。目前同时放化疗时,化疗方案大多选用紫杉醇类配合放疗进行。为消除远处微小转移灶或残存灶,给予适当周期的诱导或巩固化疗,有可能提高局部晚期NSCLC的治疗效果。大部分NSCLC患者仅采用同步放化疗显然治疗强度偏低。临床实践中更多是在该基础上加用诱导化疗2个周期或巩固化疗2个周期,以此提高治疗强度[11]。本研究采用这2种模式治疗局部晚期NSCLC患者,结果显示,诱导化疗加同步放化疗的患者在同步放化疗期间食管炎的发生率升高,与巩固化疗加同步放化疗的患者比较,差异有统计学意义,因此对食管炎和吞咽困难预防极为重要,一旦发生及时输液,给予消炎有助于局部炎症控制和及时后继治疗,此外放疗设野尽可能地减少食管受照体积或避免受照。同步放化疗的毒性不良反应在血液学方面主要表现为粒细胞、血小板和淋巴细胞减少,Ⅲ、Ⅳ级白细胞下降主要出现在化疗后2个周期,可能与治疗后程的骨髓耐受性下降有关。因此,治疗期间保证相应营养支持是非常必要。治疗期间提前使用刺激骨髓造血药物来防止白细胞下降,防止发生重度骨髓抑制。两组其他不良反应发生率比较,差异无统计学意义,这和祝沈冬[12]、GARRIDO等[13]的报道相似,提示诱导化疗与巩固化疗联合同步放化疗对NSCLC不良反应的发生率似乎没有太大的影响。
诱导化疗加同步放化疗其优点是诱导化疗后肿瘤原发肿块及转移淋巴结可能缩小,在放疗的靶区勾画相应缩小,放疗敏感肿瘤可以充分利用缩野技术提高局部剂量。同步放化疗后巩固化疗的优点在于患者处于初始的最佳生理和心理状态时,给予强度较高的同步治疗,充分利用放化疗的协同抗肿瘤效应。巩固化疗还可能会对潜在的放射范围以外亚临床灶的控制有意义,但缺点是有可能增加肺的放射性损伤,或诱发回忆性的肺放射性损伤[14]。
然而,本实验存在一些局限性,样本量过少及治疗后随访时间过短可能影响结果的准确性。综上所述,以铂类化疗药物为基础的诱导或巩固化疗联合同步放化疗治疗晚期非小细胞肺癌切实可行,诱导化疗联合同步放化疗可能使患者具有更长的中位生存期。如果进一步改进患者分期的选择,改进放疗技术和化疗药物,疗效可能更佳。
[1]CRINO L,WEDER W,van MEERBEECK J,et al.Early stage and locally advanced(non-metastatic)non-small-cell lung cancer: ESMO clinical practice guidelines for diagnosis,treatment and follow-up[J].Ann Oncol,2010,21:103-115.
[2]尹航.诱导化疗联合同步放化疗治疗Ⅲ期非小细胞肺癌的临床疗效[J].中国肿瘤临床与康复,2014,21(3):322-324.
[3]汤顾航,欧阳举.同步放化疗在局部晚期非小细胞肺癌中的研究进展[J].国际肿瘤学杂志,2015,42(11):856-859.
[4]TSUJINO K,KURATA T,YAMAMOTO S,et al.Is consolidation chemotherapy afterconcurrentchemoradiotherapy benefcialfor patientswith locally advanced nonsmall-celllung cancer? A pooled analysis of the literature[J].J Thorac Oncol,2013,8: 1181-1189.
[5]TROTTI A,BYHARDT R,STETZ J,et al.Common toxicity criteria:version 2.0 an improved reference for grading the acute effects of cancer treatment:impact on radiotherapy[J].Int J Radiat Oncol Biol Phys,2000,47:13-47.
[6]JEREMIC B.Consolidation chemotherapy after concurrent radiochemotherapy in locally advanced non-small-cell lung cancer may have been bene?cial if we only knew where it have worked[J]. J Thorac Oncol,2014,9(1),DOI:10.1097/JTO.0000000000000036.
[7]赵悦,李兴德,韩立杰,等.中晚期非小细胞肺癌同步放化疗联合DC_CIK细胞生物治疗的疗效观察[J].现代肿瘤医学,2015,23(3): 335-338.
[8]吴伟,谢传华,李金伟,等.局部晚期非小细胞肺癌同步放化疗前诱导化疗的临床研究[J].现代肿瘤医学,2014,22(12):2863-2867.
[9]BERGHMANS T,van HOUTTE P,PAESMANS M,et al.A phaseⅢ randomised study comparingconcomitant radiochemotherapy as induction versus consolidation treatment in patients with locally advanced unresectable non-small cell lung cancer[J].Lung Cancer,2009,64:187-193.
[10]陈华林,杨东红,王永存,等.培美曲塞+顺铂方案诱导化疗联合同期放化疗对局部晚期非小细胞肺癌的近期疗效及安全性观察[J].现代生物医学进展,2015,15(13):2487-2494.
[11]任维维,米登海,李征,等.非小细胞肺癌紫杉醇类联合顺铂同步或序贯放化疗对比的Meta分析[J].中华肿瘤防治杂志,2013, 20(5):377-382.
[12]祝沈冬,段宏燕,于清蕊.同步放化疗与序贯放化疗治疗Ⅲ期非小细胞肺癌的临床疗效比较[J].临床肺科杂志,2013,18(3):415-416.
[13]GARRIDO P,ROSELL R,ARELLANO A,et al.Randomized phaseⅡ trialofnon-platinum induction or consolidation chemotherapy plus concomitantchemoradiation in stage ⅢNSCLC patients:mature results ofthe spanish lung cancer group 0008 study[J].Lung Cancer,2013,81:84-90.
[14]HUBER R M,RECK M,THOMAS M.Current status of and future strategies for multimodality treatment of unresectable stageⅢ nonsmall cell lung cancer[J].Eur Respir J,2013,42:1119-1133.
(童颖丹 编辑)
Evaluation of efficiency of induction and consolidation chemotherapy for stageⅢ NSCLC
Jin-ping Fu1,Fa Jin2,Wei Pan1,Yan-ling Tu1,Le Xu1,Hui Chen1,Xiu-wei Zhang2
(1.Department of Radiotherapy;2.Department of Respiratory Diseases,Jiangning Hospital Affiliated to Nanjing Medical University,Nanjing,Jiangsu 211100,China)
ObjectiveTo evaluate the efficacy of induction and consolidation chemotherapy combined with concurrent chemoradiation on stageⅢ NSCLC.MethodsA total of 104 patients with NSCLC were divided into induction group and consolidation group,each group included 52 patients.The patients in the induction group
induction chemotherapy while the patients in the consolidation group received concurrent chemoradiotherapy followed by consolidation chemotherapy.Then the patients were followed up for 3 years. The incidence of adverse events,tumor remission and progressive rate,median survival time and median progression free survival (PFS)time were recorded.ResultsThe incidences of adverse reactions of blood system,renal injury,peripheral nerve injury and pneumonia were similar between the two groups (P>0.05); the incidence of esophagitis in the consolidation group was higher than that in the induction group(P<0.05). The rates of complete remission,partial remission,maintenance of stability and progression were similar between the two groups (P>0.05).The median survival time within 3 years after treatment in the induction group was shorter than that in the consolidation group (P<0.05),while the median PFS time was similar between the two groups (P>0.05).ConclusionsCisplatin-based chemotherapy as induction or consolidation with concurrent chemoradiotherapy can be feasible for patients with stageⅢ NSCLC.Induction chemotherapycombined with concurrentchemoradiotherapymayresultin longermedian survivaltimecompared with consolidation chemotherapy combined with concurrent chemoradiotherapy.
lung cancer,radiotherapy,chemotherapy,concurrent chemoradiotherapy
R734.2
A
10.3969/j.issn.1005-8982.2017.09.027
1005-8982(2017)09-0125-04
2016-08-08
陈惠,E-mail:chui.315@163.com;Tel:13584073159

