正常和子痫前期孕妇氧化应激指标上限值的临床研究
王 娟,李引弟,李 华,黄娟娟,张利平
(延安大学附属医院产科,陕西 延安 716000)
正常和子痫前期孕妇氧化应激指标上限值的临床研究
王 娟,李引弟,李 华,黄娟娟,张利平
(延安大学附属医院产科,陕西 延安 716000)
目的 评估正常妊娠和妊娠期高血压疾病(子痫前期)初产妇妊娠期间的氧化应激。方法 选择2012年3月至2013年7月在延安大学附属医院孕期检查的105例患者分为三组,其中A组为非妊娠女性(n=35),B组为正常血压的初产妇(n=35),C组为子痫前期初产妇(n=35);对采取的血标本分别测定丙二醛(MDA)、超氧化物歧化酶(SOD)、总抗氧化能力(TAC)和尿酸(UA)水平。结果 正常妊娠孕妇MDA、SOD和UA水平与非妊娠女性相比显著增加(P<0.05);子痫前期孕妇MDA(q=15.691,P<0.001)、SOD(q=4.060,P=0.033)和UA(q=12.095,P=0.001)水平与正常妊娠孕妇相比很大程度增加;正常妊娠孕妇在TAC水平与非妊娠女性相比显著降低(q=3.310,P=0.031),子痫前期孕妇较正常妊娠孕妇有更低的TAC水平(q=6.983,P=0.010);多因素分析显示MDA、SOD、TAC和UA水平是影响子痫前期发生风险的显著性因素(P<0.05);MDA值为7.89μmol/L可以作为预测子痫前期症状发生的临界值,其敏感性为76.74%,特异度为74.82%。结论 氧化应激是子痫前期发病的高风险因素,应尽可能的避免可导致氧化应激增强的危险因素。
氧化应激,妊娠,初产妇,高血压,子痫前期
子痫前期是指孕前血压正常的孕妇在怀孕20周后出现高血压和蛋白尿等症状[1],也是导致产妇、新生儿和胎儿的高死亡率和高发病率的重要因素[2-3]。孕妇在妊娠期间随着对氧需求量的增加,生成活性氧簇(reactive oxygen species,ROS)产物量也随之增加,即使正常妊娠的孕妇与非妊娠女性相比也具有较高水平的氧化应激和脂质过氧化反应水平[4]。子痫前期孕妇其因氧化应激增加导致脂质过氧化、ROS和超氧阴离子自由基产物的增加,进而引发内皮细胞受损和功能紊乱(如血小板和中性粒细胞的激活)[5-6]。本研究通过测定正常妊娠孕妇和子痫前期孕妇的丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、总抗氧化能力(total anti-oxidant capacity,TAC)和尿酸(uric acid,UA)水平,以评估上述指标对子痫前期影响,现将结果报告如下。
1 资料和方法
1.1 一般资料
选择2012年3月至2013年7月在延安大学附属医院进行体检和妊娠期检查的女性,纳入标准:①单胎初产妊娠;②孕前BMI≤24kg/m2;③孕周的计算结合末次月经时间、早孕反应时间和胎动出现时间及超声诊断等方式确诊;④无畸形胎儿;⑤孕妇无慢性高血压贫血及其他心血管疾病史,孕期产前检查肝肾功能均正常;⑥子痫前期确诊前均无服用高血压药及心血管药物史;⑦临床资料完整。排除多胎妊娠,近期有急性感染及合并妊娠合并肾脏疾病,妊娠糖尿病,胎儿畸形者。子痫前期的诊断标准参照全国统编教材《妇产科学》[7],结合上述纳入和排除标准纳入正常血压的初产妇35例(B组)和子痫前期的初产妇35例(C组),同时纳入35例体检健康的非妊娠期女性最为对照组(A组)。所有研究对象均签署知情同意书,本研究经过医院伦理道德委员会审核通过。
1.2氧化应激检测
肘前静脉采血6mL,将血标本收集在肝素化抗凝管中;血样置于离心机中,3 000rpm离心10min,收集血清进行下一步的生化分析。
血清中MDA (南京建成生物工程研究所)的测定采用硫代巴比妥酸反应物(thiobarbituric acid-reactive substances,TBARS)的方法;SOD(南京建成生物工程研究)的测定按照试剂盒说明书采用黄嘌呤氧化酶法。TAC(碧云天生物技术研究所)的测定按照试剂盒说明书采用亚铁还原能力(fluoride-resistant acid phosphatase,FRAP)法进行测定,UA(宁波亚太生物技术有限责任公司)的测定按照试剂盒说明书采用Uricase-PAP法。通过 INFINITE M 200 酶标仪检测。每份血清标本均检测3次,取平均值。
1.3统计学方法

2结果
2.1三组初产妇的基本信息比较
三组初产妇基本信息比较无显著性差异(均P>0.05),见表1。
2.2 三组初产妇MDA、SOD、TAC和UA水平比较
正常血压初产妇的MDA(q=5.773,P=0.013)、SOD(q=8.982,P=0.009)和UA(q=3.845,P=0.024)水平显著性高于非妊娠女性,而TAC水平显著低于非妊娠女性(q=3.310,P=0.031);子痫前期初产妇的MDA(q=15.691,P<0.001)、SOD (q=4.060,P=0.033)和UA(q=12.095,P=0.001)水平显著性高于正常血压初产妇(P<0.010),而TAC水平显著低于正常血压初产妇(q=6.983,P=0.010),见表2。

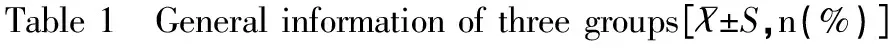
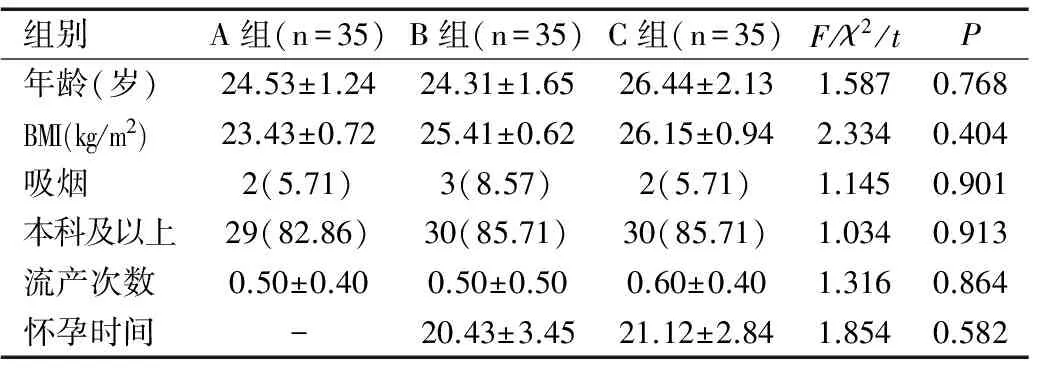
组别A组(n=35)B组(n=35)C组(n=35)F/χ2/tP年龄(岁)24.53±1.2424.31±1.6526.44±2.131.5870.768BMI(kg/m2)23.43±0.7225.41±0.6226.15±0.942.3340.404吸烟2(5.71)3(8.57)2(5.71)1.1450.901本科及以上29(82.86)30(85.71)30(85.71)1.0340.913流产次数0.50±0.400.50±0.500.60±0.401.3160.864怀孕时间-20.43±3.4521.12±2.841.8540.582
2.3子痫前期发生风险的多因素分析
多因素回归分析显示,MDA、SOD、TAC和UA是影响子痫前期发生风险显著性因素(P<0.05);而BMI、怀孕时间、吸烟史和流产次数并不是子痫前期的发生风险的显著性影响因素(P>0.05),详见表3。


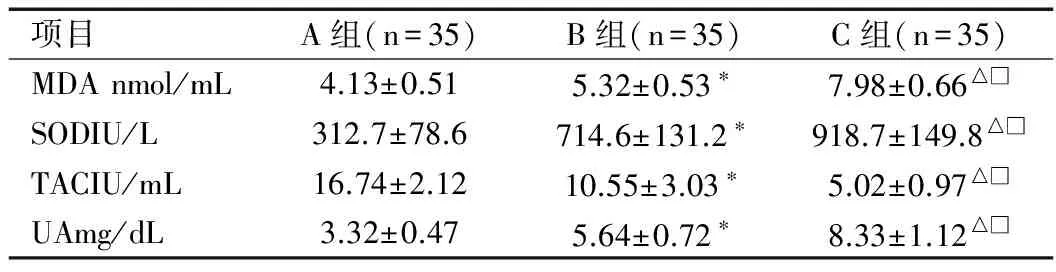
项目A组(n=35)B组(n=35)C组(n=35)MDAnmol/mL4.13±0.515.32±0.53∗7.98±0.66△□SODIU/L312.7±78.6714.6±131.2∗918.7±149.8△□TACIU/mL16.74±2.1210.55±3.03∗5.02±0.97△□UAmg/dL3.32±0.475.64±0.72∗8.33±1.12△□
注:*A组vs B组P<0.05;△A组vs C组P<0.05;□B组vs C组P<0.05。

表3 多因素分析子痫前期风险的影响变量
2.4 MDA预测子痫前期的临界值
采用ROC曲线分析MDA在预测子痫前期发生风险的临界值,其ROC曲线下面积为0.764(95%CI:0.504~0.923),MDA值为7.89 μmol/L可以作为预测子痫前期发生风险的临界值,其敏感性为76.74%,特异度为74.82%,见图1。

图1 MDA对子痫前期预测的ROC曲线分析
Fig.1 ROC curve analysis of MDA for prediction of preeclampsia
3 讨论
3.1 氧化应激指标MDA水平对子痫前期的预测作用
MDA是脂质过氧化反应的产物,氧化剂通过破坏多不饱和脂肪酸的双键而形成过氧化反应产物MDA,因此MDA水平可以作为氧化应激的间接指标[8-9]。先前的研究表明妊娠女性与非妊娠女性相比其MDA水平显著性增加[10],子痫前期孕妇血清中MDA的浓度也显著性的高于非妊娠女性[11],上述的研究结果也与我们的研究结果相一致;子痫前期孕妇与正常孕妇相比其血浆和胎盘中有更高的MDA水平,MDA水平也随着子痫前期的严重程度增加而增加[8]。因此,MDA可以作为一个重要的氧化应激指标以预测子痫前期发生风险,本研究结果表明MDA值为7.89 μmol/L可以作为预测子痫前期症状发生风险的临界值,其敏感性为76.74%,特异度为74.82%。
3.2其它指标(SOD、TAC和UA)对子痫前期的影响
本研究还发现妊娠期间SOD的活性显著性增加,早期的研究发现妊娠晚期SOD水平明显高于非妊娠女性[9],SOD活性水平也与子痫前期症状的程度有关[12]。这也与本研究结果相类似。本研究同时并未对不同妊娠时期和不同子痫前期程度的初产妇的氧化应激进行分层分析,但是根据之前的研究结果提示随着妊娠期时间的变化和子痫前期程度的增加MDA水平和SOD水平显著性增加的[10-11]。
妊娠期间TAC的减少可以作为增加氧化剂的消耗或者降低氧化剂的生成重要指标。正常妊娠期孕妇与子痫前期孕妇相比TAC水平呈现急剧性的下降。相关的研究也显示怀孕30周的孕妇TAC水平明显的低于非妊娠女性[10],TAC水平的显著性降低可以作为非酶类抗氧化剂(维生素E、A和C)水平降低的指标。本研究结果也显示,子痫前期孕妇的TAC水平明显的低于正常妊娠女性和非妊娠女性,同时TAC水平降低会增加孕妇子痫前期的发生风险。子痫前期孕妇和正常血压孕妇相比,其血清中总的抗氧化活性和谷胱甘肽水平的均降低,这也与本研究中TAC水平的变化相类似。本研究虽未对子痫前期患者后期的妊娠结局和新生儿的结局进行分析,但根据Namdev等[8]研究结果表明氧化应激和总抗氧化能力可以作为预测子痫前期孕妇新生儿临床结局的重要预测因素。
根据血浆中UA水平评估的结果显示妊娠期间UA水平呈现增加的趋势,并且尤其在子痫前期的妊娠期女性增加的更为明显。子痫前期UA的增加可引起胎盘的局部缺血或者损伤,随之增加ROS产物进而导致过度的核苷酸代谢,进而影响妊娠结局和围产儿预后[13-14]。
[1]Bilano V L,Ota E,Ganchimeg T,etal.Risk factors of pre-eclampsia/eclampsia and its adverse outcomes in low- and middle-income countries:a WHO secondary analysis[J].PLoS One,2014,9(3):e91198.
[2]Shah D A,Khalil R A.Bioactive factors in uteroplacental and systemic circulation link placental ischemia to generalized vascular dysfunction in hypertensive pregnancy and preeclampsia[J].Biochem Pharmacol,2015,95(4):211-226.
[3]Schena F P,Thomas W,Griffiths M,etal.Pre-eclampsia before 20-week gestation: diagnosis, investigation and management[J].Clin Kidney J,2012,5(6):597-599.
[4]程波,杨帆,何荣霞.子痫前期血浆网膜素水平与脂代谢的相关性研究[J].中国妇幼健康研究,2015,26(4):703-705.
[5]de Oliveira L G,Karumanchi A,Sass N.Preeclampsia:oxidative stress,inflammation and endothelial dysfunction[J].Rev Bras Ginecol Obstet,2010,32(12):609-616.
[6]李玉芳,欧彩娟,彭丽平,等.VEGF及其受体SFLT-1水平与重度子痫前期孕妇新生儿结局的关系[J].中国妇幼健康研究,2017,28(2):134-136.
[7]谢幸,苟文丽.妇产科学[M].8版.北京:人民卫生出版社,2013:64-70.
[8]Namdev S,Bhat V,Adhisivam B,etal.Oxidative stress and antioxidant status among neonates born to mothers with pre-eclampsia and their early outcome[J].J Matern Fetal Neonatal Med,2014,27(14):1481-1484.
[9]蒋莉,杨幼林,丁佳锋.妊娠期氧化应激水平及其与泌尿系感染的关系[J].中国医师杂志,2013,15(4):490-492.
[10]Hung T H,Lo L M,Chiu T Hetal.A longitudinal study of oxidative stress and antioxidant status in women with uncomplicated pregnancies throughout gestation[J].Reprod Sci,2010,17(4):401-409.
[11]李爱金,章伟丽,陈再玲,等.子痫前期胎盘组织氧化应激和炎症反应状态及与新生儿预后的关系[J].实用医学杂志,2013,29(20):3365-3367.
[12]张玢琪,程蔚蔚.子痫前期预防及治疗研究进展[J].中国妇幼健康研究,2016,27(3):406-408.
[13]陈杨,陈敏,周金财,等.妊娠高血压疾病母血及脐血神经功能及抗氧化能力相关指标的变化[J].海南医学院学报,2014,20(7):964-966.
[14]张彦玲,牛媛媛,申建梅.子痫前期患者血尿酸尿素氮及肌酐测定及临床分析[J].山西医药杂志(下半月版),2012,41(22):1154-1155.
[专业责任编辑:于学文]
Clinical study on levels of upper limit of oxidative stress markers between preeclampsia and normal pregnant women
WANG Juan, LI Yin-di, LI Hua, HUANG Juan-juan, ZHANG Li-ping
(DepartmentofObstetrics,HospitalofYan’anUniversity,ShaanxiYan’an716000,China)
Objective To assess the oxidative stress during uncomplicated pregnancy and pregnancy associated with hypertension in primipara. Methods A total of 105 women were enrolled and divided into 3 groups, group A of healthy non-pregnant women (n=35), group B of primipara with normal blood pressure (n=35) and group C of preeclamptic primipara (n=35). Blood samples were analyzed for levels of malondialdehyde (MDA), superoxide dismutase (SOD), total anti-oxidant capacity (TAC) and uric acid (UA) using appropriate biochemical methods. Results The levels of MDA, SOD and UA increased significantly in pregnant women compared to non-pregnant women (P<0.05) and to a greater extent in preeclampsia women compared to normal pregnant women(qMDA=15.691,P<0.001), (qSOD=4.060,P=0.033) and(qUA=12.095,P=0.001). TAC levels were significantly decreased in pregnant women when compared to non-pregnant women (q=3.310,P=0.031), and it was lower in preeclampsia women than in normal pregnant women (q=6.983,P=0.010). Multiple-factors analysis showed that MDA, SOD, TAC and UA were the significant risk factors of preeclampsia (P<0.05). An MDA value of 7.89μmol/L could be used as a cut-off value to predict preeclampsia symptoms, and the sensitivity was 76.74% and specificity was 74.82%. Conclusion Oxidative stress is the high-risk factor of pathogenesis of preeclampsia. Risk factors which may cause oxidative stress should be avoided.
oxidative stress; pregnancy; primipara; hypertension; preeclampsia
2016-11-04
王 娟(1983-),女,主治医师,主要从事妇产科疑难病症诊断和治疗工作。
张利平,副主任医师
10.3969/j.issn.1673-5293.2017.04.016
R714.24
A
1673-5293(2017)04-0411-03

