浅谈氢氧化亚铁实验的改进与创新
叶子
摘 要:利用碘元素的氧化方法获取亚铁状离子,在较弱碱性环境下制取Fe(OH)2,强化课堂教学实验品质。其实验器具及原料包括还原型铁粉,晶状碘固体,氨化合物与氯化铵组成的缓冲型溶液,离心型玻璃试管,小型玻璃试管,盛药勺匙,长型胶状滴定管。
关键词:制备手段 氢氧化亚铁 氧化过程 灰绿色晶体 白色絮状析出物
中图分类号:G634 文献标识码:A 文章编号:1674-098X(2017)03(a)-0245-02
1 问题的构建
Fe(OH)2产品的制作试验过程中白色状态的Fe(OH)2要逐步转换成灰绿色状态的Fe(OH)3,让同学们误以为Fe(OH)2的本体颜色是属于灰绿色状态。现有很多科研人士均由排出氧气的方式对此试验实施了优化过程。
其中的一种情况是把烧碱溶液用酒精灯加热达到煮沸状态从而除掉其溶液中所含有的溶解态氧分子。这种措施会产生相当的净化掉溶液中溶解态氧的效果,然而仅利用煮沸过程不可能把溶解态的氧整体清除干净,因此白色状态的沉淀物可存在的时间必然长一些,但是其也只有数分钟的时间。
另一种方法是选取洋油、石蜡型油等油质物对这一反应装置实施液体封闭。因为在反应过程中其反应介质体系不能够和外部大气产生接触情况,即可在一定程度上缓解Fe(OH)3被氧化作用的速度。最为常用的一种改进方式通常是把此几类思考路径实施融合,把他们各自的反应优势实施匹配,从而实现最好的除氧品质,减低氧化幅度。然而此类实验工艺改进过程都不能实现最佳的试验效果,其白色状态沉淀物留存时间依然很短暂。
另外也有一种是依托离心分离工艺来最大限度地净化反应系统中所溶解了的氧气成分。通常运用在试管内产生的氢氧化亚铁来除掉烧碱、绿矾溶液中所溶解状态的氧。第一是在已出现氢氧化亚铁沉淀物的玻璃试管内放入过剩烧碱溶液,依靠氫氧化亚铁胶体物质来除去烧碱溶液中的溶解状态氧;再有就是亦在已出现氢氧化亚铁胶体沉淀物的玻璃试管内放入过剩的硫酸溶液。依托氢氧化亚铁除掉硫酸铁溶液中所含的溶解状态的氧。尔后取两种溶液进行彼此滴定过程,如此处置之后所生成的氢氧化亚铁总体上是处在无氧成份液态条件中,故其不容易受到氧化作用,其白色状态的沉淀的延续时间最高能维持到2 h之上。然而实施如此改进的最大不足之处即在于其操作过程繁杂,不容易在教学课堂上进行实验的演示过程,从而失去它的真正价值。
基于前述多类优化手段,笔者亦由降低氧气生成量的思想去考虑,依照煮沸办法从而除去溶液中溶解态的氧,并且把横断面积低于玻璃试管横截面积的软胶管当作反应器皿,以降低反应过程中所可能接触到的氧气成分。在此基础上,亦变更了反应进行模式,利用二价铁离子和碳酸氢根离子的复水解反应以制出CO2并排放O2,从而加大白色状态沉淀的留存时间。而且因为此反应过程机理是复合型水解反应,且其反应始终处在动态转化过程之中,其受外界的干扰程度很小。利用透明型软胶管把该实验实施小型化规模设计,缩短了试验流程,提高了实验过程的情趣性,可大力促进课堂型实验过程的操作及实验效果的观注。
2 实验机理研究
2.1 实验任务
依托碘被氧化的方法获取二价铁离子,在低碱性环境下生成Fe(OH)2,强化课堂中的试验示范品质。
2.2 实验器具及材料
还原型精细铁粉,固体状碘,氨化合物一氯化铁双组份缓冲液体,离心型玻璃试管,小型玻璃试管,盛药勺匙,长胶头型滴定管。
2.3 实验装置
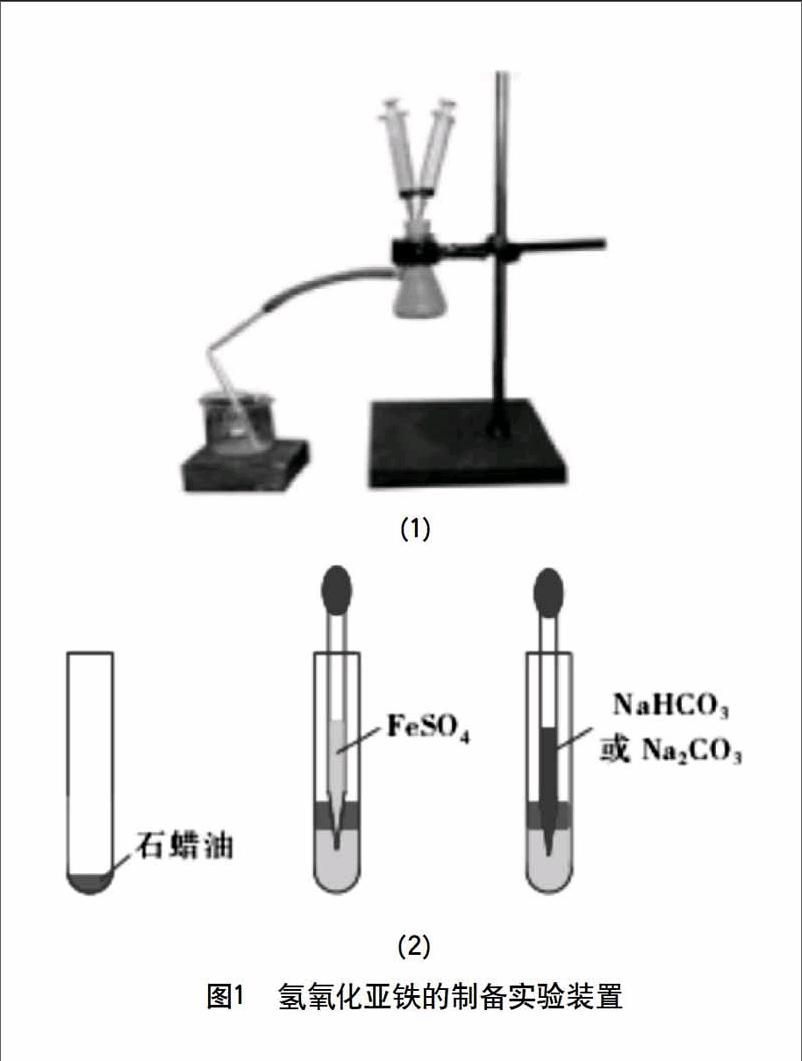
在试管中加入石蜡油进行液封,用胶头滴管直接将FeSO4溶液注入石蜡油下部,再用另一胶头滴管直接将NaHCO3或Na2CO3溶液注入FeSO4溶液中,以此避免氧气的进入。见图1。
2.4 实验程序
(1)在装有2 g固体碘的玻璃试管内,放人4 g还原型精细铁粉,让其覆盖在固体态碘上,压入4 mL经过煮沸并进行冷却之后的凉蒸馏水,等反应完全之后充分振荡此玻璃试管,静态放置一段时间,就可获取浅绿色状态的碘化亚铁盐类溶液。
(2)在离心型玻璃试管中放入4 mL利用经煮沸过的纯净蒸馏水调配的氨分子-氯化铁双组分缓冲型液体物质。
(3)利用长胶头型滴定管吸入适量碘化亚铁盐类溶液,把其尖嘴部位插进氨-氯化铁双组份缓冲型液体中的液面之下,缓慢用手挤住胶头,就能观察到在其尖嘴部位会产生并析出白色絮状物沉淀。
2.5 问题解释
(1)此试验过程是利用固体碘的氧化方法制取碘化亚铁盐类物质,并取代过去的利用硫酸溶液和铁单质进行化学反应来制取硫酸亚铁这一强酸弱碱盐,因为碘离子本身所具备的极强还原性,所以碘化亚铁这种盐类物质能静置很长时间而不产生氧化过程,从而让实验过程简单便捷。
(2)由于二价铁离子在溶液酸碱性pH=7.7上下时即可呈现Fe(OH)2胶状形态的沉淀由溶液中析出,因此pH过大或过小都无助于Fe(OH)2的制备过程,使用氨-氯化铁缓冲溶液便于将pH控制在弱碱性条件下,而且使用缓冲溶液可以控制其稳定在一个比较小的范围内。
(3)利用这种方法制备的氢氧化亚铁沉淀白色可保持1~2个小时,若用特殊方法处理(例如:加液体石蜡液封)白色可保持42个小时,将氢氧化亚铁沉淀上层清液倒出,加人自来水,白色沉淀很快变为灰绿色,最终变为红褐色。
3 实验注意事项
(1)FeSO4溶液中加入少量还原铁粉,防止实验过程中被氧化,避免溶液中产生Fe3+。
(2)NaHCO3溶液加热时要注意温度,尽可能将溶解氧除去,但是要避免沸腾再次溶入氧气。
(3)注射溶液时注意速度,避免从另一管口溢出。
4 实验创新点
(1)使用双水解的原理,将反应维持在动态平衡中,延长了白色沉淀的稳定时间,克服了这个实验的最大难点,同时也便于学生观察现象。
(2)加热NaHCO3溶液除去溶解氧,直接将FeSO4溶液注入NaHCO3溶液中部,省去液封这一步骤,简化了实验。
(3)反应生成的二氧化碳将氧气排出软管,减少并延缓产物Fe(OH)2被氧化。
(4)可以将该实验用于双水解的知识新授课。
参考文献
[1] 汤国柱.专题十四 氢氧化亚铁制备[J].广东教育:高中版,2015(11):183.
[2] 穆新巧.制备氢氧化亚铁实验的改进[J].教学仪器与实验,2007(10):69-70.
[3] 谢国仪.氢氧化亚铁的制备和保存[J].中学化学教学参考,1991(5):110.
[4] 宣文权,金淑泓.氢氧化亚铁制备实验的改进[J].化学教学,2002(4):172-173.

