JNK2、TIMP-1及CollagenⅢ在胆道闭锁肝纤维化中的作用研究
高 婷詹江华陈 扬张爱华卫园园
胆道闭锁与肝移植专题·论著·
JNK2、TIMP-1及CollagenⅢ在胆道闭锁肝纤维化中的作用研究
高 婷1詹江华2陈 扬1张爱华2卫园园1
目的 研究c—Jun氨基末端激酶2(c—Jun N-terminal kinase,JNK2)、金属蛋白酶组织抑制剂—1(tissue inhibitor ofmetalloproteinase 1,TIMP—1)及CollagenⅢ在胆道闭锁(BA)肝组织中的表达情况及在肝纤维化进程中的作用。 方法 选取胆管扩张症肝活检病例10例,为胆扩组;BA肝活检病例15例,为BA组;BA晚期因肝功能衰竭而行肝移植患者自体肝活检10例,为肝移植组。采用HE染色观察并评价肝标本纤维化程度;免疫组化染色检测JNK2、TIMP—1及CollagenⅢ在肝组织中的表达;实时荧光定量聚合酶链式反应(qRT—PCR)检测肝组织中JNK2、TIMP—1及CollagenⅢ基因表达情况。 结果 ①HE染色:胆扩组偶可见少许纤维细胞增生;BA组汇管区增宽,纤维组织增生、桥接纤维化现象普遍,可见假小叶形成;肝移植组汇管区明显增宽,纤维组织增生较重,广泛桥接纤维组织形成,假小叶显著。②免疫组化:胆扩组JNK2、TIMP—1及CollagenⅢ表达为弱阳性,BA组及肝移植组JNK2、TIMP—1及CollagenⅢ蛋白均在肝细胞、汇管区胆管上皮细胞及血管内皮细胞胞质中阳性表达。③半定量分析:三组JNK2(0.122±0.008、0.182±0.017和0.198±0.033),TIMP—1(0.123±0.009、0.185±0.012和0.201±0.017)和CollagenⅢ(0.126±0.012、0.194±0.008和0.208±0.033)表达比较,差异有显著统计学意义(P<0.001);三组中,BA组及肝移植组JNK2、TIMP-1及CollagenⅢ表达明显高于胆扩组(P<0.05);肝移植组JNK2、TIMP—1及CollagenⅢ蛋白含量与BA组比较,差异无统计学意义(P值均>0.05)。④qRT—PCR:三组JNK2、TIMP—1和CollagenⅢmRNA表达水平比较,差异有统计学意义(0.221(0.17)vs 1.395(1.22)vs 1.095(1.21),H=17.686,P=0.003;0.439(0.31)vs 1.404(0.85)vs 1.571(0.66),H=20.648,P=0.000;0.917(0.09)vs1.802(1.35)vs1.957(1.30),H=15.555,P=0.007),BA组及肝移植组肝内JNK2、TIMP—1及CollagenⅢmRNA表达含量比胆扩组高(P值均小于0.017)。 结论 JNK2、TIMP—1及CollagenⅢ在BA患儿随着肝纤维化加重而表达升高,表明其可能参与并促进BA肝纤维化进程。
胆道闭锁;肝硬化;转化生长因子β1;免疫组织化学
胆道闭锁(biliary atresia,BA)是危及婴幼儿生命的肝胆系统疾病之一,以肝内外胆管进行性炎症、纤维性梗阻及胆汁淤积为特点,导致进行性肝纤维化和肝硬化,是婴幼儿时期肝移植的主要指征[1-2]。BA患儿早期行Kasai手术虽能缓解胆汁淤积症状,但仍有2/3的患儿肝纤维化继续进展,最终发展成为肝硬化[3]。有研究证实转化生长因子—β1(transforming growth factor—β1,TGF—β1)蛋白能够调节机体细胞生长、分化、凋亡,TGF-β1/Smads促纤维化通路在BA肝纤维化进程中起重要作用[4];而c—Jun氨基末端激酶2(c-Jun N—terminal kinase,JNK2)对Smad 2/3蛋白磷酸化等起重要作用[5];有研究证实基质金属蛋白酶抑制因子-1(tissue inhibitors ofmetalloproteinase—1,TIMP—1)参与肝纤维化过程中的组织重塑,与肝纤维化程度密切相关[6];而CollagenⅢ作为TGF—β1信号通路产物,已被证实在动物模型肝纤维化中表达增多[7]。但以上三种蛋白在BA肝组织中不同纤维化时期表达情况尚不十分清晰,本研究旨在检测JNK2、TIMP—1及CollagenⅢ三种蛋白在BA患儿肝组织中的表达情况,并探讨其在BA患儿肝纤维化发展过程中的作用机制。
材料与方法
一、标本来源与分组
本研究收集2014年1月至2016年10月入住天津市儿童医院且确诊为胆管扩张症的患儿10例(为胆扩组),其中男性4例,女性6例,日龄248~2 123 d,平均(1 032±595)d;BA患儿15例(为BA组),其中男性7例,女性8例,日龄19~95 d,平均(54±18)d。另外收集2013年1月至2016年10月在天津市第一中心医院行肝移植的患儿(均已行Kasai手术,后因肝功能衰竭行肝移植)10例(为肝移植组),其中男性6例,女性4例,日龄219~2 176 d,平均(1 033±516)d。本实验均通过天津市儿童医院及天津市第一中心医院伦理委员会审查,且患儿监护人均签署了知情同意书。
二、主要试剂与仪器
TIMP—1一抗工作液,二抗(辣根过氧化物酶标记的羊抗兔聚合物)、3,3-二氨基联苯胺(3,3—diaminobenzidine,DAB)显色试剂盒,均购自北京中杉金桥生物技术有限公司。JNK2一抗(1∶200),CollagenⅢ一抗(1∶400)购自北京博奥生物技术有限公司。实时荧光定量聚合酶链式反应(qRT—PCR)引物由北京奥科生物技术有限公司设计及合成,引物序列见表2。主要仪器:IQ5实时定量PCR仪(美国Bio-Rad公司),手执式组织匀浆机(德国IKA公司)。Fast Quant RTKit(With gDNase)、TRIzol(天根生化公司),Super Real PreMix Plus(SYBR Green)。定量分析所用的ImagePro Plus 5.0自动分析系统购自美国Media Cybernetics公司。
三、实验方法
1.组织学检测:将蜡块标本连续4μm切片,分别进行HE染色及免疫组化染色。①HE染色。病理切片经二甲苯脱蜡,梯度乙醇水洗,浸染苏木素5 min,经酸化伊红乙醇液浸染2 min,梯度乙醇脱水,透明剂浸泡至透明,中性树胶封片等一系列操作,在光学显微镜下观察肝组织细胞形态、肝纤维化程度。②免疫组化染色。病理切片脱蜡至水,枸橼酸盐缓冲液进行抗原修复15 min,冷却至室温,PBS缓冲液冲洗5 min×3次,于3%H2O237℃中孵育10 min,再用PBS冲洗5 min×3次,滴加一抗(JNK2、TIMP—1及CollagenⅢ),于冰箱中4℃过夜,次日取出置于室温,PBS洗5 min×3次,加二抗于37℃下孵育30 min,PBS洗5 min×3次,经DAB显色5~10 min,镜下观察染色情况,充分水洗,苏木素液染核,脱水、透明、中性树胶封片,于低倍镜(×100)下观察染色(棕色)区域,高倍镜(×400)下辨别阳性细胞种类及表达情况。③qRT—PCR。术中取各组患儿肝右叶前缘为实验标本,置无菌EP管中储存在-80℃冰箱,依照TRIzol法研磨并提取总RNA,经反转录后,合成cDNA。PCR反应体系共20μL,其中包括上、下游引物各0.5μL,cDNA模版1μL,10μL 2×SuperReal PreMix,无酶水补足到20μL。95℃预变性15 min,95℃变性10 s,58℃退火20 s,72℃延伸32 s,扩增40个循环。分别测定样本内参(GAPDH)、JNK2、TIMP—1及CollagenⅢ的基因扩增的Ct值,每个样本重复3次,取3次结果平均值为最终Ct值;ΔCt=每个基Ct值—内参Ct;样本基因相对定量=2-ΔCt。

表1 JNK2、TIMP—1及CollagenⅢ引物序列Table 1 Base sequences of primers for qRT—PCR for JNK2,TIMP—1 and collagenⅢ
四、免疫组化结果判断免疫组化阳性标准[8]
1.定性分析:根据染色强度分为无棕黄色(阴性)、淡棕黄色(弱阳性)、棕黄色 (阳性)、棕褐色(强阳性)。
2.半定量分析:每张切片于阳性部位处取5个不同视野100倍显微镜下图片,经IPP(Image proplus)5.0分析图片计算JNK2、TIMP—1及CollagenⅢ蛋白的平均光密度值(AOD),AOD=肝组织阳性细胞光密度总和/阳性面积。
五、统计学处理
采用SPSS 15.0统计软件分析,正态分布的计量资料用均数±标准差(±s)表示,多组间比较采用方差分析,多重比较方差齐性用Bonferroni法,非齐性用Tamhane法;非正态分布的计量资料用中位数及四分位数间距[M(IQR)]表示,多组间比较使用Kruskal-Wallis H检验,多重比较用Bonferroni法进行显著性水平校正。P<0.05为差异有统计学意义。
结 果
一、HE染色结果
胆扩组肝组织标本中可见少许纤维细胞增生、少量炎症细胞;BA组肝组织标本中可见肝细胞变性,偶有坏死,炎细胞大量增生,汇管区增宽,纤维组织增生、桥接纤维化普遍,有假小叶形成;肝移植组肝组织标本中肝细胞严重变形、坏死,汇管区增宽显著,纤维组织增生较重,广泛桥接纤维化,假小叶明显(见图1)。
二、免疫组化定性分析结果
JNK2蛋白:在三组肝组织标本的肝细胞、血管内皮细胞及汇管区胆管上皮细胞胞质中均有表达,在胆扩组表达呈弱阳性,在BA组和肝移植组表达呈阳性(图2A~C);TIMP—1蛋白:在胆扩组肝组织标本的肝细胞、汇管区胆管上皮细胞及血管内皮细胞胞质中呈弱阳性表达;在BA组及肝移植组肝组织标本的肝细胞、汇管区胆管上皮细胞及血管内皮细胞胞质中呈阳性表达(图3A~C);CollagenⅢ蛋白:在胆扩组肝组织标本中,仅在血管内皮细胞、胆管上皮细胞及肝细胞胞质中有弱阳性表达,而BA组及肝移植组在以上细胞胞质中呈阳性表达(图3D~F)。
三、三种蛋白免疫组化半定量分析结果
JNK2、TIMP—1和CollagenⅢ蛋白在三组间的表达差异有统计学意义(P<0.05),两两比较发现BA组和肝移植组肝组织标本中JNK2、TIMP—1和CollagenⅢ蛋白表达水平均高于胆扩组(P<0.05),但BA组与肝移植组比较差异无统计学意义(P>

图1 各组肝组织标本肝纤维化程度比较(HE,×100),A:胆扩组;B:BA组;C:肝移植组。黄色箭头表示肝细胞空泡样变;图2 JNK2在三组肝脏组织标本中的表达情况(IHC,×100),A:JNK2在胆扩组的表达;B:JNK2在BA组的表达;C:JNK2在肝移植组的表达。黄色箭头为胆管上皮细胞、红色箭头为血管内皮细胞、绿色箭头为肝细胞; 图3 TIMP—1及CollagenⅢ在三组肝脏组织标本中的表达情况(IHC,×100),A:TIMP—1在胆扩组中的表达;B:TIMP—1在BA组的表达;C:TIMP—1在肝移植组的表达;D:CollagenⅢ在胆扩组的表达;E:CollagenⅢ在BA组的表达;F:CollagenⅢ在肝移植组的表达。黄色箭头为胆管上皮细胞、红色箭头为血管内皮细胞、绿色箭头为肝细胞Fig.1 Comparison of fibrosis extent of hepatic tissue specimens among three groups(HE,×100); Fig.2 Expression patterns of JNK2 in hepatic tissue specimens of three groups(IHC,×100); Fig.3 The expressions of TIMP-1and CollagenⅢin the liver of three groups(IHC,×100)0.05),见表2。
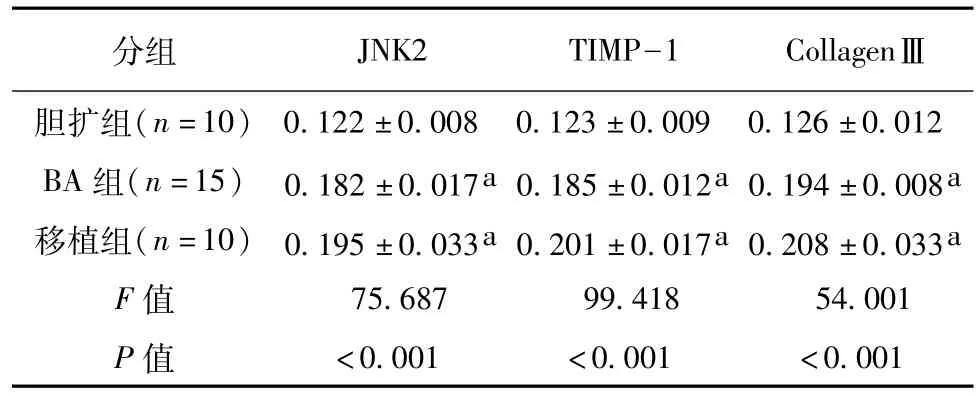
表2 三组患儿肝内JNK2、TIMP—1、CollagenⅢ蛋白半定量表达Table 2 Semi-quantitative intra-hepatic expressions of JNK2,TIMP—1 and collagenⅢin three groups
四、肝脏组织标本中JNK2、TIMP—1和CollagenⅢmRNA表达水平比较
JNK2、TIMP—1和CollagenⅢ在三组间比较差异有统计学意义(P<0.05),两两比较发现BA组及肝移植组肝组织标本中表达水平高于胆扩组(P<0.017),见表3。

表3 三组患儿中JNK2、TIMP—1,CollagenⅢmRNA相对含量比较[M(IQR)]Table 3 Comparison of expression levels of JNK2 etc.mRNA between three groups M[(IQR)]
讨 论
BA患儿以肝内外胆管梗阻,肝脏进行性炎症及纤维化为主要病理特征,早期行Kasai手术可改善胆汁淤积,但不能终止其纤维化进程[9]。已有实验研究证实TGF—β1信号通路在BA肝纤维化过程中起促进作用。在BA肝纤维化进程中,肝脏内TGF—β1信号通路经各种因子刺激下被激活,进而诱导肝细胞细胞质内的Smad 2/3磷酸化,生成磷酸化—Smad 2/3(p—Smad2/3),p—Smad 2/3与Smad 4形成络合物,并向细胞核内移动,启动细胞外基质蛋白基因转录,促进肝纤维化进程[2,10-11]。JNK2、TIMP—1及CollagenⅢ作为TGF—β1信号通路的调节蛋白及产物,在肝纤维化中的作用已有研究[5-7]。但其在BA患儿肝脏中的表达情况尚未见报道。本研究通过从蛋白水平及基因水平检测JNK2、TIMP—1及CollagenⅢ在BA肝内表达情况,探讨这几种因子在BA肝纤维化进展的作用。
一、JNK2主要参与TGF—β1信号通路相关蛋白磷酸化及核易位过程,进而促进肝纤维化进程。
JNK2是丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路中的不同亚型,Jiang Y等研究结果显示MAPK信号蛋白抑制剂通过阻断Smad 2/3磷酸化及p—Smad 2/3与Smad 4核易位,阻断Smad 2/3/4复合物形成,进而导致血浆纤溶酶原激活物抑制剂—1(Plasma plasminogen activator inhibitor—1,PAIχ21)蛋白及mRNA表达降低,提示JNK2信号蛋白参与并促进肝纤维化进程[12]。p38、ERK1/2蛋白在BA肝纤维化中的作用,已在前期研究中得到证实[13]。本研究结果显示,JNK2在BA患儿肝脏组织中肝细胞、汇管区血管内皮细胞及胆管上皮细胞胞质等中阳性表达,其表达水平较对照组明显增高,BA组JNK2免疫组化半定量及mRNA表达量均较对照组高,提示其可能在BA肝纤维化进程中起促进作用。
二、TIMP—1参与BA肝纤维化过程中的的组织重塑过程
TIMP—1由活化的肝星状细胞产生,其通过抑制基质金属蛋白酶(matrix metalloproteinases,MMPs)和通过抗细胞凋亡和增殖来影响MMP之间的相互作用,具体通过促进可溶性MMP与膜结合位点之间的相互作用,使可溶性MMP在细胞—基质界面活化,进而使细胞通过基质迁移,活化的MMP通过降解正常肝脏基质和抑制积累的纤维状胶原蛋白降解,来促进肝纤维化[6,14]。已有研究证实,在终末期肝硬化患者中,TIMP—1基因表达和血清水平上调[15]。而其在BA肝组织中的表达及与Kasai术后肝纤维化进展的关系则有不同观点。本研究结果证实,其在BA患儿肝脏组织标本中肝细胞胞质、汇管区血管内皮细胞胞质及胆管上皮细胞等呈阳性表达,其表达水平较对照组明显增高,TIMP—1mRNA表达量也较对照组高。这些实验结果表明TIMP-1可能通过抑制MMP—9等及影响MMP之间相互作用,进而有助于肝脏组织肝纤维化过程中组织重塑过程,并加速BA肝纤维化进程。
三、CollagenⅢ作为TGF—β1信号通路产物,与BA肝纤维化形成直接相关
在BA肝纤维化进展中,肝星状细胞具有关键作用,当肝组织受损后,在各种细胞因子及炎症因子作用下,激活TGF—β1信号通路,最终使肝星形细胞转换成肌成纤维细胞,使富含胶原蛋白的细胞外基质过量沉积如Collagen,发生肝纤维化[16]。Sferra R通过动物模型证实在肝纤维化过程中,α—平滑肌肌动蛋白、CollagenI—Ⅲ和结缔组织生长因子的表达增加,同时伴随着avβ6、TGFβ1、Smad 3等表达上调[7]。Suominen JS等研究证实CollagenⅠ在BA肝组织中表达较对照组高,且Kasai手术时表达量少的自体肝生存率较表达高者预后好[17]。而对于CollagenⅢ在BA的作用目前未见文献报道。本实验结果显示,在胆扩组肝组织标本中仅在血管内皮细胞、胆管上皮细胞及肝细胞胞质中有弱阳性表达;在BA组及肝移植组肝组织标本中,以上细胞胞质中呈阳性表达,且CollagenⅢ在BA组及肝移植组无论在蛋白水平还是基因水平表达均高于胆扩组。由此表明CollagenⅢ作为TGF—β1信号通路产物,在肝纤维化进程中,可能随着肝纤维化严重程度增加而持续增多,说明其在肝纤维化后期加速肝硬化进程。
综上所述,TGF—β1在BA患儿肝纤维化中起促进作用,在肝纤维化早期阶段其促进作用大于晚期肝硬化阶段。另外,JNK2、TIMP—1及CollagenⅢ在肝纤维化过程中表达明显增高,JNK2可通过影响TGF—β1信号通路蛋白磷酸化及核易位进而促进肝纤维化进程;而TIMP—1则有利于肝脏组织肝纤维化过程中组织重塑,促进肝纤维化进展;CollagenⅢ作为TGF—β1信号通路产物细胞外基质的组成部分之一,尤其是在肝硬化时期,对肝纤维化进程起直接作用。以上几种蛋白对BA肝纤维化不同时期都有相应的促进作用,在将来的研究中,是否可以通过相关抑制实验来终止或是延缓肝纤维化进程,还有待更进一步通过建立BA小鼠慢性纤维化模型行体外抑制实验来进一步研究。
1 詹江华,陈亚军.肝移植时代如何看待胆道闭锁的诊治[J].中华小儿外科杂志,2014,35(4):245—247.DOI:10.3760/cma.j.issn.0253—3006.2014.04.003. Zhan JH,Chen YJ.How to evaluate the diagnosis andmanagement ofbiliary atresia in the era of liver transplantation[J].Chin J Pediat Surg,2014,35(4):245—247.DOI:10.3760/cma.j.issn.0253—3006.2014.04.003.
2 Lampela H,Kosola S,Heikkila P,et al.Native liver histology after successful portoenterostomy in biliary atresia[J].J Clin Gastroenterol,2014,48(8):721-728.DOI:10. 1097/MCG.0000000000000013.
3 孙颖华,郑珊,钱蔷英,等.胆道闭锁Kasai术后超声随访的应用价值[J].临床小儿外科杂志,2016,15(2):144—149.DOI:10.3969/j.issn.1671—6353.2016.02.013. Sun YH,Zheng S,Qian QY,etal.Ultrasonographic followup on the children with biliary atresia after Kasai hepatoportoenterostomy[J].JClin Ped Sur,2016,15(2):144—149. Doi:10.3969/j.issn.1671—6353.2016.02.013.
4 丁美云,詹江华,赵丽,等.TGF—β1、Smad2在胆道闭锁肝纤维化中的作用[J].天津医药,2016,44(7):810—813. DOI:10.11958/20150242. Ding MY,Zhan JH,Zhao L,et al.The function of TGF—β1 and Smad2 in liver fibrosis of biliary atresia[J].Tianjin Med J,2016,44(7):810—813.DOI:10.11958/20150242.
5 JafriM,Donnelly B,McNealM,etal.MAPK signaling contributes to rotaviral-induced cholangiocyte injury and viral replication[J].Surgery,2007,142(2):192—201.DOI:10. 1016/j.surg.2007.03.008.
6 Giannandrea M,ParksWC.Diverse functions ofmatrixmetalloproteinases during fibrosis[J].Dis Model Mech,2014,7(2):193—203.DOI:10.1242/dmm.012062.
7 Sferra R,Vetuschi A,Pompili S,et al.Expression of profibrotic and anti-fibroticmolecules in dimethylnitrosamine-induced hepatic fibrosis[J].Pathol Res Pract,2016,S0344—0338(16)30641—0.DOI:10.1016/j.prp.2016.11.004.
8 姜洋,金小明,屠康.平均阳性染色面积百分比法分析免疫组化结果初探[J].生物医学工程学杂志,2007,24(3):650—653.DOI:10.3321/j.issn:1001—5515.2007. 03.039. Jiang Y,Jin XM,Tu K.A primary study using themethod of average positive stained area percentage to measure the immunohistochemistry results[J].Journal of Biomedical Engineering,2007,24(3):650—653.DOI:10.3321/j.issn:1001—5515.2007.03.039.
10 Kamato D,Burch ML,Piva TJ,et al.Transforming growth factor-βsignaling:role and consequences of Smad linker region phosphorylation[J].Cell Signal,2013,25(10):2017—2024.DOI:10.1016/j.cellsig.2013.06.001.
11 丁美云,高婷,卫园园,等.p—smad3在胆道闭锁肝纤维化中的作用机制研究[J].临床小儿外科杂志,2016,15(1):29—33.DOI:10.3969/j.issn.1671—6353.2016.01. 009. Ding MY,Gao T,Wei YY,etal.The study onmechanism of p-smad3 in hepatic fibrosis of biliary atresia[J].JClin Ped Sur,2016,15(1):29—33.DOI:10.3969/j.issn.1671—6353.2016.01.009.
12 Jiang Y,Wu C,Boye A,et al.MAPK inhibitorsmodulate Smad2/3/4 complex cyto-nuclear translocation inmyofibroblasts via Imp7/8mediation[J].Mol Cell Biochem,2015, 406(1—2):255—262.DOI:10.1007/s11010—015—2443—x.
13 高婷,詹江华,丁美云,等.整合素αvβ8、p38及ERK1/2在胆道闭锁患儿肝脏中的表达及意义[J].天津医药,2016,44(7):821—824.DOI:10.11958/20150242. Gao T,Zhan JH,Ding MY,et al.The expression and significance of integrinαvβ8、p38 and ERK1/2 in the liver of children with biliary atresia[J].Tianjin Med J,2016,44(7):821—824.DOI:10.11958/20150242.
14 Consolo M,Amoroso A,Spandidos DA,et al.Matrix metalloproteinases and their inhibitors asmarkers of inflammation and fibrosis in chronic liver disease(Review)[J].Int JMol Med,2009,24:143—152.DOI:10.3892/ijmm_ 00000217.
15 Kerola A,Lampela H,Lohi J,et al.Increased MMP—7 expression in biliary epithelium and serum underpins native liver fibrosis after successful portoenterostomy in biliary atresia[J].J Pathol Clin Res,2016,2(3):187—198. DOI:10.1002/cjp2.50.
16 Ramm GA,Nair VG,Bridle KR,etal.Contribution of hepatic parenchymal and nonparenchymal cells to hepatic fibrogenesis in biliary atresia[J].Am J Pathol,1998,153(2):527—535.DOI:10.1016/S0002—9440(10)65595—2.
17 Suominen JS,Lampela H,Heikkil P,et al.Myofibroblastic cell activation and neovascularization predict native liver survival and development of esophageal varices in biliary atresia[J].World JGastroenterol,2014,20(12):3312—3319.DOI:10.3748/wjg.v20.i12.3312.
Effects of JNK 2,TIMP—1 and collagenⅢon liver fibrosis in patients w ith biliary
atresia.Gao Ting1,Zhan Jianghua2,Chen Yang1,Zhang Aihua2,Wei Yuanyuan1.1.Graduate School,TianJin Medical University,Tianjin 300070,China;2.Municipal Pediatric Research Institute,Tianjin Children’s Hospital,Tianjin 300134,China.Corresponding author:Zhan Jianghua,E-mail:zhanjianghuatj@163.com
Objective To explore the expressions of c-Jun N-terminal kinase(JNK2),tissue inhibitor ofmetalloproteinase—1(TIMP—1)and collagenⅢin liver tissues and elucidate their functions in the process of liver fibrosis of biliary atresia(BA).M ethods Liver biopsy specimenswere collected from congenital biliary dilatation(CBD group,n=10),BA liver biopsy(BA group,n=15),BA children undergoing liver transplantation due to liver failure(liver transplantation group,n=10).Hematoxylin and eosin(HE)staining was used for evaluating the degree of liver fibrosis.And the expressions of JNK2,TIMP—1 and collagenⅢin liver tissue were detected by immunohistochemical staining.Quantitative real-time polymerase chain reaction(qRT—PCR)was used to test the gene expressions of JNK2,TIMP-1 and collagenⅢ.Results①HE staining:Fiber cell hyperplasia in CBD group;Portal area expansion,fibrous tissue proliferation,bridging fibrosis and little few pseudo lobules in Kasaigroup;Portal area becamewidened obviously,fibrous tissue proliferation was heavier,bridging fibrosis generally formed,pseudo-lobular was remarkable in liver transplantation group.②Immunohistochemistry:The expressions of JNK2,TIMP-1 and collagenⅢwere weakly positive in CBD group.The positive expression of JNK2,TIMP—1 and collagenⅢprotein in hepatocytic cytoplasm,portal area of bile ductepithelial cells and vascular endothelial cells in BA and transplantation groups.Semi-quantitative analysis:The expression levels of JNK2,TIMP—1 and collagenⅢprotein had significant differences among three groups(0.122±0.008 vs0.182±0.017 vs0.198±0.033,F=75.687,P=0.000;0.123±0.009 vs 0.185±0.012 vs 0.201±0.017,F=99.418,P=0.000;0.126±0.012 vs 0.194±0.008 vs 0.208± 0.033,F=54.001,P=0.000);BA and liver transplantation groups were significantly higher than that in CBD group(P<0.05).No significant differences existed in protein level between BA and transplantation groups(P>0.05);qRT—PCR:ThemRNA expression levels of JNK2,TIMP—1 and collagenⅢhad significant differences among three groups(0.221(0.17)vs 1.395(1.22)vs 1.095(1.21),H=17.686,p= 0.003;0.439(0.31)vs 1.404(0.85)vs 1.571(0.66),H=20.648,P=0.000;0.917(0.09)vs 1.802(1.35)vs1.957(1.30),H=15.555,P=0.007);ThemRNA expression of JNK2,TIMP-1 and collagenⅢwere higher in BA group and liver transplantation group than those of CBD group(P<0.017). Conclusions The expressions of JNK2,TIMP—1 and CollagenⅢincreased in liver of BA during fibrosis.It hints that the expressions of JNK2,TIMP—1 and collagenⅢmay promote the process of liver fibrosis in BA.
Biliary Atresia;Liver Cirrhosis;Transforming Growth Factor beta1;Immunohistochemistry
��华.胆道闭锁早期筛查现状及对策[J].天津医药,2015,43(1):1—3.
10.3969/j.issn.0253—9896.2015. 01.001. Zhan JH.The early screening and countermeasures of biliary atresia[J].Tianjin Med J,2015,43(1):1—3.DOI:10. 3969/j.issn.0253—9896.2015.01.001.
2016—02—02)
(本文编辑:王爱莲 仇 君)
高婷,詹江华,陈扬,等.JNK2、TIMP—1及CollagenⅢ在胆道闭锁肝纤维化中的作用[J].临床小儿外科杂志,2017,16(2):127-132.DOI:10.3969/j. issn.1671—6353.2017.02.006.
Citing this article as:Gao T,Zhan JH,Chen Y,et al. The effects of JNK2、TIMP—1 and CollagenⅢon liver fibrosis in patients with biliary atresia[J].J Clin Ped Sur,2017,16(2):127-132.DOI:10.3969/j.issn.1671—6353.2017.02.006.
doi:10.3969/j.issn.1671—6353.2017.02.006
1,国家自然科学基金资助项目(项目号:81570471);2,天津市卫生行业重点攻关项目(14KG129)
1,天津医科大学研究生院(天津市,300070);2,天津市儿童医院,天津市儿科研究所(天津市,300134)
詹江华,E-mail:zhanjianghuatj@163.com

