新辅助化疗前后非小细胞肺癌患者血清CA125、CEA及CYFRA21—1的变化及预后分析
龚玉芳++刘峰+++杨志胤++姜斌

[摘要] 目的 探討新辅助化疗治疗非小细胞肺癌患者的效果,并分析其对患者治疗前后血清糖类抗原125(CA125)、癌胚抗原(CEA)及细胞角蛋白19片段抗原(CYFRA21-1)水平的影响。 方法 选取2009年7月~2010年10月上海交通大学医学院附属第九人民医院收治的非小细胞肺癌患者136例,按随机数字表法将入选患者分为观察组和对照组,每组68例。两组均行手术根治术治疗,其中观察组加用GP方案新辅助化疗,对照组则未行GP方案新辅助化疗。比较分析两组临床近期疗效、不良反应、生存率,以及治疗前后CA125、CEA及CYFRA21-1水平变化。 结果 观察组患者治疗总有效率为69.1%,明显高于对照组(38.2%)(P < 0.05)。治疗前,两组CA125、CEA及CYFRA21-1水平比较,差异均无统计学意义(P > 0.05);治疗后,观察组CA125、CEA及CYFRA21-1水平均明显低于对照组(P < 0.05)。观察组不良反应发生率为7.4%,明显低于对照组(14.7%)(P < 0.05)。观察组3、5年生存率均明显高于对照组(P < 0.05)。 结论 GP方案新辅助化疗用于非小细胞肺癌患者的临床治疗具有较高的应用价值,可降低患者血清CA125、CEA及CYFRA21-1水平,提高其预后,不良反应少,值得应用及推广。
[关键词] 新辅助化疗;非小细胞肺癌;吉西他滨
[中图分类号] R734.2 [文献标识码] A [文章编号] 1673-7210(2017)04(b)-0091-04
[Abstract] Objective To discuss the clinical effect of preoperative neoadjuvant chemotherapy in the treatment of patients with non-small cell lung cancer (NSCLC), and to analyze the effects of it on the levels of serum carbohydrate antigen 125 (CA125), carcinoembryonic antigen (CEA) and cytokeratin 19 fragment antigen (CYFRA21-1) before and after treatment. Methods One hundred and thirty-six patients with NSCLC admitted to Shanghai Ninth People's Hospital Affiliated to Shanghai Jiao Tong University School of Medicine from July 2009 to October 2010 were selected, and the enrolled patients were randomly divided into observation group and control group by random number table method, with 68 cases in each group. Both groups were treated with radical surgery, the observation group was treated with GP regimen neoadjuvant chemotherapy, while the control group did not receive neoadjuvant chemotherapy with GP regimen. The clinical efficacy, adverse reactions, survival rate, and the changes of CA125, CEA and CYFRA21-1 levels before and after treatment in the two groups were compared and analyzed. Results The total effective rate of the observation group was 69.1%, which was significantly higher than that of the control group (38.2%) (P < 0.05). Before treatment, the levels of CA125, CEA and CYFRA21-1 between the two groups had no statistically significant differences (P > 0.05); after treatment, the levels of CA125, CEA and CYFRA21-1 in the observation group were significantly lower than those of control group (P < 0.05). The incidence of adverse reactions in the observation group was 7.4%, which was significantly lower than that of the control group (14.7%) (P < 0.05). The 3-year and 5-year survival rates of the observation group were significantly higher than those of the control group (P < 0.05). Conclusion Application of neoadjuvant chemotherapy with GP regimen for the clinical treatment of patients with NSCLC has relatively high value, which can decrease the levels of CA125, CEA and CYFRA21-1 of patients, improve the prognosis, with less adverse reactions, it is worthy of application and promotion.
[Key words] Neoadjuvant chemotherapy; Non small cell lung cancer; Gemcitabine
非小细胞肺癌是一种比较常见的肺癌,此病发病比较隐匿,确诊时往往处于中晚期[1]。非小细胞肺癌恶性程度比较高,病死率也高,缺少早诊断的有效方法。目前,手术根治法是治疗非小细胞肺癌的主要方法,但是手术疗法存在术中癌细胞播散、复发率高与预后不佳等缺陷[2-3]。为此,有必要积极寻找高效的非小细胞肺癌治疗方案。近些年来,许多学者对如何提升非小细胞肺癌患者预后做了比较多的探索,研究发现通过新辅助化疗可以降低术后复发率及提高预后[4-6]。GP方案新辅助化疗是一种以静脉滴注250 mL生理盐水+1000 mg/m2吉西他滨(第1、8天);静脉滴注500 mL生理盐水+30 mg/m2顺铂(第1~3天)为主的治疗方案。该方案中的吉西他滨是一种核苷酸还原酶抑制剂,具有很强的抗细胞代谢作用。该方案是上海交通大学医学院附属第九人民医院(以下简称“我院”)近些年来开展的一项手术辅助治疗方案。目前,关于GP方案新辅助化疗对非小细胞肺癌患者血清糖类抗原125(CA125)、癌胚抗原(CEA)及细胞角蛋白19片段抗原(CYFRA21-1)水平影响的研究报道尚少。本研究则主要探讨GP方案新辅助化疗治疗非小细胞肺癌的效果,并分析其对患者治疗前后血清CA125、CEA及CYFRA21-1水平的影响,以期为临床治疗非小细胞肺癌提供有益的参考。
1 资料与方法
1.1 一般资料
以2009年7月~2010年10月我院收治的非小细胞肺癌患者136例为研究对象,其中,男80例,女56例;年龄26~74岁,平均(62.5±1.6)岁;肿瘤直径<5 cm者82例,≥5 cm者54例;临床分期:Ⅲa期56例,Ⅲb期80例;组织学类型:鳞癌78例,腺癌54例,大细胞癌4例。入选标准:符合非小细胞肺癌诊断标准[7];符合非小细胞肺癌手术治疗的适应证;患者及家属知情同意本研究。排除标准:存在手术禁忌证;并发其他肿瘤疾病者;存在其他重要器官疾病者。按随机数字表法将入选患者分为观察组与对照组,每组68例。两组患者性别、年龄、肿瘤直径、临床分期及组织学类型等一般资料比较差异无统计学意义(P > 0.05),具有可比性,见表1。本研究经我院医学伦理委员会批准通过。
1.2 方法
两组均行手术切除治疗。对照组术前未行GP方案新辅助化疗。观察组术前加用GP方案新辅助化疗:第1、8天给予静脉滴注250 mL生理盐水+1000 mg/m2吉西他滨(江苏豪森药业集团有限公司,生产批号:100204),滴注时间在30 min内;在第1~3天给予静脉滴注500 mL生理盐水+30 mg/m2顺铂(云南生物谷药业股份有限公司,生产批号:051103)。每次化疗前静脉滴注250 mL生理盐水+5 mg地塞米松(白云山天星制药股份有限公司,生产批号:060402)进行止吐。连续给予2个周期的辅助化疗,合计42 d。两组术后均给予4个疗程GP方案化疗。
1.3 观察指标
①根据患者治疗情况评价两组近期疗效,疗效标准分成完全缓解、部分缓解、疾病稳定、疾病进展[8]。治疗总有效率(%)=(完全缓解+部分缓解)/总例数×100%。②比较分析两组治疗前后血清CA125、CEA及CYFRA21-1水平变化。血清CA125、CEA及CYFRA21-1水平运用酶联免疫吸附试验(ELISA)测定。③记录及分析两组患者治疗期间的不良反应发生情况。④对患者随访3~5年,比较两组患者的生存情况。
1.4 统计学方法
采用SPSS 18.0软件进行统计分析。计数资料以率表示,行χ2检验;计量资料采用均数±标准差(x±s)表示,行t检验;Kaplan-Meier计算生存率,生存率比较采用Log-Rank检验,以P < 0.05为差异有统计学意义。
2 结果
2.1 两组近期疗效比较
观察组患者治疗总有效率为69.1%,明显高于对照组(38.2%),差异有统计学意义(P < 0.05)。见表2。
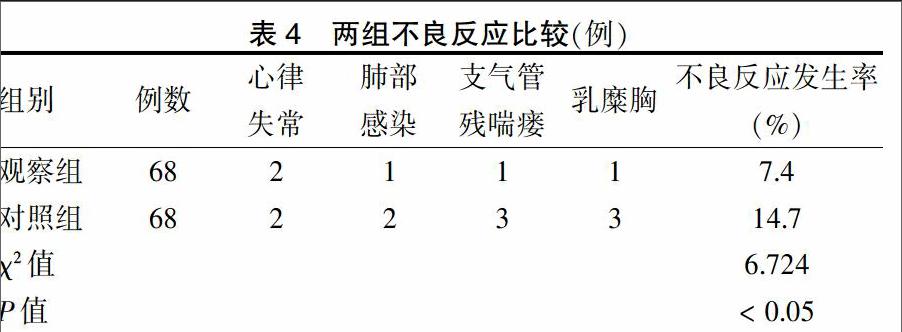
2.2 两组治疗前后CA125、CEA及CYFRA21-1水平比较
治療前,两组CA125、CEA及CYFRA21-1水平比较,差异均无统计学意义(P > 0.05);治疗后,观察组与对照组CA125、CEA及CYFRA21-1水平均较治疗前明显下降(P < 0.05),且治疗后观察组CA125、CEA及CYFRA21-1水平均明显低于对照组(P < 0.05)。见表3。
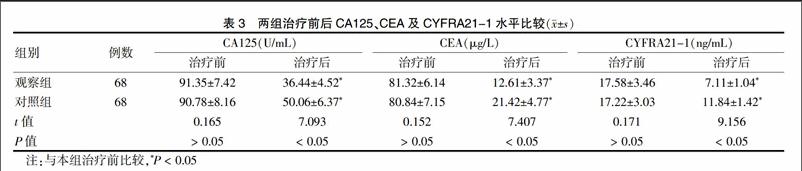
2.3 两组不良反应比较
观察组不良反应发生率为7.4%,明显低于对照组(14.7%),差异有统计学意义(P < 0.05)。见表4。
2.4 两组生存率比较
对照组中位总生存时间是27个月(95%CI:17.168~32.475),观察组中位总生存时间是36个月(95%CI:25.182~45.412),两组比较差异有统计学意义(P < 0.05),见图1。观察组3、5年生存率均明显高于对照组(P < 0.05),见表5。
3 讨论
非小细胞肺癌病情发展缓慢、症状不明显,不容易被发现,此病病死率居肺癌之首,应该给予高度重视。彻底、有效地切除病灶是治愈非小细胞肺癌的关键,但是晚期非小细胞肺癌患者仅仅接受手术治疗,难以达到理想的效果[9]。术前新辅助化疗是治疗恶性肿瘤的新方法,在临床上日益受到人们的关注及重视[10]。通过术前新辅助化疗,可以让本来不能进行手术治疗或者手术较为困难的患者在条件允许的情况下顺利实施手术切除治疗。相关研究表明,新辅助化疗属于肿瘤细胞的一种减量治疗,即通过术前新辅助化疗可以减轻患者肿瘤负荷,提升病灶的切除率。目前,恶性肿瘤的新辅助化疗方案比较多,如ECF及GP等[11-14]。这些新辅助化疗方案在临床中的治疗效果存在差异,其治疗效果一般受到恶性肿瘤的清扫范围、病情进展情况、化疗周期等多个因素的影响。GP方案是我院近些年来开展起来的一种化疗方案。相关研究表明[15-18],GP方案可以提高恶性肿瘤患者的生存期。本研究结果显示,观察组患者治疗总有效率为69.1%,明显高于对照组(38.2%)(P < 0.05),提示GP新辅助化疗方案联合手术治疗非小细胞肺癌患者的近期效果优于单纯手术治疗的效果,本研究结果与张飔雪[19]的研究结果一致。原因可能是GP方案能够缩小非小细胞肺癌体积,降低临床分期,进而提升疗效。本研究还显示,观察组不良反应发生率为7.4%,明显低于对照组(14.7%)(P < 0.05),提示GP新辅助化疗不良反应少。
CA125、CEA及CYFRA21-1是临床主要的肿瘤标志物,均参与了调控恶性肿瘤细胞的生长与繁殖等多个环节。高表达的CA125、CEA、CYFRA21-1对肿瘤的浸润及肿瘤的转移具有一定的促进作用,促进癌细胞的转移及扩散。血清中CA125、CEA及CYFRA21-1水平的表达情况可以用来评价非小细胞肺癌恶性程度与预后[20-23]。本研究结果显示,治疗前,两组CA125、CEA及CYFRA21-1水平比较差异均无统计学意义(P > 0.05);治疗后,观察组CA125、CEA及CYFRA21-1水平均明显低于对照组(P < 0.05),提示,GP新辅助化疗联合手术治疗可以有效降低患者血清CA125、CEA及CYFRA21-1水平。
对患者随访发现,观察组3、5年生存率均明显高于对照组(P < 0.05),提示,GP新辅助化疗联合手术治疗可以明显提高患者的生存率。其中本研究发现鳞癌患者的5年生存率高于非鳞癌(腺癌、大细胞癌)患者,提示GP新辅助化疗联合手术治疗在非小细胞肺鳞癌患者治疗中的长期疗效优于非鳞癌患者。原因可能是非鳞癌患者临床症状与体征不典型,难以早期明确诊断,且非鳞癌患者对化疗的敏感性不及鳞癌患者,进而导致非鳞癌患者总体预后差。本研究局限之处在于纳入的样本量较小,没有对GP新辅助化疗疗程长短进行比较研究,这可能会影响本研究结果的准确性。
综上所述,GP方案新辅助化疗用于非小细胞肺癌患者临床治疗具有比较高的应用价值,可降低患者血清CA125、CEA及CYFRA21-1水平,提高其预后,不良反应少,值得应用及推广。
[参考文献]
[1] 蒋友慧.新辅助化疗前后血清血管内皮生长因子水平的变化[J].中国普外基础与临床杂志,2016,23(3):345-345.
[2] 邓秋华,林勇平,杨海虹,等.β-tubulin表达与非小细胞肺癌患者術后诺维本联合铂类辅助化疗预后的关系[J].中国肿瘤临床,2012,39(19):1410-1414.
[3] 刘晓.甘露醇开放血脑屏障在小细胞肺癌治疗中的应用探讨[J].海峡药学,2016,28(8):134-135.
[4] 梁彩霞,陈满瑜,沈润,等.艾迪注射液治疗妇科恶性肿瘤化疗患者抑郁的临床效果[J].现代肿瘤医学,2016,24(20):3290-3294.
[5] 倪明立,谢玲,秦贝贝.Wnt/β-catenin信号通路在非小细胞肺癌组织的表达及意义[J].广东医学,2016,37(15):2299-2301.
[6] 庞一雄,黄维江,胡磊,等.小细胞肺癌恶性程度与新辅助化疗预后的研究[J].海南医学院学报,2016,22(9):898-901.
[7] 支修益.肿瘤标志物ProGRP助力小细胞肺癌的临床决策[J].中国肿瘤外科杂志,2014,6(1):42-43.
[8] 徐晓鸿,陈家斌,夏银稳,等.沙利度胺联合吉非替尼新辅助化疗对非小细胞肺癌的临床价值[J].昆明医科大学学报,2016,37(1):65-68.
[9] 范宜楚,汪笑冬,迟明友,等.术前新辅助化疗对局限期小细胞肺癌预后的影响研究[J].中国全科医学,2016,19(14):1653-1658.
[10] Zhang Z,Gasser RB,Yang X,et al. Two benzimidazole resistance-associated SNPs in the isotype-1 β-tubulin gene predominate in Haemonchus contortus populations from eight regions in China [J]. Int J Parasitol Drugs Drug Resist.,2016,6(3):199-206.
[11] Chan SK,Hagen HR,Swanson SA,et al. Development of Bipotent Cardiac/Skeletal Myogenic Progenitors from MESP1+Mesoderm [J]. Stem Cell Reports,2016,6(1):26-34.
[12] 汤新跃,蔡长青,廖万清.注射用黄芪多糖联合三维适形放疗治疗老年非小细胞肺癌疗效观察[J].现代医院,2015,15(9):30-31.
[13] 牛朝霞,李宁宁,梁芳,等.紫杉醇化疗联合参一胶囊对晚期非小细胞肺癌患者的疗效及安全性[J].世界中医药,2016,11(7):1265-1267,1271.
[14] 王先国,周远,李宇,等.培美曲塞联合替吉奥胶囊治疗晚期老年非小细胞肺癌的临床研究[J].中国医学创新,2015,12(31):32-35.
[15] 梁秋萍,殷俊.EGFR TKI+TP方案及TP方案对晚期非小细胞肺癌治疗临床效果及肿瘤标志物水平的影响[J].成都医学院学报,2016,11(1):40-44.
[16] 仲立新,张莉,范瑞,等.晚期NSCLC患者βⅢ-tubulin和Tau表达与紫杉醇敏感性的关系[J].中国实用医药,2016,11(5):147-148.
[17] 陈建英,胡先全,黄三雄,等.华蟾素胶囊联合GP方案对晚期非小细胞肺癌患者免疫功能的影响[J].中国现代医生,2016,54(14):12-15.
[18] 仇建玲.培美曲塞联合铂类化疗方案在非小细胞肺癌患者中的疗效分析[J].中外医学研究,2016,14(5):145-146.
[19] 张飔雪.新辅助化疗对局部晚期非小细胞肺癌患者临床疗效和手术切除率的影响[J].实用癌症杂志,2016, 31(8):1299-1301.
[20] 张生大,丁洁卫,唐志华,等.吉西他滨联合顺铂与紫杉醇联合顺铂治疗非小细胞肺癌的疗效对比研究[J].中国现代医生,2016,54(1):71-73,77.
[21] 巫云立,黄菁,张勇,等.多西他赛联合不同铂类在晚期非小细胞肺癌一线治疗中的效果分析[J].中外医学研究,2016,14(12):36-37.
[22] 熊新军.培美曲塞联合奥沙利铂在非小细胞肺癌术前新辅助化疗中的应用效果[J].实用临床医药杂志,2016, 20(9):153-154.
[23] 周旸,王延伟,高明,等.CEA、CA125、CA72-4、CYFRA211联合NSE对非小细胞肺癌诊断运用分析[J].现代生物医学进展,2013,13(16):3122-3124.
(收稿日期:2016-12-21 本文编辑:张瑜杰)

