W/Sn/Mg复合氧化物催化合成过氧乙酸的工艺研究
李 莹, 邓 军, 李胜楠, 闫 捷, 张国孟, 桂绍庸, 张光旭*
(1.武汉理工大学 化学化工与生命科学学院, 武汉 430070; 2.河南能源化工集团研究院, 郑州 450040)
W/Sn/Mg复合氧化物催化合成过氧乙酸的工艺研究
李 莹1, 邓 军1, 李胜楠1, 闫 捷2, 张国孟1, 桂绍庸1, 张光旭1*
(1.武汉理工大学 化学化工与生命科学学院, 武汉 430070; 2.河南能源化工集团研究院, 郑州 450040)
采用沉淀法制备W/Sn/Mg复合氧化物催化剂,并用其催化乙酸(AA)和过氧化氢(HP)制备过氧乙酸(PAA).考察了催化剂用量、带水剂种类及用量、乙酸与双氧水的摩尔比以及反应时间对产品收率和所得液中平衡水含量的影响,并用正交实验对反应条件进行优化.实验结果表明,适宜的反应条件为:催化剂用量1.5 g,n(HP)∶n(AA)=0.5∶1,带水剂乙酸丁酯100 g,反应时间10 h,在此条件下,过氧乙酸的收率可达33.83%,反应液中含水量可降低至3.0%左右;催化剂在重复使用一次后,过氧乙酸收率为19.62%,催化活性降低的原因可能是其表面吸附了有机物,部分活性中心被覆盖以及活性组分WO3流失.
复合氧化物催化剂; W/Sn/Mg; 过氧乙酸; 带水剂
目前,有机过氧化物(organic peroxide chemistry)已经成为有机化学领域一门新兴的交叉学科,关于有机过氧物化学的文献不断涌现[1-3],过氧酸类在各类有机过氧化物中氧化能力最强且在有机化学的各类特殊氧化反应中应用最广,其中最重要且广泛应用的是过氧乙酸(peroxyacetic acid, PAA)[4],其在医疗卫生、饮食行业作为杀菌消毒剂和在造纸纺织业作为漂白剂的应用有较多报道[5-7].
本课题组致力于双氧水间接氧化环己酮合成ε-己内酯的研究,由于ε-己内酯易水解、自聚,因此制备无水PAA是实际生产中亟需解决的重要问题.目前合成无水PAA采取的主要措施是用高浓度的过氧化氢(质量分数70%~100%)或固体过氧化氢(过碳酰胺[16]或过碳酸钠[17])来替代低浓度过氧化氢,同时利用酸酐来代替相应的酸,但这些方法原料难得且成本较高,很难实现工业化.作者通过改进催化剂的制备方法,考察不同反应条件.提高PAA收率,强化带水作用,并通过正交试验方案,得到最佳反应条件,最后初步探讨了催化剂的失活原因.
1实验部分
1.1试剂及仪器
结晶四氯化锡(A.R.)、钨酸(A.R.)、六水合氯化镁(A.R.)、氨水(A.R.)、乙酸(A.R.)、50%双氧水(工业品)、2-甲基吡啶(A.R.)、乙酸丁酯(A.R.)、乙酸异丙酯(A.R.)、丙酸乙酯(A.R.)、环己烷(A.R.)、高锰酸钾(A.R.)、硫代硫酸钠(A.R.)、氢氧化钠(A.R.)、钼酸铵(A.R.)、硫酸锰(A.R.)、硫酸(A.R.)、可溶性淀粉.
915 KF Ti-Touch卡尔费休测水仪:Metrohm Herisau Switzerland;Nova StatonA比表面积和孔结构测定仪:美国Quantachrome;AXIOS X荧光光谱仪:荷兰PANalytical.B.V; JA1003N电子分析天平:上海精密科学仪器有限公司;SHZ-D(Ⅲ)循环水式真空泵:巩义市英峪予华仪器厂;DF-101S热式恒温加热磁力搅拌器:巩义市英峪予华仪器厂;
1.2W/Sn/Mg复合金属氧化物催化剂的制备
将112.5 g MgCl2·6H2O,28.5 g SnCl4·5H2O和蒸馏水加入到1 000 mL三口烧瓶中,并搅拌溶解,然后滴加氨水进行沉淀,控制溶液的pH值,在pH值达到9~11后停止滴加并将9.5 g的H2WO4缓慢加入到溶液中,继续搅拌1 h;停止搅拌,在水浴30℃条件下让溶液静置12 h后过滤得到湿催化剂固体,并将其用蒸馏水、无水乙醇各洗涤3次,每次用量250 mL;然后在恒温干燥箱中100℃条件下干燥12 h;将干燥后的固体用粉碎机粉碎,于600℃马弗炉中焙烧3 h即制成W/Sn/Mg复合金属氧化物催化剂,马弗炉的温度先4 h升温到600℃,再在600℃下保持3 h.
1.3过氧乙酸的合成
合成PAA的反应方程式如下:
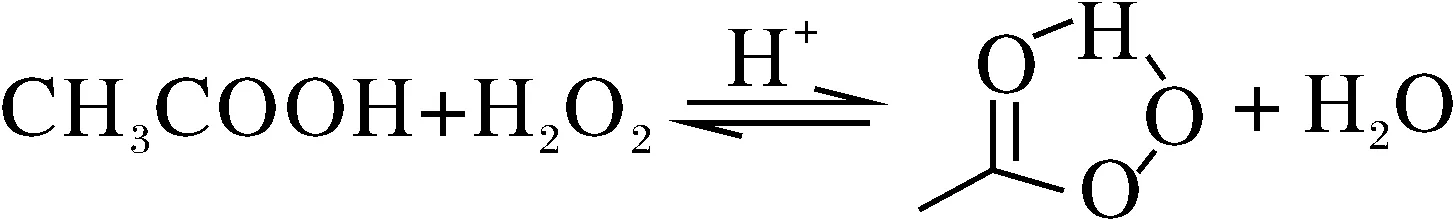
.
催化合成PAA装置见图1.在带有温度计、分水器和回流冷凝管的三口烧瓶中按一定计量比加入催化剂、乙酸、2-甲基吡啶及带水剂,在负压、磁力剧烈搅拌、56℃下将一定量质量分数为50%的H2O2由恒压漏斗向三口烧瓶缓慢滴加,保持带水剂回流,连续脱水,反应结束后称重,分析并计算收率.

1.U型压差计;2. 集热式恒温磁力搅拌器;3.500 mL三口烧瓶;4.恒压漏斗;5.温度计;6.油水分离器;7.蛇形冷凝管;8.缓冲瓶;9.循环水式真空泵图1 催化反应装置图Fig.1 The experimental setup of catalyst reaction
1.4过氧乙酸的含量测定及计算
取离心后的反应液试样m1约0.1~0.2 g,加入10%的硫酸10 mL和3滴硫酸锰,用蒸馏水稀释到100 mL左右,用KMnO4标液(摩尔浓度记为c1=0.1 mol/L)滴定至微红色,记体积为v1.
取离心后的反应液试样m2约0.1~0.2 g于碘量瓶中,加入10%的硫酸5 mL,10 mL碘化钾(100 g/L),3滴钼酸铵,水封瓶塞后在暗处放置10 min后,用蒸馏水稀释到100 mL 左右,用Na2S2O3标液(摩尔浓度记为c2=0.1 mol/L)滴定至淡黄色,加入3 mL 10 g/L的淀粉指示剂,继续滴定到溶液由深蓝色变为无色,记Na2S2O3体积为v2;计算公式如下:

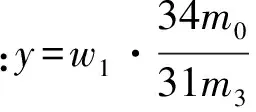
式中,m0为反应液最终质量,g;m3为双氧水的质量,g.
2结果与讨论
2.1带水剂种类对PAA收率及水含量的影响
不同带水剂对PAA的收率及含水量(均指质量分数)有较大影响,本实验综合考察了不同的带水剂,其结果见表1.由表1可知,以环己烷和丙酸乙酯为带水剂时,PAA的收率较低,产物中的平衡含水量很多,这主要是因为,环己烷和丙酸乙酯分别与水形成的共沸物中含水量较低,分别为0.09和0.10,导致带出去的水较少.而由反应动力学原理可知,将水带出可以促进反应正向进行,使PAA收率增加;以乙酸丁酯和乙酸异丙酯为带水剂时,PAA收率接近,但乙酸异丙酯为带水剂时平衡含水量比乙酸丁酯多且乙酸异丙酯价格较贵;因此,综合考虑后选用乙酸丁酯做带水剂.
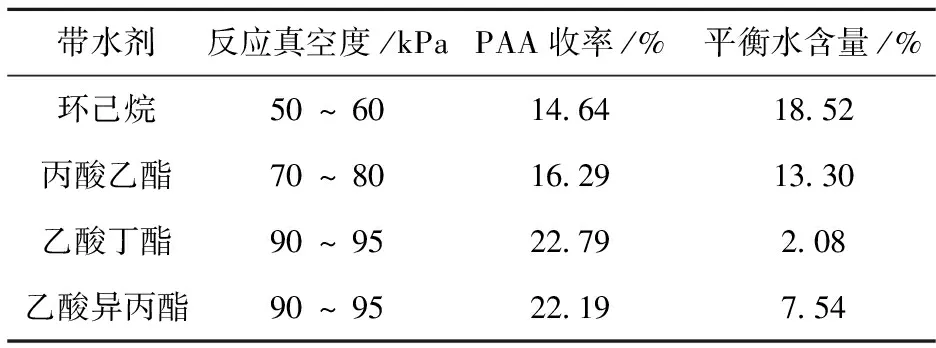
表1 带水剂种类对过氧乙酸收率和平衡水含量的影响
注:催化剂2g,n(双氧水)∶n(乙酸)=0.5∶1,吡啶0.2 g,反应时间11 h.
2.2带水剂乙酸丁酯用量对PAA收率和水含量的影响
由上面实验可知带水剂乙酸丁酯的效果最好,本实验对乙酸丁酯的用量在反应的影响方面进行考察,结果见图2,由图2可知,当带水剂用量为75 g时,过氧乙酸的收率最高(30.18%),这是因为带水剂用量少时,带水不完全,不利于反应正向进行.随着带水剂用量的增加,产生的水分不断被带出,有利于反应正向进行,过氧乙酸的收率增加.但当带水剂过多时,会对反应物及催化剂起稀释作用,反应物浓度降低.使得收率降低,此外,随着带水剂用量的增多,所得溶液中水含量虽越来越少,但减少的缓慢,因此综合考虑,选择带水剂的用量为75 g.
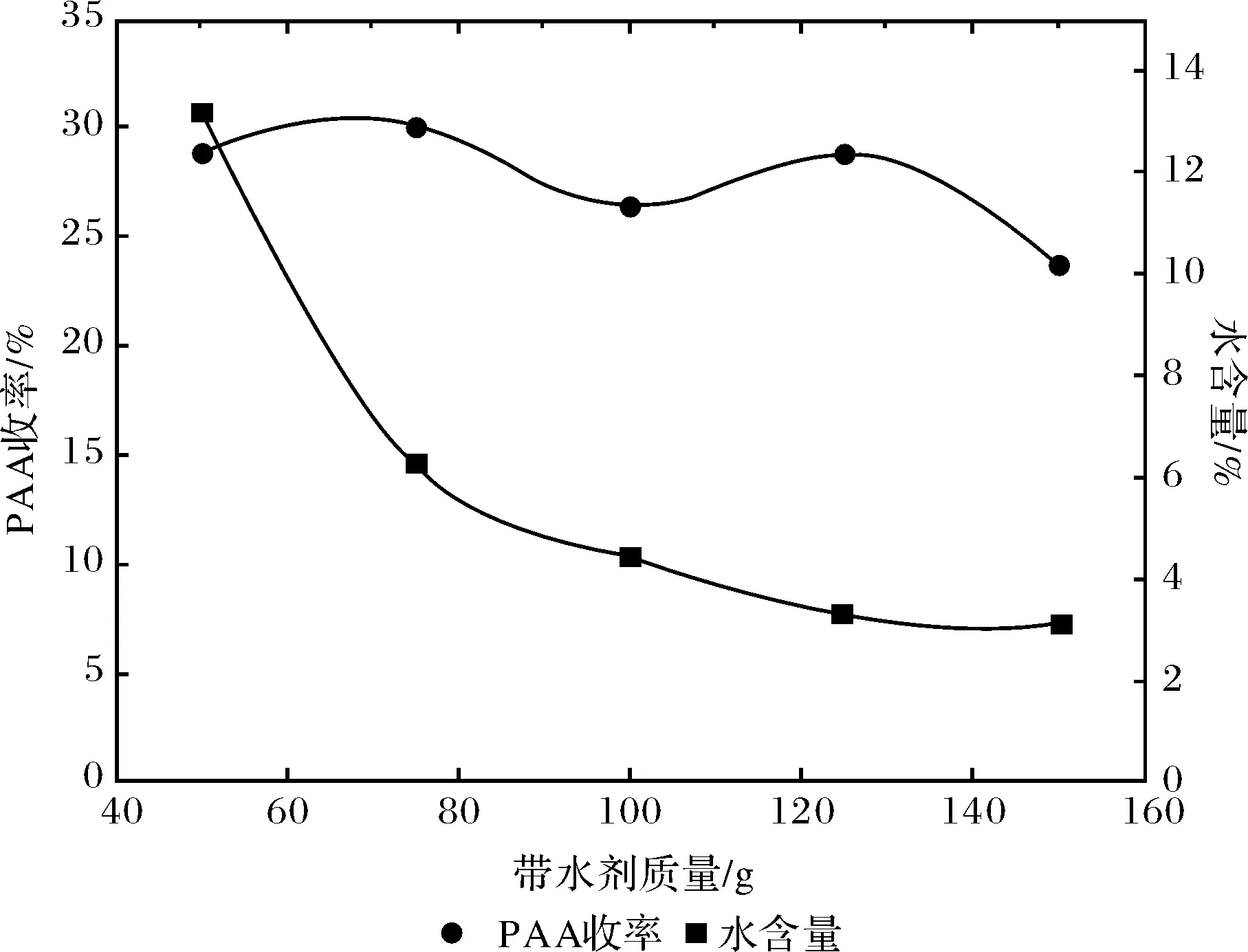
(催化剂1 g,n(HP)∶n(AA)=0.5∶1, 吡啶0.4 g,反应时间11 h)图2 带水剂用量对PAA收率和平衡水含量的影响Fig.2 Effect of water-carrying agent dosage on yield of PAA and water content
2.3催化剂用量对PAA收率和水含量的影响
催化剂按前述方法进行制备,考察其用量对反应的影响,结果见图3.由图3可知,不加催化剂时PAA收率很低且溶液中水含量较高,当催化剂用量为1.5 g时,PAA收率最高为27.56%且平衡含水量较低;当催化剂用量的进一步增加时,过氧乙酸的收率并没有明显增加,甚至有减小的趋势,这是因为金属离子对PAA的分解速度有影响[18].W/Sn/Mg复合金属氧化物催化剂,其中的Mg2+对PAA起稳定作用,而金属离子W3+,与同族元素Cr3+一样对过氧乙酸分解起促进作用,当催化剂用量较少时,Mg2+的稳定作用占主要地位,随催化剂用量增加,W3+的分解作用占主要地位,因此PAA收率反而有所下降;此外,随催化剂用量的增加,水含量减少不明显,因此选择催化剂用量为1.5 g.
2.4n(HP)∶n(AA)对PAA收率和水含量的影响
不同物料摩尔比对PAA收率和水含量的影响见图4.由图4可知,当n(HP)∶n(AA)增加至0.5∶1时,PAA的收率最高为25.06%,平衡含水量为3.24%,继续增加双氧水的用量,过氧乙酸的收率下降,这是因为催化剂被稀释,双氧水反应不完全;此外,由图4可知,随n(HP)∶n(AA)的增加,生成液中的水含量逐渐增加,这主要是由于双氧水带入的初始水的量增多引起的.因此,适宜的n(HP)∶n(AA)为0.5∶1.
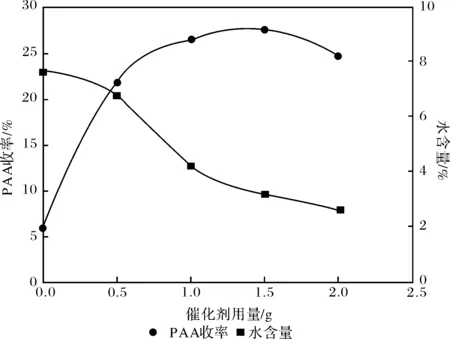
(n(HP)∶n(AA)=0.5∶1,乙酸丁酯100 g, 吡啶0.4 g,反应时间11 h)图3 催化剂用量对PAA收率和平衡水含量的影响Fig.3 Effect of catalyst dosage on yield of PAA and water content

(催化剂1 g,乙酸丁酯100 g, 吡啶0.4 g,反应时间11 h)图4 n(HP)∶n(AA)对PAA收率和平衡水含量的影响Fig.4 Effect of n(HP)∶n(AA) on yield of PAA and water content
2.5反应时间对PAA收率和平衡水含量的影响
反应时间对过氧乙酸收率和平衡含水量的影响见图5.由图5可知,随反应时间的延长,过氧乙酸的收率逐渐增加,产物中含水量逐渐降低,反应进行到11 h时,已基本完成,再延长反应时间,过氧乙酸的收率反而下降,水的含量上升,这是因为生成的过氧乙酸在加热条件下的自然分解,后期水量相比之前有所上升,可能是因为在后期水含量较少,被抽走的乙酸丁酯比例较共沸时有所增加,导致含水量相对增加.因此,选择反应时间为11 h.

(催化剂1 g,乙酸丁酯100 g, n(双氧水)∶n(乙酸)=0.5∶1,吡啶0.4 g)图5 反应时间对PAA收率和平衡水含量的影响Fig.5 Effect of reaction time on yield of PAA and water content
2.6反应条件的优化
为寻找双氧水氧化乙酸生成PAA的最佳工艺条件,为工业化提供参考数据,结合上述单因素实验结果,进一步采用正交实验法进行优化.由单因素实验结果可知,影响过氧乙酸收率和含水量的主要因素有催化剂的质量、HP与AA的摩尔比、带水剂乙酸丁酯的用量以及反应时间,因此在乙酸用量为96 g时,采用四因素三水平L9(34)正交实验法,考察四因素对PAA收率和含水量的影响,结果见表2和表3.
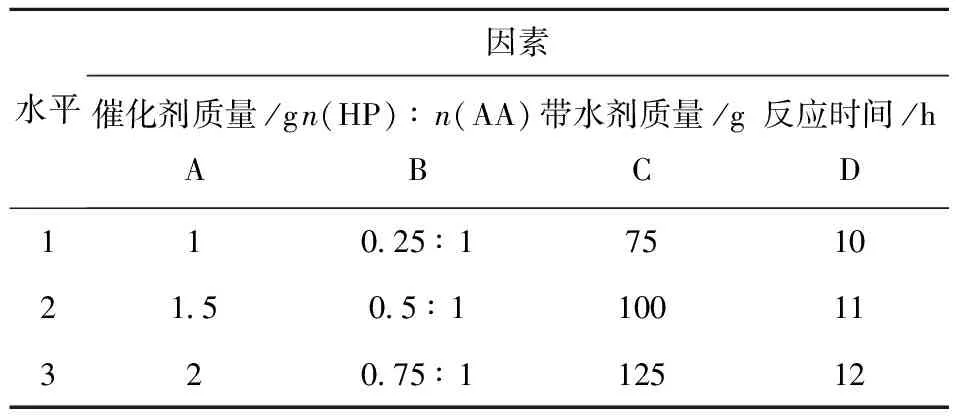
表2 正交实验的因素和水平
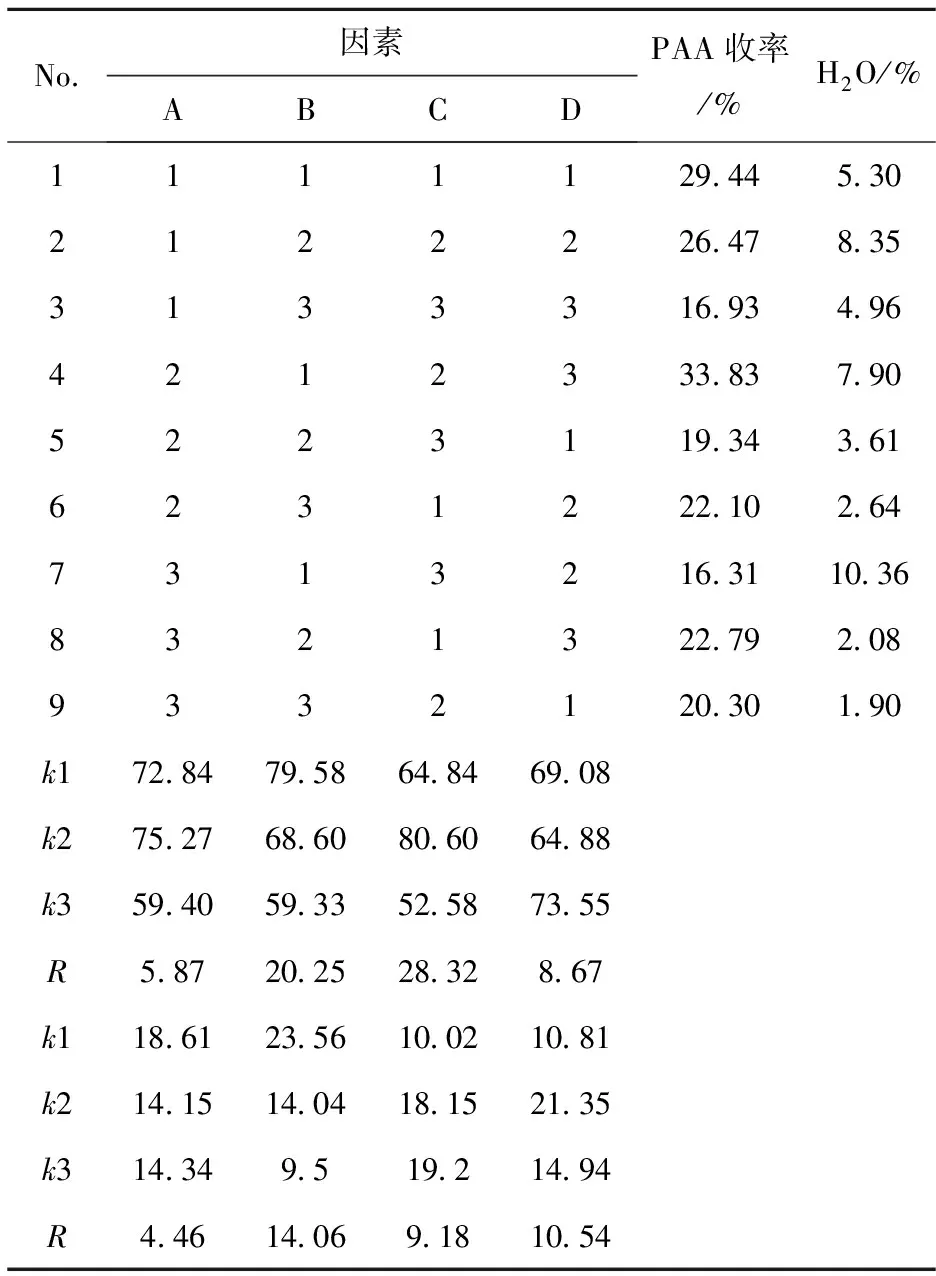
表3 正交实验结果与分析
由表3可见,四因素对过氧乙酸收率的影响大小顺序为C>B>A>D.由位级分析可知,最佳的位级组合是A2B1C2D3.四因素对反应液中水含量的影响大小顺序为B>D>C>A,最佳的位级组合是A2B3C1D1.综合上述两个指标及其重要程度,最佳的位级组合是C2B2D1A2,即优化的反应条件为:催化剂用量1.5 g,n(HP)∶n(AA)=0.5∶1,带水剂乙酸丁酯100 g,反应时间10 h,在该优化条件下,过氧乙酸的收率可达33.83%,反应液中含水量可降低至3%左右.
2.7催化剂的活性机理研究
将用过一次的催化剂进行活性评价,PAA收率降低至19.62%.为探究失活机理,对新鲜、失活催化剂的孔结构参数进行对比,结果见表4、图6、图7.此外,对两者活性组分的含量进行X荧光光谱(XRF)分析,结果见表5.

表4 新鲜、失活催化剂的孔结构参数对比
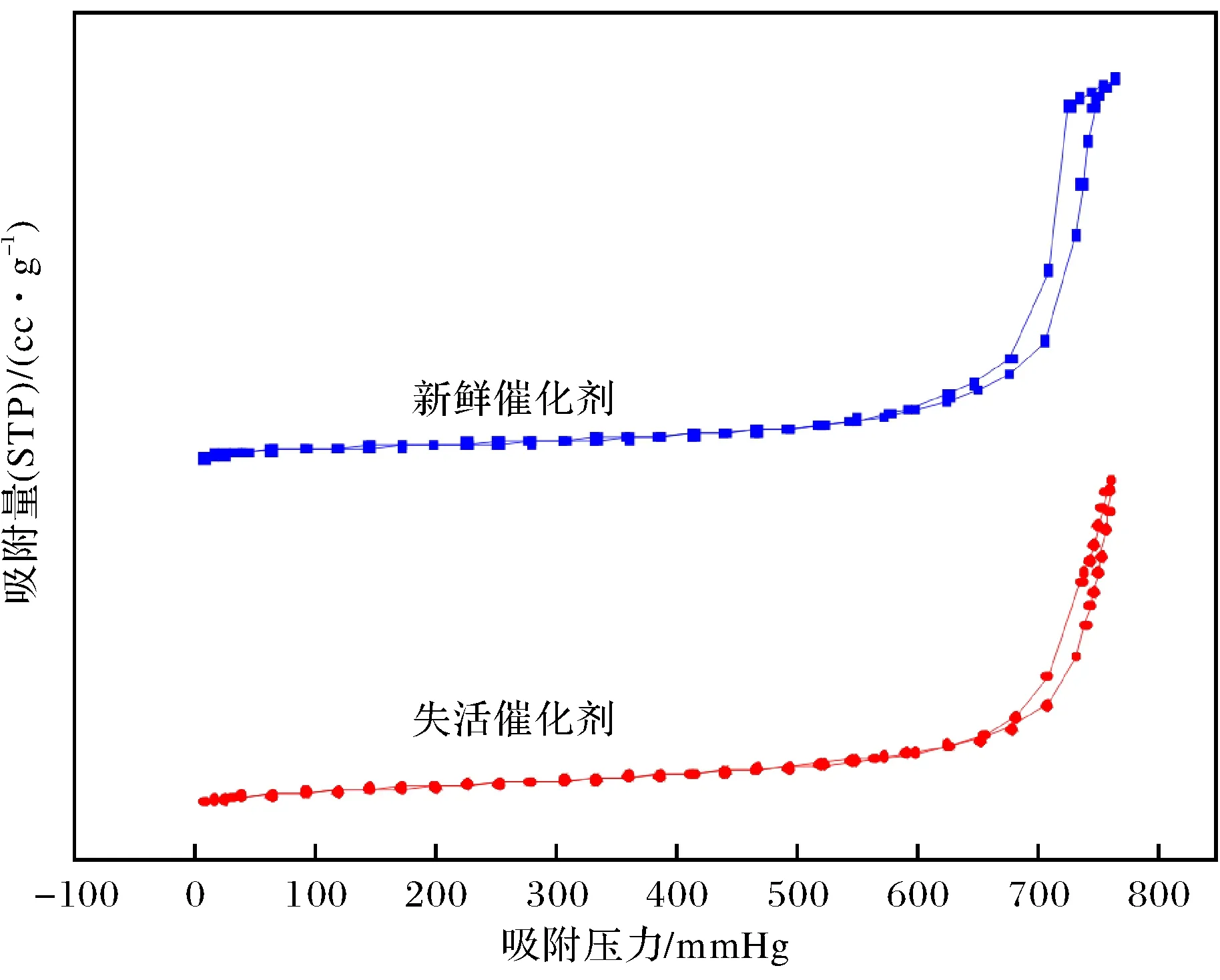
图6 新鲜、失活催化剂低温N2吸附-脱附等温线Fig.6 N2 adsorption-desorption isotherms of the fresh or deactivatal catalysts
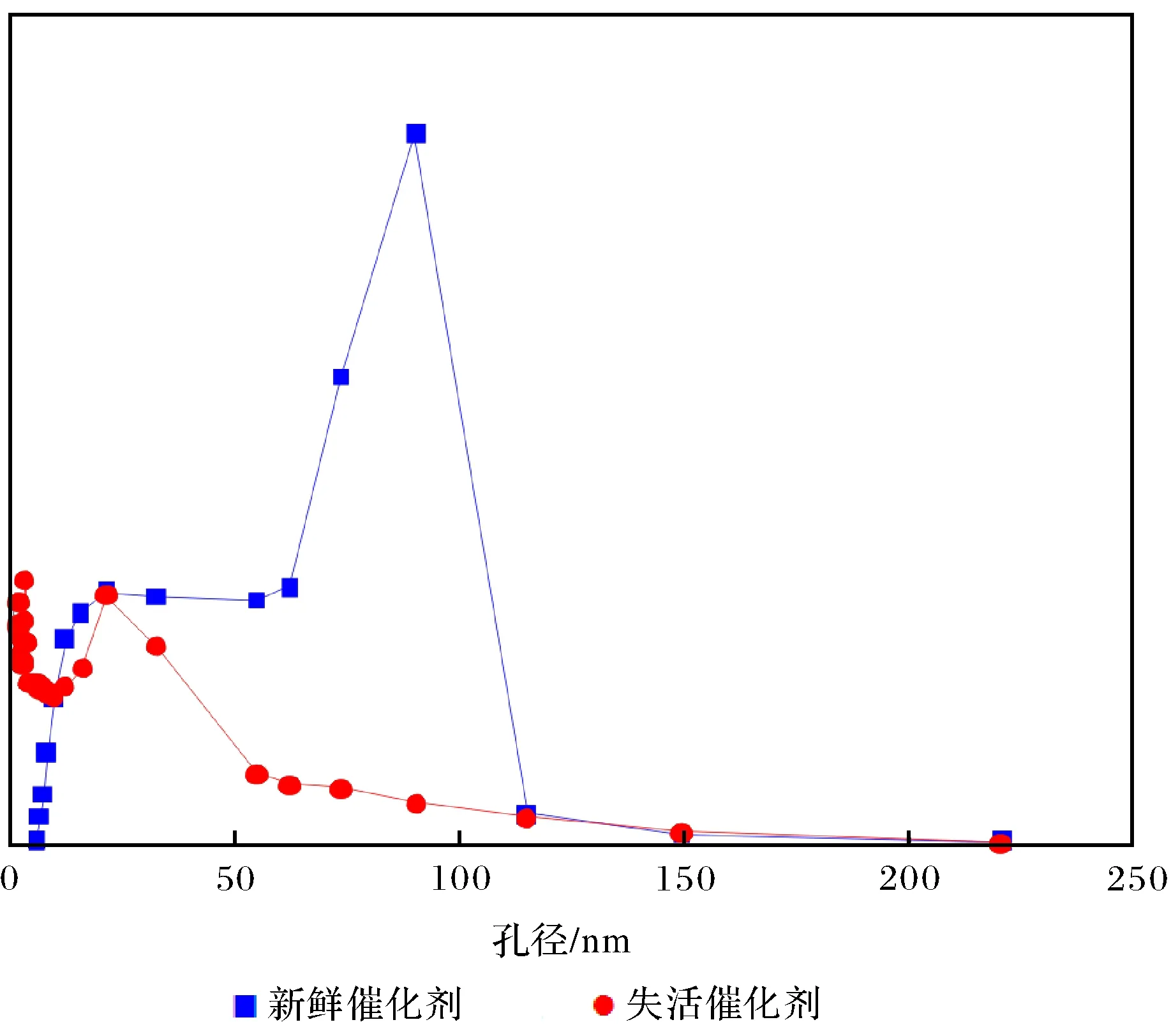
图7 新鲜、失活催化剂的孔径分布曲线Fig.7 Pore radius distribution curves of the fresh or deactivatal catalysts
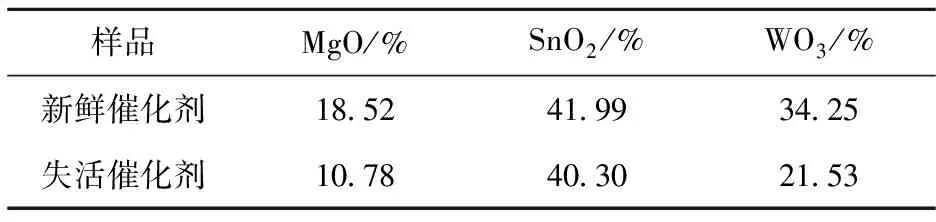
样品MgO/%SnO2/%WO3/%新鲜催化剂185241993425失活催化剂107840302153
由图6可见新鲜、失活W/Sn/Mg复合氧化物催化剂均具有典型的IV型等温线和H1型滞后环,表明制备的样品具有典型的介孔结构.由表4和图7可知新鲜、失活催化剂的平均比表面积和孔容相差不大,但失活催化剂的孔径集中分布在较小的范围.一般而言,孔径越小,在相近的孔容下,比表面积应越大,而这里失活催化剂的比表面积比新鲜催化剂的小,说明催化剂的孔道结构很有可能发生坍塌或催化剂表面吸附了有机物,使孔径变小、活性中心被覆盖.
由表5可知,失活催化剂与新鲜催化剂的活性组分WO3的含量差别较大,失活催化剂中的WO3流失严重,主要原因可能是在H2O2溶液中,由于[O2]2-强的电负性,WO3发生配位作用生成过氧化钨酸(H2[W2O3(O2)4(H2O)2]),过氧化钨酸在H2O2存在时,溶于有机溶剂乙酸和乙酸丁酯中,在抽真空的条件下不断被有机溶剂带出,这样使得WO3的含量不断减少.
3结论
(1)采用共沉淀法制备W/Sn/Mg复合氧化物催化剂,制备方法简便,催化剂易回收.
(2)以W/Sn/Mg复合氧化物作催化剂,乙酸和双氧水为原料合成过氧乙酸,最佳的反应条件为:催化剂用量1.5 g,n(HP)∶n(AA)=0.5∶1,带水剂乙酸丁酯100 g,反应时间10 h,在该优化条件下,过氧乙酸的收率可达33.83%,含水量可降低至3%左右.
(3)催化剂失活的原因主要有两方面:一方面,催化剂的孔道结构可能发生坍塌或催化剂表面吸附了有机物,使大孔变为小孔,比表面积变小、活性中心被覆盖;另一方面,反应过程中催化活性组分WO3流失.因此,减少催化剂孔结构的坍塌及减少活性组分的流失是提高W/Sn/Mg复合氧化物催化剂重复使用性能的关键.
[1] ANTONOVSKY V L, KHSURSAN S L. Physical Chemistry of Organic Peroxides [M]. Boston: Brill Academic Publishers, 2005.
[2] ADAM W. Peroxide Chemistry [M]. Hoboken: John Wiley & Sons, 2005.
[3] 游贤德. 国内有机过氧化物制备与应用研究[J]. 化学推进剂与高分子材料, 2000,4: 1-3.
[4] SWERN D. Organic Peroxides (Vol.1)[M]. Toronto: John Wiley &Sons, 1970.
[5] 段杨萍, 胡跃华, 段青兵, 等. 过氧乙酸用于循环冷却水系统的杀菌试验研究[J]. 化工进展, 2005, 24(6): 676-681.
[7] LIANG T, WANG L. An environmentally safe and nondestructive process for bleaching birch veneer with peracetic acid[J]. J Clean Prod, 2015, 92: 37-43.
[8] POHJANVESI P, MUSTONEM E L, PUKKINEN K. Process for the production of percarboxylic acid[P]. US2002177732 A1, 2002-11-28.
[9] LLAMAS R, JIMENEZ-SANCHIDRIAN C, RUIZ J R. Environmentally friendly Baeyer-Villiger oxidation with H2O2/Nitrile over Mg(OH)2and MgO[J]. Appl Cata B, 2007, 72: 18-25.
[10] 李静霞, 黄 靓, 戴维林, 等. 高活性MgO/SnO2复合金属氧化物催化剂的合成及其在双氧水选择氧化环己酮制ε-己内酯反应中的应用[J]. 化学学报, 2008, 66(1):5-9.
[11] Michael C R, GRAHAM C, ARNOLD B L, et al. Process for the oxidation of cyclohexanone to epsilon-caprolactone[P].US, 6531615, 2003-03-11.
[12] GRACA O R, ROBERT A W J, HEMMING B F, et al. Rates of formation of peroxyacetic acid from hydrogen peroxide and acetic acid in the presence of metal (IV) phosphates[J]. J Mol Catal A-Chem, 2002, 186:127-133.
[13] Palani A, Pandurangan A. Single pot synthesis of peroxyacetic acid from acetic acid and hydrogen peroxide using various solid acid catalysts[J]. Catal Commun, 2006, 7:875-878.
[14] PHILIPS B, FROSTICK F C, STARCHER P S. A new synthesis of peracetic acid [J]. J Am Chem Soc, 1957, 79: 5982-5986.
[15] 李韶峰, 何红振, 李 明, 等. 过氧乙酸合成及其在ε-己内酯制备中的应用[J]. 化学推进剂与高分子材料, 2016, 14(1):36-43.
[16] 李德新. 过碳酰胺合成工艺研究[J]. 郑州工业大学学报, 1997, 18(4): 113-114.
[17] 张 妍, 胡 辉, 方 屹, 等. 过碳酸钠-醋酸酐作用下的Baeyer-Villiger反应[J]. 有机化学, 1996, 16(1): 64-67.
[18] 郑建美. 金属离子影响过氧乙酸分解速度的探讨及对策[J]. 化学工程与装备, 2007, 4:8-12.
The synthesis and the technological study of peroxyaceticacid catalyzed by composite oxides W/Sn/Mg
LI Ying1, DENG Jun1, LI Shengnan1, YAN Jie2,ZHANG Guomeng1, GUI Shaoyong1, ZHANG Guangxu1
(1.School of Chemistry, Chemical Engineering and Life Sciences, Wuhan University of Technology, Wuhan 430070;2. Henan Energy Research Institute of Chemical Industry Group, Zhengzhou 450040)
Peroxyacetic acid (PAA) was synthesized from acetic acid (AA) and hydrogen peroxide (HP) on W/Sn/ Mg composite oxides catalyst. The catalyst was prepared by precipitation method. Influencing factors of end product yield and the water content were investigated. Orthogonal experiment was used to optimize reaction conditions. The optimal reaction conditions are: 1.5 g catalyst mass,n(HP)∶n(AA) as 0.5∶1, 100 g butyl acetate as water-carrying agent, and 10 hours of reaction time. Under the above conditions the yield of peroxyacetic acid is 33.83%, and the water content is able to be reduced to about 3%; the yield of PAA is reduced to 19.62% after catalyst was being used for one time, and catalyst deactivation is mainly due to covering of active sites by organic substances and losing of active component WO3.
composite oxide catalyst; W/Sn/Mg; peroxyacetic acid; water-carrying agent
2016-07-22.
国家自然科学基金项目(21676206).
1000-1190(2017)01-0056-06
TQ032.4
A
*通讯联系人. E-mail: zhanggx2002@163.com.
- 华中师范大学学报(自然科学版)的其它文章
- 基于高阶相关聚类的脱机手写文本行分割
- 基于改进ICA算法对云南地区重力固体潮中地震前兆信息的提取与识别
- 2,3-二芳基-1,3-苯并噁嗪的合成及对利什曼原虫CYP51活性的初步研究
- Fabrication of PZT PCs with nanoporearrays by sol-gel process
- 3种木棉光合特性及碳汇能力研究
- Mechanism exploration of xylitol selenite-inducedapoptosis in a human hepatoma cell lineSMMC-7221 cells using real-time quantitative PCR

