肝细胞癌患者循环血肿瘤细胞的检测、分型鉴定及其临床意义
齐鲁楠向邦德吴飞翔马良陈祖舜叶甲舟黎乐群,3
作者单位:530021 南宁1广西医科大学附属肿瘤医院肝胆外科;2广西肝癌诊疗工程技术研究中心;3区域性高发肿瘤早期防治研究教育部重点实验室
临床研究
肝细胞癌患者循环血肿瘤细胞的检测、分型鉴定及其临床意义
齐鲁楠1,2向邦德1,2吴飞翔1,2马良1,2陈祖舜1,2叶甲舟1,2黎乐群1,2,3
作者单位:530021 南宁1广西医科大学附属肿瘤医院肝胆外科;2广西肝癌诊疗工程技术研究中心;3区域性高发肿瘤早期防治研究教育部重点实验室
目的 通过对肝细胞癌(hepatocellular carcinoma,HCC)患者外周循环血肿瘤细胞(c irculating tumor cells,CTCs)的检测及亚型鉴定,分析其与HCC临床分期的关系及对手术预后的影响。方法 采用CanPatrolTMCTC-二代捕获技术联合RNA多重原位杂交分析(RNA in situ hybridisation,RNA-ISH),检测112例可手术切除HCC患者术前1~2 d与术后8~10 d外周循环血中的肿瘤细胞,并根据上皮-间叶转化(epithelial-mesenchymal transition,EMT)相关标志物的表达情况对其进行分型鉴定。同时,抽取20名健康志愿者的外周血作对照。结果 112例HCC患者术前1~2 d检测出CTCs 101例(90.18%),20名健康志愿者的外周血中未检测到CTCs。根据EMT相关标志物的表达情况,将检测出的CTCs分为上皮型CTCs、上皮为主型CTCs、上皮/间叶混合型CTCs、间叶为主型CTCs及间叶型CTCs。其中CTC总数及间叶型CTC的比例与HCC的巴塞罗那肝癌临床(barcelona clinic liver cancer,BCLC),分期密切相关。当以CTC总数等于16作为临界点时,预测患者术后极早期复发的敏感性为55.3%,特异性为92.3%,曲线下面积(area under the curve,AUC)为0.74;当以间叶型CTC的比例等于2%作为临界点时,预测患者术后极早期复发的敏感性为80.9%,特异性为69.2%,AUC为0.748。CTC总数≥16且间叶型CTC的比例≥2%组的患者中位无瘤生存期为3.5个月,明显低于单纯CTC总数≥16或间叶型CTC的比例≥2%组(7个月)和CTC总数<16且间叶型CTC的比例<2%组(13.5个月),差异有统计学意义(P<0.05)。112例HCC患者术后8~10 d CTC总数较术前有所下降,但间叶型CTC的比例较术前增多。术后出现间叶型CTC的比例增多的患者无瘤生存期短于间叶型CTC的比例下降(或不变)的患者,其预后也较差(P<0.05)。对10例患者进行术后连续定期CTCs变化的动态监测直至复发,发现其中8例患者于出现临床可见复发病灶前的1~2个月,CTCs就可出现逐渐增多的趋势。结论 HCC患者外周血CTC阳性率高,CTCs能被检测出存在于早期HCC患者外周血中,提示HCC的播散转移是早期事件;术前高CTC总数或高间叶型CTC的比例以及术后出现间叶型CTC的比例增多的患者,其复发时限较短,预后较差。术后动态监测CTCs变化,对HCC极早期复发的预测具有一定的临床意义。
肝肿瘤;循环血肿瘤细胞(CTCs);上皮-间叶转化;复发;转移;预后
肝细胞癌(hepatocelluar carcinoma,HCC)是我国最常见的恶性肿瘤之一[1]。既往认为通过HCC分期能很好地评估其预后。然而,某些处于早期的HCC患者,即使行根治性切除术,术后仍易短期内出现复发或转移。因此,临床上仍需探索与HCC术后复发转移相关的预测方法及防治措施。肿瘤细胞要实现循环系统的侵袭播散,首先必须发生细胞表型的转化。肿瘤细胞上皮-间叶转化(e pithelial-mesenchymal transition,EMT)被认为是肿瘤细胞血循环侵袭转移关键的一步[2-3]。因此,检测外周循环血肿瘤细胞(c irculating tumor cells,CTCs)及对其各亚型的鉴定分析具有重要的临床价值。目前CTCs的检测已经被用于乳腺癌、肺癌、胃癌等患者预后的评估[4-9]。然而,关于CTCs在HCC患者中应用的报道仍相对较少,特别是关于EMT转化型CTCs检测在评估可手术切除的HCC患者预后方面的报道。本研究采用CanPatrolTMCTC-二代捕获技术联合RNA多重原位杂交分析(RNA in situ hybridisation,RNA-ISH),检测HCC患者术前与术后外周循环血中的CTCs,同时根据EMT相关标志物的表达情况对其进行分型鉴定,探讨其临床意义。
1 材料与方法
1.1 标本来源
抽取2014年3月至2016年5月广西医科大学附属肿瘤医院肝胆外科112例可手术切除HCC患者外周血5mL。其中男性91例,女性21例;年龄32~65岁,中位年龄44.7岁。同时抽取20名健康志愿者外周血作对照。所有患者术前均未接受放疗、化疗。所有选取的病例均履行告知义务并签署知情同意书。
1.2 主要试剂及材料
CanPatrolTMCTC-二代捕获技术及RNA-ISH试剂盒和相关材料购自广州益善生物技术股份有限公司。其余试剂及仪器均由广西医科大学实验中心提供。
1.3 操作方法
1.3.1 样本采集 使用8号采血针和EDTA抗凝采血管采集5 mL外周血,将EDTA抗凝采血管上下颠倒混匀10次。将样本保存管插入孔内,EDTA抗凝采血管内的血液自动输入样本保存管内。待样本保存管内的液面不再上升后,拔出样本保存管,上下颠倒混匀10次。室温放置30min。
1.3.2 人外周循环血肿瘤细胞富集 离心去除上清液,固定剂固定8min。将真空管通过纳米滤膜过滤器与真空泵连接。将样本保存管中的液体转移至过滤器中,实现肿瘤细胞纳米技术截留与富集。滤过膜的样本甲醛溶液室温固定60min。
1.3.3 RNA多重原位杂交分析检测 透化剂孵育5min,PBS洗涤3次。消化酶孵育60min,PBS洗涤3次。首先行EMT相关标志物基因探针杂交(各探针序列详见表1)。加入探针工作液,置于(40±1)℃生化培养箱中,孵育3 h,洗涤液洗涤3次。接着行扩增探针杂交(目的是使用扩增探针与捕获探针进行杂交,为杂交信号的放大做准备),加入预扩增工作液,置于(40±1)℃生化培养箱中,孵育30min,洗涤液洗涤3次。加入扩增探针工作液,置于(40±1)℃生化培养箱中,孵育30min,洗涤液洗涤3次。最后进行信号标记探针杂交(使用标记有荧光基团的标记探针与扩增探针进行杂交,产生荧光信号),加入显色信号探针工作液,置于(40±1)℃生化培养箱中,孵育30 min,洗涤液洗涤3次。在样本上加抗淬灭剂(含DAPI)。样本放置5 min后利用自动识别系统阅读荧光信号,自动判断检测结果[10]。
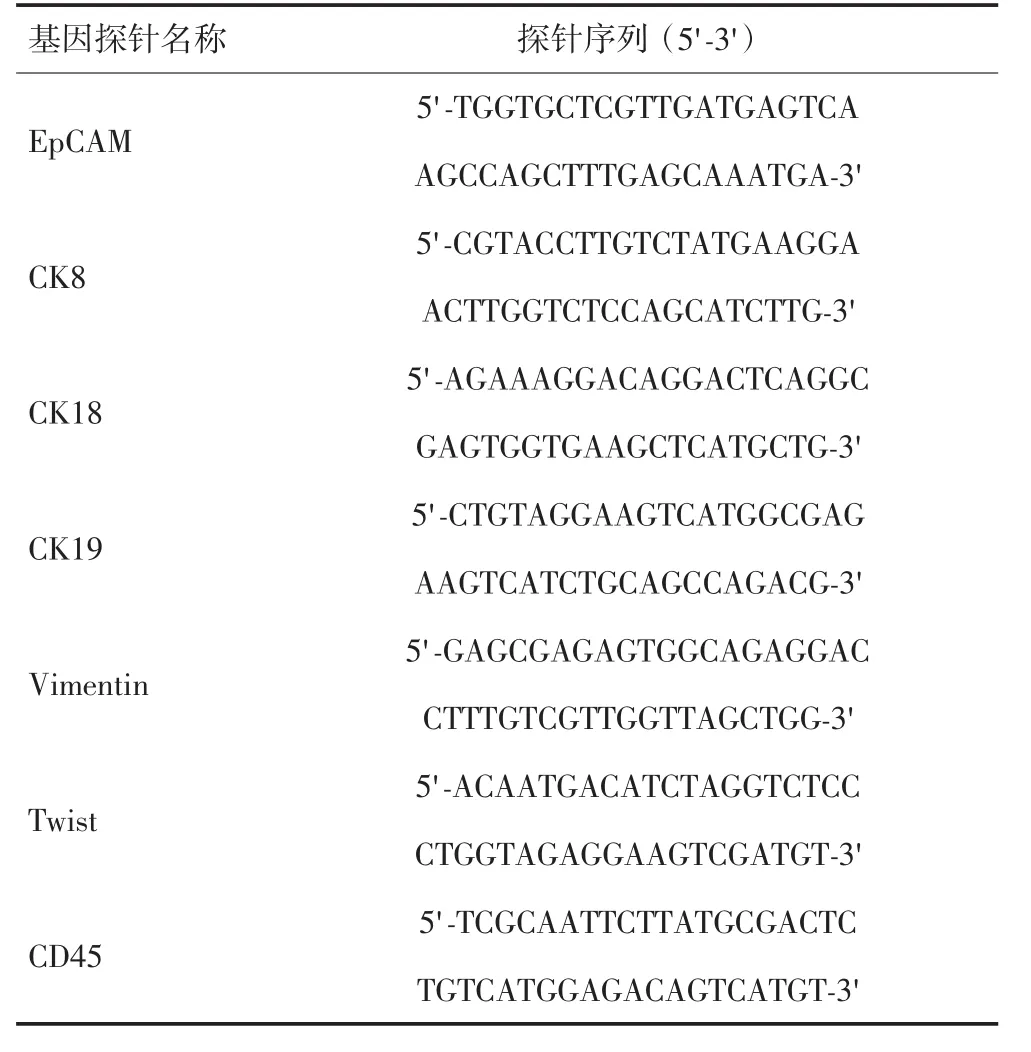
表1 EMT相关标志物基因探针序列
1.3.4 结果分析及分型鉴定 试剂盒采用多重RNA探针(EMT相关标志物基因探针),针对多种CTCs特异性基因,通过不同颜色荧光信号将CTCs分型。上皮型CTCs仅上皮相关标志物(EpCAM、CK8/18/19)表达阳性,显示为红色荧光信号点;间叶型CTCs仅间叶相关标志物(Vimentin和Twist)表达阳性,显示为绿色荧光信号点;同时表达上皮和间叶特异性基因的CTCs为混合型(同时显示红色荧光及绿色荧光信号点)。
1.4 统计学处理
应用SPSS 18.0统计学分析软件对所得数据进行统计学处理。各指标在组间阳性表达率的比较,采用四格表χ2检验或行×列表χ2检验;组间计量资料的比较采用Wilcoxom秩和检验;生存分析采用Kaplan-Meier法估计无瘤生存曲线,Log-rank检验比较无瘤生存曲线的差别。以P<0.05为差异具有统计学意义。
2 结果
2.1 HCC患者术前及健康志愿者外周血CTCs的检测情况
根据EMT相关标志物(EpCAM、CK8、CK18、CK9、Vimentin及Twist)的表达情况,将检测出的CTCs分为上皮型CTCs(E-CTC)、上皮为主型CTCs(E>M-CTC)、上皮/间叶混合型CTCs(E≈M-CTC)、间叶为主型CTCs(M>E-CTC)及间叶型CTCs(M-CTC)(图1A)。112例HCC患者术前1~2 d外周血可检测出CTCs 101例(90.18%)(图1B)。20名健康志愿者的外周血中未检测到CTCs。其中手术前CTC总数及间叶型CTC的比例与HCC的巴塞罗那肝癌临床(barcelona clinic liver cancer,BCLC)分期密切相关,即在BCLC B~C期患者中明显高于BCLC 0~A期患者(P<0.001)(图1C、图D)。
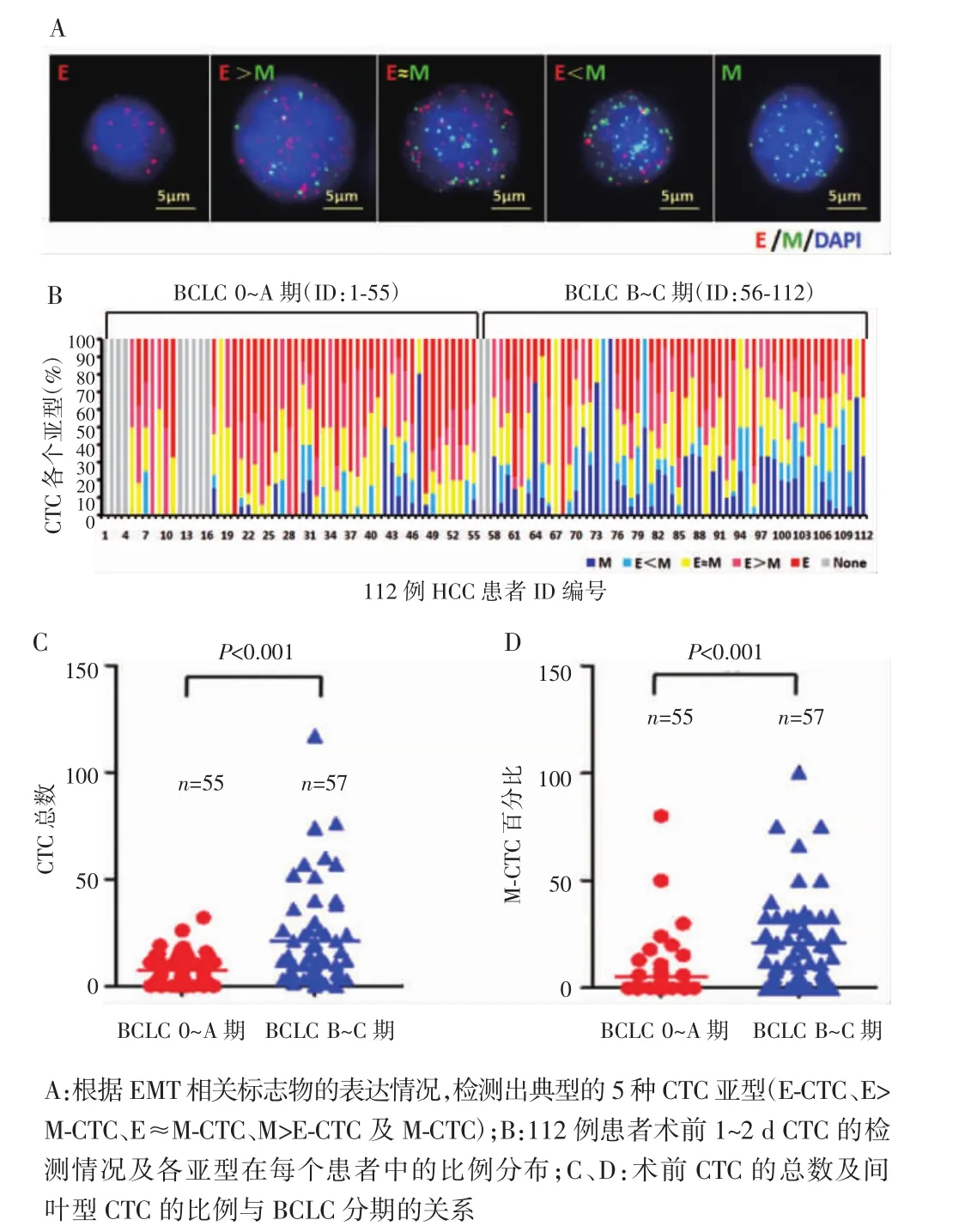
图1 112例HCC患者术前CTC检测及与BCLC分期的关系
2.2 HCC患者术前CTC检测与手术预后的关系
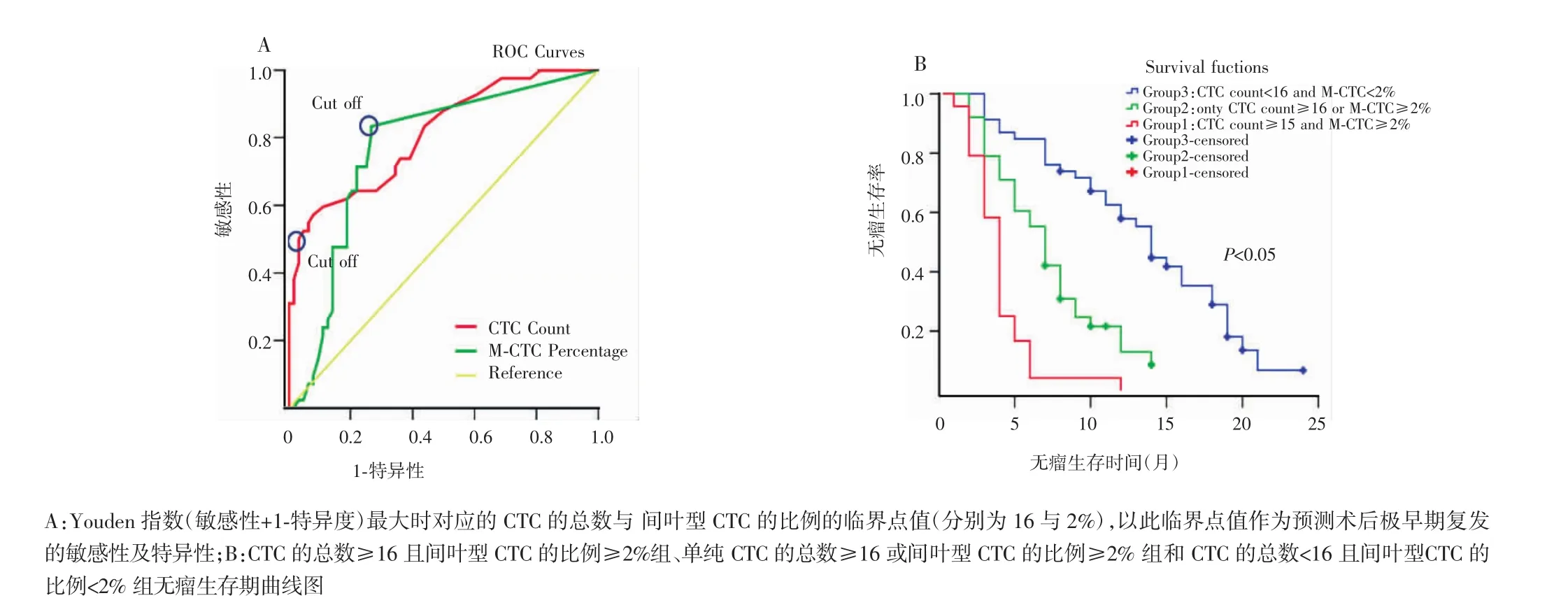
图2 HCC患者术前CTC检测与手术预后的关系分析
由于术前CTC总数及间叶型CTC的比例与HCC的BCLC分期密切相关,本研究进一步探讨两者作为预测术后极早期复发的可行性。将术后无瘤生存时间(复发时限)小于或等于6个月定义为术后极早期复发,以CTC总数及间叶型CTC的比例分别构建受试者工作特征曲线(ROC),Youden指数(敏感性+1-特异性)最大对应的值作为临界点(cut off)。当以CTC总数等于16作为临界点时,预测患者术后早期复发的敏感性为55.3%,特异性为92.3%,曲线下面积(area under the carve,AUC)为0.74;当以间叶型CTC的比例等于2%作为临界点时,预测患者术后早期复发的敏感性为80.9%,特异性为69.2%,AUC为 0.748(图2A)。根据临界点值,将112例患者分成3个亚组:CTC总数≥16并且间叶型CTC的比例≥2%组(n=25),单纯CTC总数≥16或间叶型CTC的比例≥2%组(n=39)和CTC总数<16且间叶型CTC的比例<2%组(n=48)。在112例HCC患者中,共有91例患者在随访期间出现了HCC复发。所有患者6个月、12个月、24个月的肿瘤复发率分别为35.6%、54.3%、81.12%,中位无瘤生存期为13个月。其中CTC总数≥16且间叶型CTC的比例≥2%组患者的中位无瘤生存期为3.5个月,明显低于单纯CTC总数≥16或间叶型CTC的比例≥2%组(7个月)和CTC总数<16且间叶型CTC的比例<2%组(13.5个月)(P<0.05)(图2B)。
2.3 术后CTC变化的动态监测
112例HCC患者于术后8~10 d复测CTC变化,结果显示:112例患者术后8~10 d CTC的总数、上皮型CTC比例及各混合型CTC比例均有所下降(图3A),但间叶型CTC比例有所增高(图3B)。我们根据术后8~10 d CTC变化情况,将112例患者分为CTC总数减少(或无变化)组与CTC总数增多组,采用Kaplan-Meier法分析比较两组无瘤生存时间的差异,结果发现两组的无瘤生存时间差异无统计学意义(P>0.05)(图3C)。根据术后间叶型CTC的比例变化分为间叶型CTC比例下降(或无变化)组与间叶型CTC比例增高组,两组比较结果显示,间叶型CTC比例增高组的无瘤生存时间明显短于间叶型CTC比例下降(或无变化)组,两组差异有统计学意义(P<0.05)(图3D)。
接着对其中10例患者进行术后连续定期CTC变化的动态监测直至出现复发,发现其中8例患者于临床出现可见复发病灶前的1~2个月,CTC便开始出现逐渐增多的趋势。图3E为其中1例典型患者的术后CTC总数及各亚型变化的动态监测情况(直到复发时间截点),该患者术后第4个月临床确诊复发,但在术后第2个月CTC表现出上升趋势。
3 讨论

图3 术后CTC数量及各亚型变化的检测
肿瘤患者外周血中CTCs的检测对于患者的诊断、预后评估具有重要的意义。包括HCC在内的多数研究中,通过CellSearch系统检测外周血CTCs是最常用的方法之一[6-8,11-12]。由于肿瘤细胞大多数来源于上皮细胞,所以会带有上皮细胞特有的表面抗原EpCAM,CellSearch用带抗EpCAM的磁珠富集循环血CTC细胞。然而,肿瘤细胞要发生转移,首先要经过“上皮-间叶转化”,经过EMT转化获得间叶表型的肿瘤细胞更容易播散进入循环系统。因此,采用CellSearch检测系统的局限在于其往往无法富集到“间叶表型CTC”。本研究中,我们采用CanPatrolTMCTC-二代捕获技术对HCC患者外周血进行CTCs俘获,同时根据EMT相关标志物的表达情况,采用RNA-ISH对俘获到的CTC进行亚型分型鉴定并鉴定出5种不同亚型的CTCs,其中包括“间叶表型CTC”,弥补了CellSearch的不足。
本研究112例HCC患者术前1~2 d,有101例检测出CTCs,阳性率高达90.18%。并且,CTC在BCLC0-A期患者中具有较高的阳性率,提示在HCC的早期,癌细胞就可以出现体循环扩散,即HCC的播散转移可能是早期事件,符合肿瘤转移“早期平行转移学说”[13]。正因为CTC的播散可能发生在早期,甚至可能发生在传统影像学检查(B超、CT等)还无法检测出可见病灶的极早期,因此,CTCs检测作为一项“液态活检”技术,有望成为HCC早期筛查、早期诊断的又一重要手段,为HCC早期干预治疗提供有价值的依据。
虽然,肝癌CTC播散转移可能是早期事件,但本研究仍然发现与BCLC分期密切相关,即CTC总数及间叶型CTC的比例在BCLC B~C期患者中明显高于BCLC0~A期患者。并且,以CTC总数等于16或间叶型CTC的比例为2%作为临界点,预测术后极早期复发(复发时限小于等于6个月)具有较高的敏感性及特异性,提示CTC总数及间叶型CTC的比例与HCC的进展及患者的不良预后有关。某些乳腺癌、结肠癌及肺癌等研究也提示外周血中CTCs检测阳性的患者术后复发率高,放化疗疗效不佳[4,11,14-15]。这些研究与本研究结果具有一致性。
以CTCs的变化评估肝癌治疗方案疗效的研究也有相关报道。比如,Wu等[10]研究发现,多数患者术后CTC总数出现明显下降,且出现CTC总数明显下降的患者,其无瘤生存期明显延长。本研究对112例HCC患者术后8~10 d CTCs变化进行复测,同样发现CTCs总数较术前有所下降,但间叶型CTCs的总比例较术前增多。但CTC总数减少(或无变化)组与CTC总数增多组之间无瘤生存时间却无明显差别。甚至某些患者虽然术后8~10 d表现为CTC总数增加,但却有着相对较长的无瘤生存时间。出现此结果的具体原因尚不明,可能与手术方式有关,即由于手术操作过程中对肿瘤产生挤压作用,促使CTCs的循环播散,从而导致术后早期体循环中CTC总数增加。然而,此类CTC很可能由于缺乏抗“失巢凋亡”的能力在循环系统中很快发生凋亡,并不影响患者的无瘤生存期。换句话说,术后早期的CTC总数变化并不是评估预后的良好指标。另有研究报道[4],间叶型CTSs具有较强的转移侵袭及抗凋亡能力。本研究亦发现术后间叶型CTCs比例增多的患者,其无瘤生存期较短,预后较差。
本研究定期连续监测10例患者术后CTCs的变化,发现其中8例患者于临床检测出可见复发病灶前的1~2个月,CTC出现逐渐增多的趋势。目前,暂无肿瘤细胞脱离原发瘤进入循环系统后获得自我增殖潜能的报道。然而,在Klein[13]的报道中提到这样一个观点:原发瘤被手术切除后,若监测循环血CTCs出现动态变化,特别是当其总量逐渐增加时,则可能提示原发瘤已经在某些靶器官发生了定植转移,尽管转移灶或许还不能被传统检验手段检测出。如前所述,原发瘤的播散可能是早期事件,复发灶或转移灶或许也能在极早期释放CTCs进入血循环。术后定期动态检测CTCs变化,有可能先于传统影像学检查发现并提示肿瘤极早期复发。因此,术后CTCs动态检测有望成为HCC患者预测术后极早期复发的重要手段,为HCC复发转移的早期干预治疗提供有价值的线索。
[1] Bruix J,GoresGJ,Mazzaferro V.Hepatocellular carcinoma:clinical frontiers and perspectives[J].Gut,2014,63(5):844-855.
[2] Ksiazkiewicz M,Markiewicz A,Zaczek AJ.Epithelial-mesenchymal transition:ahallmark inmetastasis formation linking circulatingtumor cellsand cancer stem cells[J].Pathobiology,2012,79(4):195-208.
[3] GuarinoM.Epithelial-mesenchymal transitionand tumour invasion[J]. Int JBiochem Cell Biol,2007,39(12):2153-2160.
[4] Yu M,Bardia A,Wittner BS,et al.Circulating breast tumor cells exhibitdynamic changesinepithelialandmesenchymalcomposition[J]. Science,2013,339(3119):580-584.
[5] Schramm A,Mueller V,Huober J,et al.P176 The DETECT-study concept-circulating tumor cells(CTCs)inmetastatic breastcancer[J]. Breast,2015,24:85-86.
[6] Tu Q,Wu X,Le Rhun E,et al.CellSearch technology applied to the detection and quantification of tumor cells in CSF of patients with lung cancer leptomeningealmetastasis[J].Lung Cancer,2015,90(2):352-357.
[7] Li Y,Zhang X,Ge S,et al.Clinical significance of phenotyping and karyotyping of circulating tumor cells in patientswith advanced gastric cancer[J].Oncotarget,2014,5(16):6594-6602.
[8] Riethdorf S,Fritsche H,Müller V,et al.Detection of circulating tumor cells in peripheral blood of patients with metastatic breast cancer:a validation study of the CellSearch system[J].Clin Cancer Res,2007,13(3):920-928.
[9] 蒋蔚峰,张贺龙.外周血循环肿瘤细胞检测的研究进展[J].临床肿瘤学杂志,2010,15(10):944-947.
[10] Wu S,Liu S,Liu Z,et al.Classification of circulating tumor cells by epithelial-mesenchymal transition markers[J].PLoSOne,2015,10(4):e0123976.
[11] Sun YF,Xu Y,Yang XR,etal.Circulating stem cell-like epithelial cell adhesion molecule-positive tumor cells indicate poor prognosis of hepatocellular carcinoma after curative resection[J].Hepatology,2013,57(4):1458-1468.
[12] Chang K,Kong YY,Dai B,et al.Combination of circulating tumor cellenumeration and tumormarkerdetection in predicting prognosis and treatment effect in metastatic castration-resistant prostate cancer[J].Oncotarget,2015,6(39):41825-41836.
[13] Klein CA.Parallelprogression ofprimary tumoursandmetastases[J]. Nat Rev Cancer,2009,9(4):302-312.
[14] Hou JM,Krebs M,Ward T,et al.Circulating tumor cells as a window onmetastasisbiology in lung cancer[J].Am JPathol,2011,178(3):989-996.
[15] Sun W,LiG,Wan J,et al.Circulating tumor cells:A promising marker of predicting tumor response in rectal cancer patients receiving neoadjuvantchemo-radiation therapy[J].Oncotarget,2016.[Epub ahead of print].
[2016-11-07收稿][2017-01-14修回][编辑 江德吉]
Detection and classification of circulating tumor cells in hepatocellular carcinoma patients and their clinical significance
Qi Lunan1,2,Xiang Bangde1,2,Wu Feixiang1,2,Ma Liang1,2,Chen Zushun1,2,Ye Jiazhou1,2,Li Lequn1,2,3(1Department of Hepatobiliary Surgery,Affiliated Tumor Hospital of Guangxi Medical University;2Guangxi Liver Cancer Diagnosis and Treatment Engineering and Technology Research Center;3Key Laboratory of High-Incidence-Tumor Early Prevention and Treatment,Ministry of Education,Nanning 530021,P.R.China)
Li Lequn.E-mail:Li_lequn@263.com
Objective To explore the distribution of circulating tumor cells(CTCs)in hepatocellular carcinoma(HCC)patients and to analyze their relationship with HCC clinical stage and prognosis after surgery.M ethods CanPatrolTMCTC-enrichment and in situhybridization(ISH)were used to isolate,identify and classify CTCs from the blood of 112 HCC patients and 20 healthy donors.Blood was collected from HCC patients at 1 or 2 days before resection as well as 8-10 days after resection.Results CTCs were detected in 101(90.18%)HCC patients but not in any of the healthy donors.CTCswere classified into five subpopulations based on EMTmarkers: epithelial CTCs(E-CTC),epithelial-predominant hybrid CTCs(E>M-CTC),epithelial/mesenchymal hybrid CTCs(E≈M-CTC),mesenchymal-predominant hybrid CTCs(M>E-CTC)and mesenchymal CTCs(M-CTC).CTC count and M-CTC percentagewere closely related to BCLC stage of HCC.The cut-off value of 16 for CTC count predicted early recurrence with sensitivity of 55.3%,specificity of 92.3%and AUC of 0.74.The cut-off value of 2%for M-CTC percentage predicted recurrence with sensitivity of 80.9%,specificity of 69.2%and AUC of 0.748.Tumor-free survival analyses indicated that patientswith both CTC count≥16 and M-CTC≥2%showed significantly lower tumor-free survival than patientswith both CTC count<16 and M-CTC<2%and patientswith only CTC count≥16 or M-CTC≥2%.Postoperative levels were measured in all 112 patients at 8-10 days following resection.CTC count dropped after surgery,whereas M-CTC percentage increased.Patients in whom M-CTC percentage increased,showed significantly shorter tumor-free survival than patients in whom M-CTC percentage decreased or stayed the same(P<0.05).In 10 patientsmonitored postoperatively for CTC changes,8 displayed an increase in CTC count at 1-2months before recurrence or appearance ofmetastatic lesions.Conclusions CTCs were detected in a high percentage of HCC patients,including early-stage HCC patients,suggesting that tumor dissemination may be an early event.Patients with high CTC count and/or M-CTC percentage and patients in whom M-CTC percentage increased after surgery show lower tumor-free survival and worse prognosis.Postoperativemonitoring of changes in CTC counts after surgerymay allow early prediction of recurrence.
Liver neoplasms;Circulating tumor cells;Epithelial-mesenchymal transition;Recurrence;Metastasis;Prognosis
R735.7
A
1674-5671(2017)01-06
10.3969/j.issn.1674-5671.2017.01.11
国家自然科学基金青年基金资助项目(81502533);广西科学基金青年基金资助项目(2013GXNSFBA019196)
黎乐群。E-mail:Li_lequn@263.com

