响应面分析优化蒽酮硫酸法测定葡萄叶片中可溶性糖的含量
徐美蓉,李晓蓉,李婷
摘要:测定葡萄叶片中的可溶性糖,對葡萄叶片可溶性糖提取条件进行了比较;利用响应面法(RSM)对测定可溶性糖含量的蒽酮-硫酸显色方法参数进行优化,并得到回归模型。结果表明,葡萄叶片可溶性糖提取的最佳提取剂为水,采用21.9%乙酸锌和10.6%亚铁氰化钾可以最大限度的去除共提物干扰,确定检测波长为625 nm。用0.2 mg/mL蒽酮-硫酸试剂12 mL,在沸水浴中加热12 min。在此条件下测定的可溶性糖平均含量为2.54%~6.93%,精密度实验RSD为0.68%~0.81%,平均加标回收率99.4%,RSD=2.7%(n=3)。
关键词:葡萄叶片;可溶性糖;蒽酮-硫酸法;响应面法
中图分类号:S132 文献标志码:A 文章编号:1001-1463(2017)11-0025-05
doi:10.3969/j.issn.1001-1463.2017.11.008
Determination of Soluble Sugar from Grape Leaves by Optimizing of
Anthrone-Sulfuric Acid Method by Response Surface Methodology
XU Meirong, LI Xiaorong, LI Ting
(Institute of Agricultural Quality Standards and Detection Technology, Gansu Academy of Agricultural Sciences, Lanzhou Gansu 730070, China)
Abstract:An anthrone-sulfuric acid method for the extraction of soluble sugar from grape leaves is optimized using response surface methodology (RSM). The result indicates the optimum extraction agent of soluble sugar glucose is water, adding 21.9% zinc acetate and 10.6% potassium ferrocyanide could not interfere with co-extract extremely, and detection wavelength is 625 nm. In addition, we suggest 12 mL of 0.2 mg/mL anthrone-sulfuric acid agent should be added and perform water-bathing for 12 min. on the basis of the conditions, the content of soluble sugar is found in the range of 2.54~6.93%, the relative standard deviation (RSD) ranged from 0.68% to 0.81%, and the average recovery is 99.4% (RSD=2.7%, n=3).
Key words:Grape leaves;Soluble sugar;Anthracenone-sulfate method;Response surface method (RSM)
葡萄在我国属于六大水果之一,在果树种植中有着举足轻重的作用[1 - 2 ]。可溶性糖不仅是高等植物的主要光合产物,而且是碳水化合物代谢和暂时贮藏的主要形式。在研究葡萄果实生长发育的过程中,掌握整个植物体内可溶性糖含量变化,特别是叶片的可溶性糖含量变化,有助于了解其光合性能和糖份及干物质积累等过程[3 - 7 ]。一般以葡萄糖作为可溶性糖的测定指标,其测定方法主要有蒽酮-硫酸法[8 ]、苯酚-硫酸法[9 ]、3,5-二硝基水杨酸比色法[10 ]和铁氰化钾法[11 ]等。3,5-二硝基水杨酸比色法适用于直接测定植株中还原糖。苯酚-硫酸法测定时影响因素较多,苯酚试剂见光或遇氧即逐渐氧化成淡红色,而且加入试剂反应剧烈,容易溅出,往往导致结果偏差[12 ]。铁氰化钾法操作繁琐,整个操作过程需要在微沸状态下进行,试剂的滴定速度、加热时间、热源稳定程度等对测定结果的准确度都有很大的影响[9 ]。蒽酮-硫酸比色法则显色稳定、重现性好、操作简便、结果稳定。目前对葡萄叶片可溶性糖含量测定的报道并不多见。我们对葡萄叶片中可溶性糖的含量进行了测定,并通过优化前处理提取条件,利用响应面法对蒽酮-硫酸比色法测定条件进行了进一步的优化,以期准确测定葡萄叶片中可溶性糖的含量,为实现葡萄高产、优质栽培及其副产品的开发提供参 考。
1 材料与方法
1.1 材料与设备
供试葡萄鲜叶片采自甘肃省农业科学院林果花卉研究所葡萄园。用烘箱低温烘干至恒重,粉碎过40目筛,放入封口袋备用。所用试剂有葡萄糖、蒽酮、浓硫酸、乙醇、丙酮,葡萄糖为GR,其余试剂均为AR。纯水三级。实验仪器主要有瓦里安Cary50紫外-可见分光光度计、AG204分析天平(上海梅特勒-托利多仪器有限公司提供)、高速离心机、水浴锅。
1.2 实验方法
1.2.1 葡萄糖标准溶液的配制 准确称取105 ℃干燥至恒重的葡萄糖250 mg,混匀后用蒸馏水溶解并定容至250 mL,得到浓度为1.0 mg/L的葡萄糖标准品溶液,待用。
1.2.2 蒽酮试液的配制 精密称取蒽酮0.2 g,加入85%浓硫酸溶液中,完全溶解后定容至100 mL,放于棕色瓶内,现用现配。
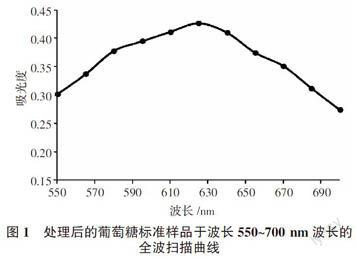
1.2.3 测定波长的选择 吸取一定体积的葡萄糖标品溶液,经蒽酮-硫酸比色法处理,用紫外分光光度计在波长550~700 nm进行全波长扫描,以最大吸收值确定检测波长。
1.2.4 标准曲线的绘制 依次吸取葡萄糖标准溶液0、1.00、3.00、5.00、7.00、9.00 mL,置于100 mL容量瓶内,定容。分别吸取标准溶液2.0 mL,在冰水浴中缓缓加入12.0 mL的蒽酮试剂,100 ℃水浴反应12 min,迅速冷却,室温放置20 min,待显色稳定后测定吸光度,绘制标准曲线。
1.2.5 样品测定方法 准确称取烘干粉碎的葡萄叶片0.500 0 g,放入50 mL塑料离心管,置于80 ℃水浴中,用一定体积提取液提取30 min,取出离心,收集提取液于量杯中。用此方法对残渣重复提取2次,使糖提取完全。加入去干扰剂后定容,过滤,待测。
1.2.6 提取剂的选择 由于可溶性糖易溶于水及乙醇,因此 GB/T 5009.7-2008、GB/T 5009.8-2008、GB/T 5513-2008 以及一些糖的测定方法中,用于糖的提取溶液最常用是水和80%乙醇。选取处理好的葡萄叶片,分别用水和80%乙醇提取,进行测定可溶性糖的比较试验,方法同1.2.5。
1.2.7 去干扰剂的选择 蒽酮比色法产生的糖醛显色反应,往往会受到样品共提物的影响,所以在植物样品提取,特别是从含有较多色素以及蛋白质的样品中提取可溶性糖,需要去干扰剂。根据国标以及其他文献,采用21.9%乙酸锌和10.6%亚铁氰化钾(A)、30%硫酸锌和16%亚铁氰化钾(B)、酸洗活性炭(C)3种组合进行对比试验,测定方法同1.2.5。
1.2.8 单因素试验设计 用一定浓度的葡萄糖标准溶液对蒽酮显色反应中的试剂用量、显色时间、显色温度因素进行实验比对,以吸光度为指标,确定各因素对结果的影响。
①蒽酮试剂用量的选择 分别取0.3 mg/mL的标准品溶液2 mL,置于8支10 mL的具塞试管中,分别加入0.2 mg/mL的蒽酮试剂10.00、10.50、 11. 00、11.50、12.00、12.50、13.00、13.50 mL,于100 ℃水浴中反应10 min,冷却至室温,静置20 min,于625 nm下测定吸光值。
②显色温度的选择 按①步骤,在4支试管中加入蒽酮试剂12.00 mL分别在25、50、75、100 ℃水浴中进行显色反应10 min,冷却,静置,测定吸光值。
③显色时间的选择 按①步骤,在试管中加入蒽酮试剂12.00 mL,在100 ℃水浴中加热4、6、8、10、12、14、16 min,冷却,静置,测定吸光值。
1.2.9 响应面实验 依据1.2.8实验结果,采用Design Expert 8.0软件设计进行三因素三水平响应面试验方案,优化可溶性糖含量测定条件。
2 结果与分析
2.1 测定波长的确定
吸取葡萄糖标准溶液2.00 mL,经1.2.4进行显色反应,在550~700 nm处扫描(图1)。可以看出,在(625±1) nm处吸收值最大,因此确定测定波长为625 nm。
2.2 葡萄糖标准曲线
以标准溶液浓度(X)为横坐标,以吸光度(Y)为纵坐标进行线性回归,得标准曲线如图1所示。线性方程为Y=0.0082X+0.0296,R2=0.9994。结果表明,糖含量在0~0.9 mg/mL范围内与吸光度的线性关系良好。
2.3 提取液的比较
水和80%乙醇提取液实验结果如表1所示。可以看出,2种提取液测定的葡萄叶片可溶性糖的结果相差不大,3次平行测定的结果差值为0.13%,低于算數平均值的10%。因此,对于葡萄叶片中可溶性糖的提取,水和80%乙醇提取结果无明显差别,均可作为提取液。考虑到实验成本,我们选择用水做提取液。
2.4 去干扰剂比较
通过图3可以看出,通过对21.9%乙酸锌和10.6%亚铁氰化钾(A)、30%硫酸锌和16%亚铁氰化钾(B)、酸洗活性炭(C)对可溶性糖的测定结果的比较,酸洗活性炭的测定结果明显低于其他2种,因为酸洗活性炭(C)在去除色素方面具有一定优势,但含有其它共提物时,去除效果并没有组合沉淀剂好,并且在实验过程中,最后处理过的提取液还有一定的浑浊,易导致结果偏低。而乙酸锌-亚铁氰化钾(A)沉淀速度快速、易混匀,故选用硫酸锌-亚铁氰化钾作为测定葡萄叶片可溶性糖的沉淀剂。
2.5 单因素实验
2.5.1 蒽酮试剂用量 显色温度为100 ℃,反应时间为10 min时,蒽酮试剂用量对吸光值的影响结果见图4。可以看出,随蒽酮试剂用量增加,吸光值呈先增高后递减趋势,说明蒽酮试剂用量不够;反应没有达到完全;当用量到12 mL时,吸光值达到最大,蒽酮试剂用量再继续增加反而使吸光值有明显的降低,因此,初步选择蒽酮试剂用量为12 mL。
2.5.2 显色温度 通过图5可以看出,蒽酮试剂用量为12 mL、反应时间为10 min时,随着显色温度的升高,吸光值逐步增加。综合考虑显色温度对吸光值的影响,显色温度定为100 ℃。
2.5.3 显色时间 蒽酮试剂用量为12 mL、显色温度为100 ℃时,显色时间对吸光值的影响见图6。可以看出,显色时间在12 min以前时,随着时间增加吸光值不断增加,超过12 min后吸光值有明显的降低,因此,确定显色时间12 min左右为最佳。
2.6 响应面优化分析
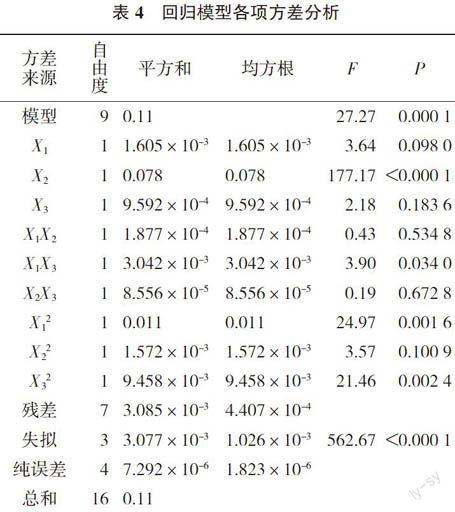
2.6.1 因素的选取及模型评价 以单因素试验结果为基础,根据Box-Behnken中心组合实验设计,采用3因素3水平共17个实验点(5个中心点)的响应面分析实验设计(表2)。通过实验数据(表3)可以看出,利用Design-Expert 8.0软件对表3数据进行二次多项式逐步回归拟合,得到数学模型Y=0.12-0.014X1+0.099X2-0.011X3+0.006 85X1X2- 0.028X1X3+0.004 525X2X3-0.051X12-0.019X22-0.049X32。从方差分析结果(表4)和各项系数显著性检验结果可知,模型的F=9.28、P=0.000 1(注:P < 0.05为差异显著,P < 0.01为差异极显著),说明本实验所采用的二次模型显著。模型的X2、X1X3、X12、X32的P值均小于0.05,说明显色温度、蒽酮试剂用量和显色时间的交互项、蒽酮试剂用量和显色时间的二次项都具有显著影响;决定因素R2值为0.972 3,说明模型能够很好的反应响应值的变化,拟合度好。各关系的效应关系为显色温度 > 蒽酮试剂用量 > 显色时间。
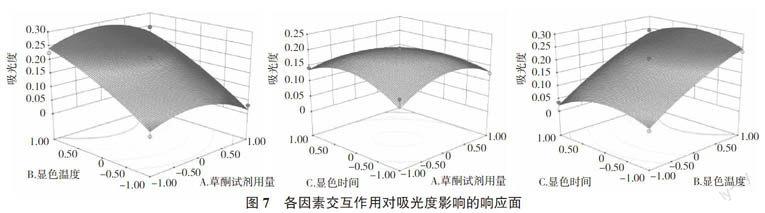
2.6.2 响应面分析 通过图7可以看出,当蒽酮试剂用量和显色时间都固定时,吸光值随显色温度的变化幅度较大,而随着蒽酮试剂用量以及显色时间的变化幅度相对较小,所以显色温度对吸光值的影响较为显著。通过最优化分析,确定的最佳测定条件为蒽酮试剂用量11.79 mL、显色温度99.79 ℃、显色时间11.26 min。考虑到实际操作的局限性,将实验条件修正为蒽酮试剂用量12 mL、显色温度100 ℃、显色时间12 min,以此条件做5次平行实验,测得吸光值平均为0.277 6,与预测值基本相符,证实了响应面法所得的回归方程的准确性和实用性。
2.7 实际样品测定
2.7.1 精密度与回收率实验 选择可溶性糖含量不同的葡萄叶片B、C,进行方法的精密度与稳定性实验,所得结果如表5。平行测定6次,实验结果的RSD值为0.68%~0.81%,均符合实验要求,表明本方法具有良好的精密度。
2.7.2 准确度与加标回收率实验 通过表6可以看出,加标回收率为97.5%~102.5%,平均加标回收率为99.4%,RSD值为2.7%,表明本方法的准确度较好。
2.7.3 葡萄叶片中可溶性糖含量 根据优化实验条件,测得不同批次葡萄叶片中的可溶性糖含量范围为2.54%~6.93%。
3 结论
通過对葡萄叶片可溶性糖提取及测定过程中的单因素条件,并在此基础上利用响应面法(RSM)对蒽酮-硫酸测定方法进行优化。得出葡萄叶片可溶性糖含量的测定方法是提取剂为水,用21.9%乙酸锌和10.6%亚铁氰化钾作为去除显色干扰物沉淀剂,定容过滤,吸取2 mL滤液,加入0.2 mg/mL蒽酮-硫酸试剂12 mL,在沸水浴中加热12 min,冷却后在波长 625 nm 处测定其吸光度。
在最优条件下,得到蒽酮-硫酸法测定葡萄叶片可溶性糖含量的精密度实验RSD为0.68%~0.81%,平均加标回收率 99.4%,RSD=2.7%(n=3)。用该方法测得不同时期葡萄叶片中可溶性糖的平均含量为2.54 %~6.93%。该方法测定葡萄叶片中可溶性糖含量,结果稳定可靠。
参考文献:
[1] 张致玺,张 琰,甘全善. 砧木对葡萄嫁接苗成活率的影响[J]. 甘肃农业科技,2013(8):8-10.
[2] 巨智强,成自勇,王 栋,等. 水分胁迫对红地球葡萄生理生长的影响[J]. 甘肃农业科技,2015(2):42-45.
[3] 徐惠风,金研铭,张春祥,等. 向日葵叶片可溶性糖含量的研究[J]. 吉林农业大学学报,2000,22(1):23-25.
[4] 陈立松,刘星辉. 水分胁迫对荔枝叶片糖代谢的影响及其与抗旱性的关系[J]. 热带作物学报,1999,20(2):31-35.
[5] WANG Z C,STUTE G W. The role of carbohyd rates in active osmotic adjustment in apple under water stress[J]. J. Amer. Soc. Hort. Sci.,1992,117:816-823.
[6] 刘 华. 盐胁迫下对碱茅生长及碳水化合物含量的影响[J]. 草业学报,1997,14(1):18-19.
[7] 姜 东,于振文,李永庚,等. 冬小麦叶茎可溶性糖含量变化与籽粒淀粉积累的关系[J]. 麦类作物学报,2001,21(3):38.
[8] 中国科学院上海植物生理研究所,上海市植物生理学会. 现代植物生理学实验指南[M]. 北京:科学出版社,1999.
[9] 黄生权,敖 宏,郭爱玲. 真菌保健食品中多糖含量测定方法的比较[J]. 现代食品科技,2010,26(7):767-771.
[10] 丛峰松. 生物化学实验[M]. 上海:上海交通大学出版社,2005.
[11] 李凤玉. 用铁氰化钾法测定王浆中总糖的含量[J]. 养蜂科技,2005(3):5-6.
[12] 魏晓明,符 红,万幼平. 硫酸蒽酮比色法测定鹿龟酒中多糖的含量[J]. 中成药,2000,22(5):380-382.
(本文责编:陈 伟)

