甘蔗内标基因PCR检测技术研究
肖乃衍 林冰 刘迪 陈平华 许跃语 施桂姣 王恒波 郭晋隆 高三基 许莉萍 陈如凯


摘 要 克隆鉴定甘蔗内源低拷贝基因鲜有研究,影响转基因甘蔗精确鉴定。根据其他作物已有的内标基因和内源低拷貝基因,按照内标基因的物种特异性和通用性原则,用12个有代表性甘蔗栽培品种对11个候选基因进行筛选与鉴定,获得了甘蔗特有的内源低拷贝基因,并以该基因建立了甘蔗内标基因PCR检测技术体系,为转基因甘蔗的精确检测和转基因标准的制定奠定了基础。
关键词 甘蔗;内标基因;鉴定;PCR检测技术
中图分类号 S566.1;Q78 文献标识码 A
Abstract Cloning and identification of endogenous low copy gene in sugarcane has been rarely reported, which affects the accurate determination of the transgenic sugarcane. Low copy endogenous genes of sugarcane were identified referring to the known endogenous reference genes and low copy endogenous genes of other crops. Eleven candidate genes were tested with twelve representative sugarcane cultivars based on the principles of species specific and universal existence. PCR protocol to amplify the low copy endogenous gene was set up subsequently, which contributes to identify transgenic sugarcane plants precisely and lays the foundation for development of relevant detection standards.
Key words sugarcane; endogenous reference genes; determination; PCR detection technology
doi 10.3969/j.issn.1000-2561.2017.03.019
目前,转基因作物的推广已给全世界带来了巨大的社会效益和经济效益[1],为了检测转基因作物的需要,农业部制订了一系列标准。甘蔗(Saccharum officinarum)转基因研究也越来越多,涉及增加蔗糖分积累和蔗茎产量、增强抗病能力、提高抗逆性等方面[2-5],但迄今为止,尚没有制订一例转基因甘蔗检测标准。农业部制订的转基因检测标准大部分是定性PCR检测标准。定性PCR是检测转基因植物常用的方法,具有快速、灵敏等优点,能够有效扩增低拷贝的靶片段DNA[6]。影响PCR检测效果的因素有很多,如PCR反应程序、退火温度、Taq酶质量等,通过设立对照可以有效检验这些因素合适与否。但样品DNA质量却难以通过设立对照的方式来解决,因为常用紫外分光光度计测定OD260/OD280比值的方法来衡量DNA质量并把1.8作为纯DNA的理论值,而OD260和OD280只是测定溶液中核酸和蛋白质的含量,其他物质的含量情况不得而知。抑制或干扰PCR反应的物质很多,如蛋白酶、有机溶剂、表面活性剂、盐类、络合物、金属离子、多糖以及酸类物质等,这些物质是OD260/OD280比值所不能反映的。这就是有些经测定纯度很高的DNA样品在PCR测定中结果却很差的主要原因。逐个测定和去除这些抑制物需要耗费大量的时间和试剂,显然不可取。目前研究人员已经在某些作物上找到解决办法,即鉴定该物种特有的低拷贝基因并作为内标基因建立PCR检测方法,在目的基因PCR检测前先对DNA样品进行内标基因PCR检测,根据内标基因扩增效果判定待检DNA质量是否满足准确测定目的基因的要求。多数主要作物的内标基因已被克隆并在转基因检测中得到应用,如水稻的SPS[7]、gos9[8]基因,玉米的IVR[9]、zSSIIb[10]基因等,大豆的Lectin[9]、β-actin[11]基因等。但到目前为止,尚未有甘蔗内标基因被克隆鉴定,一个主要原因是:与上述整倍体植物不同,甘蔗是高度杂合的异源多倍体植物,其遗传背景非常复杂,筛选和鉴定甘蔗内源低拷贝基因比较困难。本研究试图通过内源低拷贝基因筛选鉴定,建立起甘蔗内标基因PCR检测方法,为甘蔗转基因检测标准的制订奠定基础。研究结果对于甘蔗DNA样品质量判定和转基因甘蔗准确鉴定具有重要意义。
1 材料与方法
1.1 材料
1.1.1 甘蔗品种 甘蔗栽培品种是由甘蔗属中5个种即热带种、大茎野生种、细茎野生种、印度种和中国种中的几个种杂交而来的。由于甘蔗本身遗传背景非常复杂,为了使实验材料具有代表性,参考各实验材料的亲本血缘,选取中国甘蔗主产区12个不同栽培品种(系)为材料,分别是广西的柳城03-1137,广东的粤甘34、粤甘35,云南的云蔗04-241、云蔗05-51、云蔗06-407,福建的FN36、FN02-5707、FN39,江西的赣南02-70,台湾的ROC16、ROC22。其中云蔗04-241的父母本分别为ROC10、84-153;FN36的父母本分别为崖82-96、ROC1;ROC22的父母本分别为ROC5、69-435;粤甘34的父母本分别为ROC22、粤糖92-1287;云蔗05-51的父母本分别为ROC23、崖城90-56;FN39的父母本分别为CP84-1198、粤糖91-976;粤甘35的父母本分别为CP85-384和CP92-624、粤糖73-204;赣南02-70的父母本分别为CP84-1198、桂69-435;ROC16的父母本分别为F171、74-575;云蔗06-407的父母本分别为ROC25、粤糖92-70。以上品种的父母本覆盖目前生产上常用的杂交育种亲本材料,可以代表大多数甘蔗栽培品种的遗传背景。上述材料由福建农林大学甘蔗综合研究所提供。
1.1.2 内标基因 从国家转基因生物安全标准中查找到的已有转基因植物内标基因有:IVR[12]、Lectin[12]、18S rRNA[12]、SPS[13]。美国农业部以植物5S rRNA-ITS基因作为甘蔗内标基因[14]。
1.1.3 试剂 2×Premix Ex Taq酶、pMD18-T载体购自TaKaRa公司;胶回收试剂盒购自日本BioFlux公司;100 bp DNA Ladder、E.coli DH5α感受态细胞购自北京天根生化科技公司;SYBR Green PCR Master Mix购自美国ABI公司;PCR引物由上海生工生物工程技术服务有限公司合成;其他生化试剂为国产分析纯。
1.2 方法
1.2.1 已有转基因植物内标基因检测筛选 根据农业部科技发展中心编写的《农业转基因生物安全标准》以及国家技术监督局《1949.5.4-2004转基因产品检测核酸定性PCR检测方法》,检索其中已有转基因植物内标基因及其PCR检测引物序列和PCR反应体系,按照标准或文献中各参试基因定性PCR反应体系,在PCR反应管中依次加入各反应试剂,轻轻混匀,离心10 s后,将PCR管放入PCR仪中,按照扩增参数进行扩增反应。PCR产物的特异性和通用性分析:PCR产物的特异性就是要求PCR产物扩增只有单一的目的条带并达到一定浓度,PCR产物的通用性就是要求PCR产物在甘蔗栽培品种中都能有效扩增,并且扩增的条带符合特异性要求。利用入选的甘蔗品种DNA,对测试基因进行PCR扩增,通过对PCR产物条带的电泳分析判定测试基因是否符合内标基因的标准。制备含有EB的1.5%琼脂糖凝胶对PCR扩增产物进行电泳,用凝胶成像系统分析产物的特异性和通用性。胶回收目的片段,并进行克隆和测序。
1.2.2 已知低拷贝基因检测筛选 通过检索文献资料或登录GenBank检索已经克隆的植物低拷贝基因或者甘蔗的低拷贝基因,检索到已经克隆的植物低拷贝基因和基因序列有:ALS[15](登录号:EU243998.1)、UGPase[16](登录号:FJ536261.1)、vrn2[17](登录号:CA080033.1)、LeftsH6[18](登录号:DN193862.1)、LsD1[19](登录号:CA224873.1)、NCED1[20](登錄号:AY838901.1)。利用已有PCR检测引物或根据其序列用Primer Premier 5软件设计适合甘蔗的引物,计算引物适宜退火温度,建立PCR反应体系。参照1.2.1进行PCR产物特异性和通用性分析。
1.2.3 入选基因实时荧光定量PCR测试和拷贝数分析 采用两步法进行PCR扩增:Holding Stage:50 ℃ 2 min;95 ℃ 10 min;Cycling Stage:95 ℃ 1 s;60 ℃ 1 min;40 cycles;Melt Curve Stage:95 ℃ 15 s;60 ℃ 1 min;95 ℃ 30 s;60 ℃ 15 s。反应体系:DNA模板1.0 μL,SYBR Green PCR Master Mix 12.5 μL,上下游引物(10 μmol/L)各1.0 μL,加ddH2O使总体积为25.0 μL。实时荧光定量PCR引物扩增效率:将已知浓度的含目的基因质粒浓度调整到109 copies/μL,再依次稀释为108、107、106、105、104、103、102、101,然后作为模板进行实时荧光定量PCR反应,根据反应结果制作标准曲线,标准曲线以log10为横坐标,Ct值为纵坐标。如引物的扩增效率(E)大于0.8、扩增曲线相关系数(R2)大于0.95则认为曲线线性关系成立,所设计引物能够满足实时荧光定量PCR扩增的要求,可用于下一步甘蔗内源基因拷贝数分析。定量PCR反应中,为了避免引物二聚体干扰并保证引物扩增的效率,扩增的目的片段一般都不大,以200 bp左右为宜。把测得的各样品的Ct值代入标准曲线方程计算出目的基因拷贝数,再代入公式:拷贝数/{[6.02×1023×10-9×40/(7 740×106×660)]}得出基因在单个细胞基因组中的拷贝数。
1.2.4 入选基因定性PCR检测体系 为确定入选基因PCR检测体系的灵敏度,根据优化的入选基因定性PCR反应体系,将甘蔗基因组DNA浓度依次稀释为20、2、0.2、0.02、0.01、0.001 ng/μL,然后进行PCR反应,根据能够扩增出目的片段的最低甘蔗基因组DNA浓度高低,确定入选基因PCR反应的灵敏度。
1.2.5 入选基因PCR检测体系甘蔗物种特异性验证
为验证入选基因的物种特异性,以已经有转基因品种的典型作物如双子叶植物大豆、单子叶植物水稻、玉米等和甘蔗DNA为模板,利用优化的PCR反应体系同时进行入选基因PCR检测,根据PCR反应结果判定甘蔗入选基因PCR检测体系的物种特异性。
2 结果与分析
2.1 甘蔗材料的遗传背景和代表性分析
甘蔗育种的改良对象主要为栽培种,因此甘蔗栽培种的亲本材料在甘蔗育种中有着重要的作用。中国大陆目前大多数的甘蔗优良栽培品种是美国CP49-50、印度Co419和中国台湾F134等的后代,而Co419、F134等又是印尼爪哇POJ2878的后代[21]。本研究的甘蔗材料中,父本为F系列的有ROC16;父本为“ROC”系列的有云蔗04-241、ROC22、粤甘34、云蔗05-51、云蔗06-407;母本为“ROC”系列的有FN36;父本为美国CP系列的有FN39、粤甘35、赣南02-70。此外,考虑到中国不同蔗区的特点,又增加了主要蔗区常用育种亲本,如父母本分别为崖城系列的FN36和云蔗05-51;母本为粤糖系列的粤甘34、FN39、粤甘35、云蔗06-407;母本为桂糖系列的赣南02-70。以上受试品种的父母本不仅涵盖美国CP系列、中国台湾ROC和F系列,而且还有崖城系列、粤糖系列、桂糖系列等,基本可以代表目前生产上栽培品种的遗传背景。由此可以看出,本研究的试验材料具有较广泛的代表性,能够较好地反映甘蔗遗传背景的总体情况。
2.2 已有转基因植物内标基因检测筛选
2.2.1 PCR产物电泳检测与产物特异性和通用性分析 用表1中5个基因的引物对甘蔗DNA进行PCR检测,结果发现:SPS、5S rRNA-ITS、Lectin基因PCR扩增出多个条带(图1-A、B、C),其中SPS基因扩增出3个不同的高丰度带;5S rRNA-ITS基因个别甘蔗品种扩增出的非特异条带较亮;Lectin基因主扩增带长度偏离很大。这些现象主要是引物特异性不强造成的,因此,没有再进行体系优化研究。IVR基因PCR虽然只在部分材料中产生非特异条带,高丰度带也较单一,但条带大小介于200~300 bp且接近200 bp,与玉米已有IVR内标基因的226 bp大小一致,因已被鉴定、使用,故不再进一步研究(图1-D);18S rRNA(图1-E)PCR只扩增出1个条带并且所有受试甘蔗品种均能扩增出来,符合内标基因标准,但条带大小与棉花扩增条带大小一致。由于18S rRNA已作为棉花内标基因使用,不符合甘蔗物种特异性原则,不能作为甘蔗内标基因。
2.2.2 目的片段回收测序 为进一步验证18S rRNA PCR扩增的单一条带大小,对目的条带进行了回收测序,结果显示目的片段长度137 bp,序列长度与图1-E中电泳条带大小一致,两种方法结果相互印证。
2.3 已知低拷贝基因检测筛选
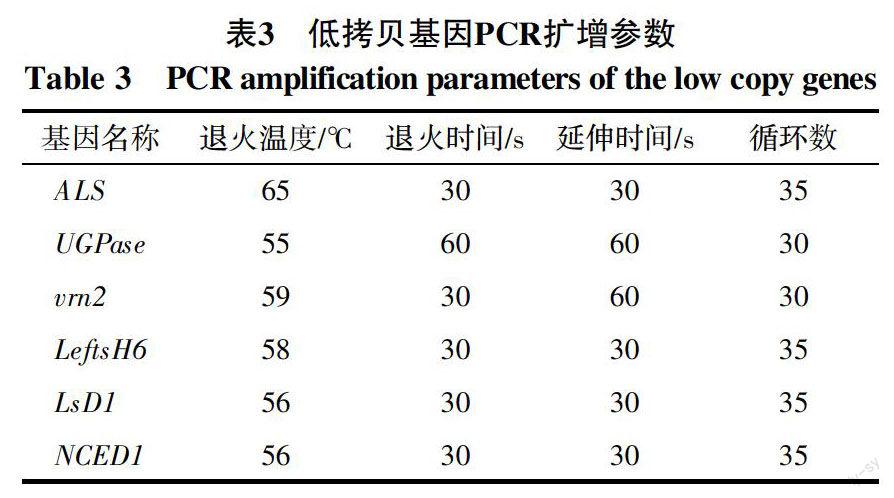
根据检索到的6个低拷贝基因ALS、UGPase、vrn2、LeftsH6、LsD1、NCED1的序列设计特异引物,引物序列及产物长度见表2,其PCR反应参数见表3。
2.3.1 PCR产物电泳检测与产物特异性和通用性分析 用ALS、UGPase、vrn2、LeftsH6、LsD1、NCED1的引物对甘蔗进行PCR检测,结果发现ALS基因引物PCR扩增只出现1个条带并且每个甘蔗品种均能扩增出同一条带,符合甘蔗品种通用性原则,结果见图2-A,扩增条带大小在100~200 bp之间,接近预期长度170 bp。该基因未作为内标基因使用,且在甘蔗上未进行过鉴定,值得进一步研究。NCED1基因引物扩增出一个主带,大小接近预期长度203 bp,但有一个弱的非特异扩增带,结果见图2-B。因已筛选到与预期目标一致的基因,未对该基因深入研究。其他基因中UGPase和LeftsH6未擴增出目的条带,vrn2和LsD1扩增出多个条带,不符合内标基因标准(图未列出)。
2.3.2 目的片段回收测序 对ALS基因PCR扩增的单一条带进行胶回收并测序,测序结果如下(5′-3′):
测序结果显示:ALS基因PCR目的片段长度171 bp,与图2-A中ALS基因PCR产物电泳条带长度一致。经Blast比对,从甘蔗上克隆的ALS基因序列与水稻ALS基因只有62%的同源性(登录号:XM_015779138.1、AP014960.1、AP014960.1),可见,利用甘蔗DNA为模板扩增到的ALS基因片段,其序列与水稻相比差异很大,说明该基因具有甘蔗物种特异性,符合内标基因物种特异性原则,但其在甘蔗基因组中的拷贝数未知,需要进一步研究鉴定。
2.4 ALS实时荧光定量PCR检测
利用表2中ALS基因PCR引物进行实时荧光定量PCR反应,绘制出ALS基因的标准曲线,结果引物的扩增效率(E)大于0.95,扩增曲线相关系数(R2)为0.999(见表4),表明该引物适用于ALS基因实时荧光定量PCR扩增的要求,可用于下一步甘蔗内源基因拷贝数分析。
2.4.1 实时荧光定量PCR溶解曲线 对实时荧光定量PCR溶解曲线的分析实质上是产物的特异性分析。如果溶解曲线为单峰则说明引物的特异性强,峰值高则说明PCR扩增效率好。ALS基因的实时荧光定量PCR溶解曲线为单峰,且峰值较高,说明引物特异性强,PCR扩增效率好(图3)。图中有12条PCR溶解曲线,每条PCR溶解曲线代表一个受试甘蔗品种。
2.4.2 ALS基因拷贝数分析 以12个受试甘蔗品种的DNA为模板,把模板浓度调整为20 ng/μL,进行实时荧光定量PCR反应,确定Ct值,然后按照ALS基因的标准曲线公式将12个甘蔗品种的Ct值代入,计算出其相应的拷贝数。然后按公式:拷贝数/{[6.02×1023×10-9×40/(7740×106×660)]}得出ALS基因在单个细胞基因组中的拷贝数,结果见表5。对表5的数据进行t检验,结果显示:ALS基因的样本均值为1.107,与1接近,t统计量为0.778,自由度为11,p值为0.453。由于p值大于显著水平0.05,所以接受ALS基因在甘蔗基因组中的拷贝数为低拷贝的原假设,推断ALS基因是单拷贝基因。
2.5 ALS基因定性PCR检测体系
表6是根据常见转基因检测标准设计的ALS基因定性PCR反应体系,按照优化的反应程序进行PCR反应:95 ℃变性5 min;进行35次循环扩增反应(94 ℃变性30 s,65 ℃退火30 s,72 ℃延伸30 s);最后72 ℃延伸5 min。反应结束后取出PCR反应管,对PCR反应产物进行电泳检测或在4 ℃下保存待用。
PCR产物电泳结果见图4,可以看到:当甘蔗基因组DNA浓度为0.2 ng/μL时仍然可以看到目的条带,但当浓度低于0.2 ng/μL就难以辨别目的条带了,可见要检测到甘蔗内源低拷贝基因,DNA浓度应在0.2 ng/μL以上。
2.6 甘蔗ALS基因PCR检测体系物种特异性验证
根据设计的验证入选基因物种特异性方法,以水稻、大豆、玉米、甘蔗DNA为模板,用ALS基因的引物(表2中ALS-F和ALS-R)进行PCR反应,结果只有甘蔗得到扩增,且PCR扩增产物很特异,亮度很强(图5)。其他已经有转基因品种的作物如双子叶植物大豆、单子叶植物水稻和玉米均未扩增出任何条带,这表明本研究利用甘蔗内源低拷贝基因ALS建立的 PCR检测体系可以从典型转基因作物中特异地鉴定出甘蔗。
3 讨论
实验材料的选择。基于不同的研究目标选取相应的实验材料。本实验选取的甘蔗实验材料基于三个原则:一是栽培品种,因为转基因目的是应用,受体材料用栽培品种才有更大利用价值。二是糖蔗,因为根据人们对转基因的敏感性,直接食用的果蔗很难获得环境释放;糖蔗作为工业原料则相对容易。三是材料要具有较广泛代表性。因为鉴定的是甘蔗栽培种内标基因,在甘蔗栽培种内要广泛存在。由于甘蔗本身遗传背景非常复杂,不同栽培种之间基因组大小差别就很大[22],为使实验材料具有代表性,既要考虑实验材料的血缘,能够代表大多数甘蔗栽培品种的遗传背景,同时也要考虑甘蔗的来源,覆盖较多的甘蔗不同产区才能进一步提高实验材料的代表性。本研究所选材料较好满足了上述要求。
基因拷贝数计算公式分析。在实时荧光定量PCR拷贝数分析中,先通过标准曲线计算出基因拷贝数,然后再采用公式:拷贝数/{[6.02×1023×10-9×40/(物种单个细胞的基因组大小×660)]}得出该基因在单个细胞基因组的拷贝数。公式中6.02×1023为阿伏伽德罗常数,660为4个脱氧核糖核苷酸(A、T、G、C)的平均分子量的2倍(双链),由于甘蔗基因组比较复杂,不同甘蔗品种间基因组大小差异较大,一般在7 500×106~11 780×106 bp之间,而80%的甘蔗高貴种的基因组大小在7 500×106~8 500×106 bp之间[23],本研究所用材料为栽培品种,因此以甘蔗高贵种平均基因组大小7 740×106 bp作为计算公式中的“物种单个细胞基因组大小”的值代入公式进行计算。从正文表5中拷贝数计算结果可以看出不同来源品种间存在差异,这与甘蔗学术界普遍认为不同甘蔗品种间基因组大小差异较大的看法一致,由于本研究取样具有较广泛的代表性,且样品数较多,多个样品的平均值就比较接近真值。
参试基因筛选鉴定的标准。对于参试的基因是否需要进行深入鉴定,一是要看测试基因是否符合内标基因标准,有3个基本要求,种间特异性、种内非特异性和恒定低拷贝数的特点[24],种间特异性指该基因在不同的物种间同源性极低,本研究在筛选过程中已充分考虑该要求;种内非特异性要求该基因在同一物种的不同品种中具有很高的同源性和稳定性,具体到本研究,要求PCR产物在甘蔗栽培品种中都能有效扩增;恒定低拷贝数指的是在同一物种拷贝数不变,一般为1~3个拷贝,单拷贝最佳。参试基因首先要符合上述3个要求。二是在测试基因符合内标基因标准的前提下,看测试基因PCR产物大小是否与已有内标基因相同,如果相同,说明不具备物种特异性要求,继续研究失去意义;如果该基因尚未被鉴定为内标基因,则可进一步鉴定。对于有明显单一条带的新基因,无论条带大小如何,都值得进一步研究鉴定。
参考文献
[1] 任志强, 肖建红, 杨慧珍, 等. 转基因植物在农业上的应用[J]. 安徽农业科学, 2016, 44(3): 109-110, 125.
[2] Guo J L, Gao S W, Lin Q L, et al. Transgenic sugarcane resistant to sorghum mosaic virus based on coat protein gene silencing by RNA interference[J]. BioMed Research International, Volume 2015(2015), Article ID 861907, 9 pages, http: //dx.doi.org/10.1155/2015/861907.
[3] 陈利平, 陈平华, 陈忠伟, 等. 甘蔗黄叶病毒与花叶病毒CP基因RNAi载体构建与转化甘蔗研究[J]. 热带作物学报, 2016, 37(1): 99-106.
[4] 王文治, 杨本鹏, 蔡文伟, 等. 抗除草剂bar基因与EPSPS基因在转基因甘蔗中的应用研究[J]. 生物技术通报, 2016(3): 73-78.
[5] 张 卓, 陈平华, 许莉萍, 等. 四价抗病虫除草剂RNAi植物表达载体构建与转化甘蔗研究[J]. 基因组学与应用生物学, 2014, 33(3): 661-673.
[6] Ahmed F E. Detection of genetically modified organisms in foods[J]. Trends in Biotechnology, 2002, 20(5): 215-223.
[7] Ding J Y, Jia J W, Yang L T, et al. Validation of a rice specific gene, Sucrose Phosphate Synthase, used as the endogenous reference gene for qualitative and real-time quantitative PCR detection of transgenes[J]. Journal of Agricultural and Food Chemistry, 2004, 52(11): 3 372-3 377.
[8] Hernandez M, Esteve T, Pla M. Real-time polymerase chain reaction based assays for quantitative detection of barley, rice, sunflower, and wheat[J]. Journal of Agricultural and Food Chemistry, 2005, 53(18): 7 003-7 009.
[9] Hurst C D, Knight A, Bruce I J. PCR detection of genetically modified soya and maize in foodstuffs[J]. Molecular Breeding, 1999, 5(6): 579-586.
[10] Tomoaki Y, Hideo K, Takeshi M, et al. Applicability of the quantification of genetically modified organisms to foods processed from maize and soy[J]. Journal of Agricultural and Food Chemistry, 2005, 53(6): 2 052-2 059.
[11] James D, Schmidt A M, Wall E, et al. Reliable detection and identification of genetically modified maize, soybean, and canola by multiplex PCR analysis[J]. Journal of Agricultural and Food Chemistry, 2003, 51(20): 5 829-5 834.
[12] GB/T 1949.5.4-2004轉基因产品检测核酸定性PCR检测方法[S]. 2004-04-13.
[13] 农业部953号公告-6-2007转基因植物及其产品成分检测抗虫转Bt基因水稻定性PCR方法[S]. 2008-03-01.
[14] Chen P H, Pan Y B, Chen R K. High-throughput procedure for single pollen grain collection and polymerase chain reaction in plants[J]. Journal of Integrative Plant Biology, 2008, 50(3): 375-383.
[15] 宋贵生, 冯德江, 魏晓丽, 等. 水稻乙酰乳酸合成酶基因的克隆和功能分析[J]. 中国农业科技导报, 2007, 9(3): 66-72.
[16] 张 杨, 隋正红, 丁弘叶, 等. 龙须菜UDP-葡萄糖焦磷酸化酶基因的克隆及其表达与琼胶产量的关系[J]. 中国海洋大学学报(自然科学版), 2011, 41(1): 80-86.
[17] 杨 , 徐碧玉, 金志强. 拟南芥春化基因vrn2的克隆及相关分析[J]. 热带作物学报, 2003, 24(2): 46-50.
[18] Sun A Q, Yang J Y, Yi S Y, et al. Cloning and molecular characteristic of the metalloprotease gene LeftsH6 from tomato[J]. Journal of plant physiology and molecular biology, 2006, 32(1): 64-72.
[19] 王丽娟, 田颖川, 何朝族. 新基因水稻OsLSD1的克隆及拟南芥和水稻类LSD1基因家族的生物信息学分析[J]. 生物化学与生物物理进展, 2005, 32(3): 268-274.
[20] 杨锦芬, 郭振飞, 杨 静. 柱花草9-顺式环氧类胡萝卜素双加氧酶基因(SgNCED1)的克隆及表达分析[J]. 草业学报, 2007, 16(3): 21-28.
[21] 陈如凯. 现代甘蔗遗传育种[M]. 北京: 中国农业出版社, 2011: 7-8.
[22] 郑成木. 甘蔗核型及其染色体数目变化的研究[J]. 热带作物学报, 1993, 14(1): 47-51,
[23] Zhang J S, Nagai C, Yu Q Y, et al. Genome size variation in three Saccharin species[J]. Euphytica, 2012, 185(3): 511-519.
[24]丁春燕, 沈 峰, 陆 敏, 等. 辣椒内标准基因及其在食品检测中的应用[J]. 浙江农业科学, 2014(1): 89-92.

