内生真菌HND5挥发性物质组分分析及其抑菌作用测定
陈奕鹏 杨扬 时涛 蔡吉苗 黄贵修

摘 要 HND5是从健康的臂形草叶片中分离得到的一株顶孢霉属(Acremonium sp.)内生真菌,可通过产生挥发性物质抑制病原菌生长。采用顶空固相微萃取技术(HS-SPME)提取富集了内生真菌HND5的挥发性有机物(VOCs),利用气相色谱-质谱联用法(GC-MS)进行了挥发性物质的组分分析,共分离鉴定得到14个单体化合物。活性分析发现,石竹烯(Caryophyllene)和4-乙烯基-1,2-二甲氧基苯(Benzene,4-ethenyl-1,2-dimethoxy-)具有抑菌活性,对峙试验表明2种物质均对尖孢镰刀菌(Fusarium oxysporum)、胶胞炭疽菌(Colletotrichum gloeosporioides)和多主棒孢菌(Corynespora cassiicola)具良好的抑制作用,其中石竹烯的有效中浓度(EC50)分别为2 916.07、729.54和404.23 μL/L,4-乙烯基-1,2二甲氧基苯的有效中浓度(EC50)分别为62.72、27.60和23.54 μL/L。
关键词 内生真菌;挥发性有机物;气相色谱-质谱联用;抑菌作用
中图分类号 S432.1 文献标识码 A
Abstract Endophytic fungi HND5 which was isolated from healthy leaves of Brachiaria sp. could inhibit many plant pathogens with volatile substances. In this article,solid phase micro-extraction(SPME)was used to collect volatile organic compounds(VOCs)produced by HND5 from the head space. And GC-MS was used to analyzed the volatile compounds of HND5. At last, 14 compounds were identified from VOCs produced by HND5. Within these compounds, Caryophyllene and Benzene, 4-ethenyl-1,2-dimethoxy- were found antagonistic against growth of Fusarium oxysporum, Colletotrichum gloeosporioides and Corynespora cassiicola. EC50 values of Caryophyllene were 2 916.07, 729.54 and 404.23 μL/L, respectively. And EC50 values of Benzene, 4-ethenyl-1,2-dimethoxy were 62.72, 27.60 and 23.54 μL/L, respectively.
Key words endophyte; volatile organic compounds; GC-MS; fungistasis
doi 10.3969/j.issn.1000-2561.2017.04.016
使用化学药剂是控制农作物病害的有效方法,但化学杀菌剂污染环境,诱导病菌抗性增强,破坏生态平衡及化学残留问题亦令人担忧,因此植物病害的生物防治研究越来越受到人们的重视。植物内生真菌(endophytic fungi)是指那些在其生活史的一定阶段或全部阶段生活于健康植物各种组织和器官内部或细胞间隙,并在植物组织内不引起明显组织变化的真菌[1]。研究表明内生菌可与宿主的长期共处,二者可形成互利的共生关系[2]。部分内生真菌可以在植物体内产生多种生物学反应,可以提供植物生长所需化学物质及激素[3],参与植物的防卫反应[4],促进植物快速增长[5],增强植物抗逆、抗病害、抗虫害的能力[6]。近年来,利用有益内生真菌进行植物病害的防治已成为研究热点,内生菌可以通过产生抗生素或其他次级代谢产物诱导或增加宿主防御机制或者直接抑制甚至杀死病原菌[7-8]。HND5是本实验室从珊状臂形草中分离获得的一株内生真菌,经形态学和分子鉴定,该菌属枝顶孢属(Acremoniu sp.)真菌[9],体外抗性分析实验结果表明,该菌株对多种重要病原真菌具有明显的抑菌活性,并能诱导宿主植物产生耐盐碱性[10]。且研究发现该菌株产生的挥发性有机物(VOCs)对多种重要病原真菌同样具有抑制作用[11],但关于VOCs种类及其具体活性物质等方面未见相关研究报道。
本研究采用顶空固相微萃取技术(HS-SPME)萃取了HND5产生的挥发性气体,采用气相色谱-质谱联用法(GC-MS)进行了其挥发性物质的组分分析,并以尖孢镰刀菌(Fusarium oxysporum)、胶胞炭疽菌(Colletotrichum gloeosporioides)和多主棒孢病菌(Corynespora cassiicola)3种常见的植物病原真菌为靶标菌,测定了石竹烯和4-乙烯基-1,2二甲氧基苯2种单体化合物对这3种病原菌菌絲生长的熏蒸抑制作用,为今后HND5应用于植物病害的生物防治以及相关农药制品的研发利用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 供试菌株 内生真菌HND5及植物病原真菌香蕉尖孢镰刀菌(Fusarium oxysporum)Foc4、节瓜胶胞炭疽菌(Colletotrichum gloeosporioides)T43和橡胶树多主棒孢菌(Corynespora cassiicola)CC01均由中国热带农业科学院环境与植物保护研究所提供。
1.1.2 培养基和试剂 菌株培养采用马铃薯葡萄糖琼脂培养基(PDA),配方参照方中达的方法[12]。石竹烯(98.5%)和4-乙烯基-1,2二甲氧基苯(工业纯)购自Sigma-Aldrich公司,其它试剂均为国产分析纯。
1.1.3 仪器设备 气相色谱Agilent 7890A、质谱Agilent 5975均为Agilent(Palo Alto,CA)公司产品;SPME探头(100 umol/L,PDMS)均购自Supelco(Bellefonte,PA);石竹烯(98.5%)和4-乙烯基-1,2二甲氧基苯(工业纯)均购自Sigma-Aldrich(Vienna,Austria)。
1.1 方法
1.2.1 挥发性有机物的吸附和解吸 挥发性有机物的吸附和解吸参照张冬静[13]的方法,并加以改进:在带橡胶塞的100 mL顶空瓶中倒入约30 mL PDA培养基制成斜面;将HND5菌株经平板活化后,接种至顶空瓶中,塞紧橡胶塞并用石蜡封口膜封口以保证顶空瓶的密封性,以不接HND5菌饼的PDA培养基为对照,置于28 ℃恒温培养7 d;将固相微萃取头在气相色谱仪进样口经250 ℃老化30 min后,将固相微萃取装置针头穿透橡胶塞插入试剂瓶内HND5菌落上方,固定好萃取装置的手柄,小心推出纤维头并计时,吸附30 min后取出并随即插入GC-MS进样口,250 ℃下热脱附3 min。
1.2.2 GC-MS分析 色谱条件:使用的色谱柱为Agilent HP-5MS;色谱程序:60 ℃ 2 min;10 ℃/min升至100 ℃;5 ℃/min升至180 ℃;10 ℃/min升至240 ℃;240 ℃保持5 min。质谱条件:EI 70 eV,离子源230 ℃,四级杆150 ℃,35~800 amu全扫描。
1.2.3 挥发性物质的熏蒸抑菌作用测定 挥发性物质对植物病原真菌菌丝生长的熏蒸抑制作用测定采用菌丝生长速率法[14],根据挥发性物质的使用剂量分别设5个浓度梯度处理,石竹烯每皿分别为10、20、40、80、160 μL(实际浓度分别为111.11、222.22、444.44、888.89、1777.78 μL/L);4-乙烯基-1,2-二甲氧基苯每皿分别为1、5、10、20、40 μL(实际浓度分别为11.11、55.56、111.11、222.22、444.44 μL/L),并以无菌水为空白对照,重复3次;5 d后观察病原真菌菌落生长情况,并采用十字交叉法测定其菌落直径,计算其抑制率。
抑菌率/%=(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)×100。
进行浓度计算时,将使用浓度(μL/皿)按以下公式换算成实际浓度(μL/L):实际浓度=(使用浓度×1 000 mL)/培养皿容积90 mL。计算浓度对数(x)与抑制菌落生长百分率的几率值(y),利用最小二乘法分别求得各杀菌剂对该菌的毒力回归方程y=a+bx和EC50。
2 结果与分析
2.1 内生真菌HND5挥发性有机物GC-MS分析
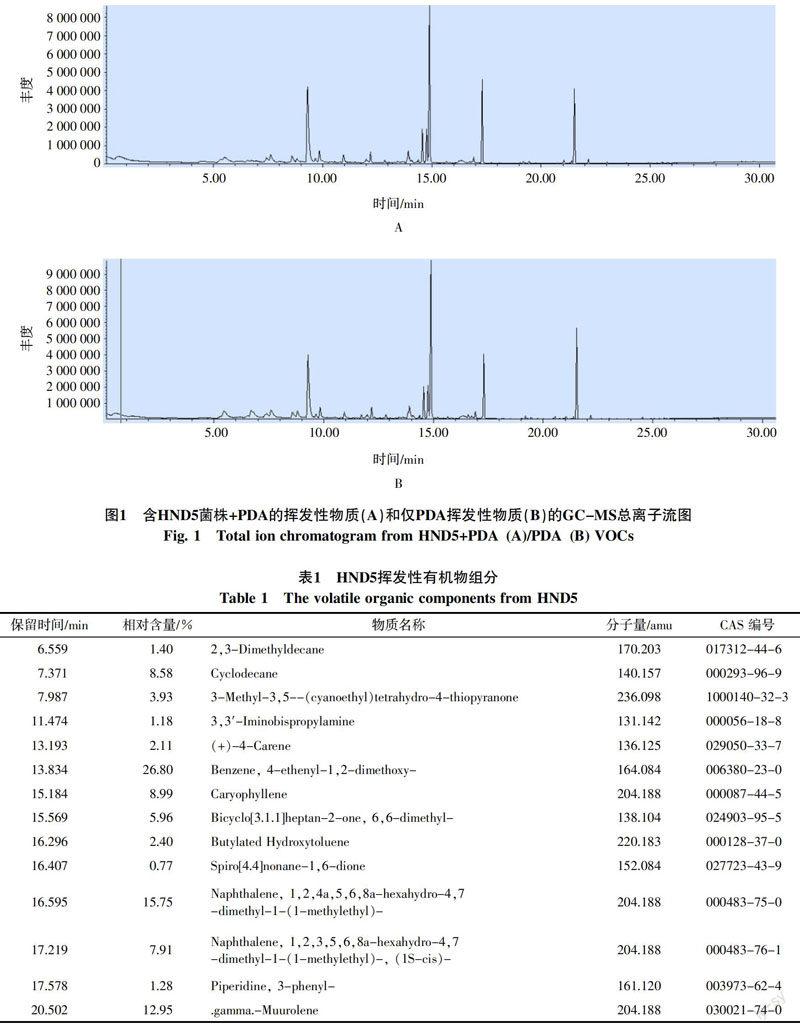
分别将萃取的含HND5菌株和PDA的挥发性有机物和仅有PDA挥发性有机物的SPME萃取头直接进样进行GC-MS分析,总离子流图见图1。利用色谱峰面积归一法测得各组分的相对含量,质谱图经NIST11质谱数据库检索,与标准图谱比对并结合化学物质登录号(CAS号)分析,按照CPS(counts per second)>105,鉴定可信度大于90%的标准,得到14种HND5产生的挥发性有机物(表1),可分为烷烃类(2种),烯烃类(4种),酮类(1种),芳香族化合物(3种),氨基丙胺类(1种),萘衍生物(2种),哌啶类(1种)。其中,4-乙烯基-1,2二甲氧基苯的同系物4-甲氧基苯乙烯曾被报道具有抗菌活性,萘衍生物的同系物也在Muscodor albus产生的抗菌挥发性物质中被发现,石竹烯也存在于多种中药挥发油中,关于其他挥发性物质的抗菌活性则少见报道[15,19,23]。据此,将对石竹烯、4-乙烯基-1,2二甲氧基苯和萘衍生物进行活性测定,但由于未能购置到相关试剂,仅使用石竹烯(Caryophyllene)和4-乙烯基-1,2二甲氧基苯2种物质的商品化纯品进行了后续实验。
2.2 内生真菌HND5挥发性有机物对病原真菌的熏蒸抑制作用
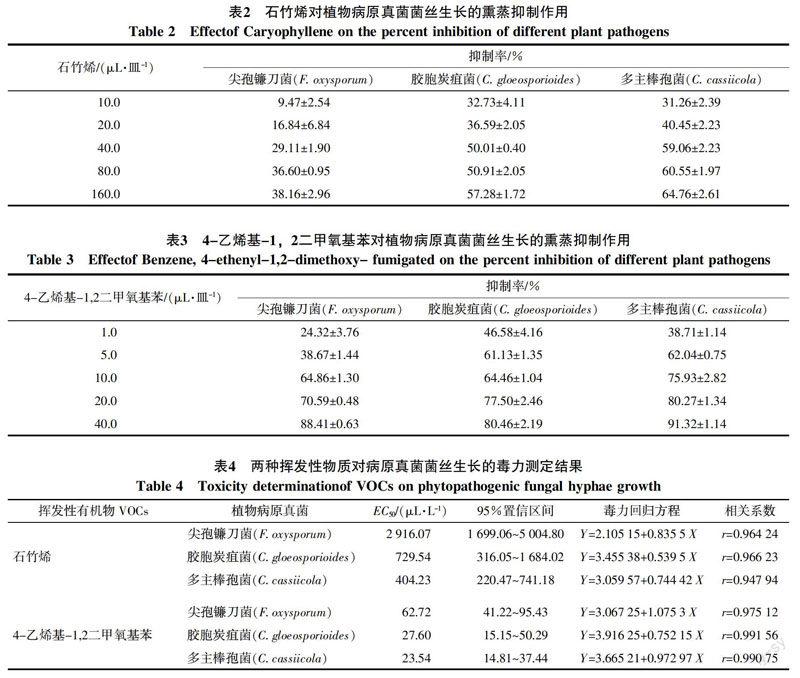
石竹烯(Caryophyllene)和4-乙烯基-1,2二甲氧基苯(Benzene,4-ethenyl-1,2-dimethoxy-)对3种病原真菌菌丝生长的抑制率见表2、表3和图2。从表2、表3可以看出,2种挥发性物质对供试菌株菌丝生长均具有一定抑制作用,且抑制作用均随剂量增加而增强,其中40 μL/皿石竹烯对胶胞炭疽菌和多主棒孢菌的抑制率即可达到50%以上;但其对尖孢镰刀菌的抑制效果相对较差,在160 μL/皿的剂量下其抑制率为38.16%。4-乙烯基-1,2二甲氧基苯的抑菌效果较石竹烯好,在5 μL/皿的剂量下其对胶胞炭疽菌和多主棒孢菌抑制率即可达到60%以上;在10 μL/皿的剂量下其对尖孢镰刀菌的抑制率也达到60%以上;在40 μL/皿的剂量下,该物质对3种病原菌的抑制率均达到了80%以上,其中对多主棒孢菌的抑制率達到了91.32%。
表4显示,2种挥发性物质对病原真菌的生长均具良好的抑制作用,其中石竹烯对多主棒孢病菌的抑制作用最强,EC50仅为404.23 μL/L;其次为胶胞炭疽菌,EC50为729.54 μL/L;对尖孢镰刀菌的抑制作用相对较弱,EC50为2916.07 μL/L。4-乙烯基-1,2二甲氧基苯对多主棒孢菌的抑制作用最强,EC50仅为23.54 μL/L;其次为胶胞炭疽菌,EC50为27.60 μL/L;对尖孢镰刀菌的抑制作用相对较弱,EC50为62.72 μL/L。
3 討论
HND5是分离自臂形草的内生真菌,根据形态与分子鉴定,该菌株属于顶孢霉属(Acremonium sp.)。前期的研究发现,该菌株具有促进香蕉植株生长、提高香蕉植株耐盐碱能力,能够有效抑制多种病原菌的生长,是一株良好的生防菌株。时涛等[11]发现HND5可以通过产生挥发性物质抑制多种植物病原菌的生长,但挥发性物质的具体种类与有效成分尚未明确。固相微萃取是研究菌株挥发性产物的新方法,由于萃取方法简单,时间短,是目前微生物挥发性有机物研究中最常使用的方法之一[15]。在本研究中,使用了顶空固相微萃取的方法收集HND5菌株的挥发性产物,结合GC-MS技术,全面并深入地分析了内生真菌HND5挥发性物质的种类,结果发现HND5共产生了14种挥发性物质,包括烯烃类芳香族,酚类。由于无法全部购买到商品化的纯品,只对2种物质石竹烯(占总物质产量8.99%)和4-乙烯基-1,2二甲氧基苯(占总物质产量26.80%)进行了活性鉴定,仅占总挥发性物质产量的35.79%,结果证明这2种物质对3种植物病原真菌均具有较好的抑菌活性。
石竹烯存在于许多具有抗炎、抑菌、抑制哮喘功能的中草药挥发油中[16]。同时,在很多具有抗菌功能的植物提取物中,也存在大量的石竹烯,如降香挥发油中石竹烯的含量占54.22%,红叶李茎挥发油中石竹烯占8.57%,海南黄芩挥发油中石竹烯占7.92%等等[17-19],但大多数研究仅分析了植物挥发油的抗菌活性,对其中的单体组分的活性没有进一步分析。本研究发现石竹烯具备一定的抗菌活性,由此推断石竹烯可能与一些植物挥发油的抗菌活性相关。4-乙烯基-1,2二甲氧基苯是HND5合成的分泌量最大的挥发性物质,占总量的26.80%,其抑菌活性也较石竹烯好,是HND5主要的挥发性抗菌物质。与石竹烯不同,4-乙烯基-1,2二甲氧基苯仅有少量同系物的相关抑菌活性报道。Wu等[20]曾在Streptomyce albulus NJZJSA2菌株中发现其同系物4-甲氧基苯乙烯具有拮抗尖孢镰刀菌FOC4的活性,该物质能破坏细胞膜,导致菌丝缢缩和细胞内容物外溢,孢子顶端也出现了穿孔等现象。和4-甲氧基苯乙烯相比,4-乙烯基-1,2二甲氧基苯抑菌活性更高,并具有更广的抑菌谱,具有进一步开发利用的良好前景。在没有进行活性鉴定的物质中,萘衍生物是主要的部分,共有2种,占总挥发性物质总量的23.66%。内生真菌Muscodor albus能够产生多种萘衍生物,抑制Pythium ultimum、Ustilago hordei和Fusarium solani等多种病原真菌[21]。衣兰油烯也是HND5挥发性物质的主要部分,占总量的12.95%,衣兰油烯经常在植物和中草药挥发油中被发现,如藿香、连翘、日本常山等等,但对其没有进行抑菌活性的相关研究[22-24]。
综上所述,本研究从内生真菌HND5产生的挥发性物质中得到了2种对多种病原真菌具有良好拮抗活性的单体组分,石竹烯和4-乙烯基-1,2二甲氧基苯,为之后香蕉枯萎病、瓜菜炭疽病、橡胶棒孢霉落叶病等植物真菌病害防治药剂的研发提供了前体和理论依据。此外,微生物代谢产生的挥发性物质的抑菌防病作用可能是一种或几种物质的单一行为,也可以是众多挥发物质协同作用下的群体效应。HND5产生的挥发性物质具良好的抑菌活性,亦可能是多种抑菌组分协同作用的结果,其具体的抑菌机理,也有待进一步研究分析。
参考文献
[1] Andrews J H, Hirano S S. Microbial ecology of leaves[M]. New York: Springer, 1991.
[2] Stone J, Bacon C W, White J F. An overview of endophytic microbes: Endophytism defined[M]. New York: Marcel Dekker Inc, 2000: 29-33.
[3] Teruyoshi Hashiba, Kazuhiko Narisawa. The development and endophytic nature of the fungus Heteroconium chaetospira[J]. FEMS Microbiology Letters, 2005, 252(2): 191-196.
[4] Herre E A, Mejía L C, Kyllo D A, et al. Ecological implications of anti-pathogen effects of tropical fungal endophytes and mycorrhizae[J]. Ecology, 2007, 88(3): 550-558.
[5] 易 婷, 缪煜轩, 冯永君. 内生菌与植物的相互作用: 促生与生物薄膜的形成[J]. 微生物学通报, 2008, 35(11): 1 774-1 780.
[6] Fiore S D, Gallo M D. Endophytic bacteria: their possible role in the host plant[M]. Berlin Heidelberg: Springer, 1995: 169-187.
[7] Strobel G, Daisy B. Bioprospecting for microbial endophytes and their natural products[J]. Microbiology & Molecular Biology Reviews, 2003, 67(4): 491-502.
[8] Strobel G, Daisy BCastillo U, Harper J. Natural products from endophytic microorganisms[Review][J]. Journal of Natural Products, 2004, 67(2): 257-268.
[9] 刘先宝, 郭志凯, 时 涛, 等. 内生真菌HND5分子鉴定及其生物学特性研究[J]. 中国农学通报, 2011, 27(27): 272-276.
[10] 郭志凯, 王 蓉, 蔡吉苗, 等. 臂形草内生真菌菌株HND5的分离、 抗性评价及其初步鉴定[J]. 热带作物学报, 2007, 28(2): 92-96.
[11] 时 涛, 黄贵修. 一株产生抑菌气体内生真菌的拮抗活性评价[J]. 湖北农业科学, 2011, 50(9): 1 803-1 805.
[12] 方中达. 植病研究方法[M]. 北京: 中国农业出版社, 1998: 46-47.
[13] 张冬静. 药用植物内生真菌的分离及其抑菌活性筛选[D]. 长春: 吉林大学, 2015.
[14] 陈利军, 智亚楠, 王国君, 等. 土荆芥花序和叶挥发油的抑菌作用及组分分析[J]. 植物保护, 2014(5): 40-43.
[15] Stoppacher N, Kluger B, Zeilinger S, et al. Identification and profiling of volatile metabolites of the biocontrol fungus Trichoderma atroviride by HS-SPME-GC-MS[J]. Journal of Microbiological Methods, 2010, 81(2): 187-193.
[16] 周成林, 钱之玉. β-石竹烯醇抑制哮喘豚鼠气道炎症及清除氧自由基作用[J]. 药物生物技术, 2006, 13(5): 373-376.
[17] 陈 欣, 陈光英, 陈文豪, 等. 海南黄芩挥发油成分分析及生物活性研究[J]. 热带农业科学, 2016, 36(5): 93-97.
[18] 卫 强, 纪小影. 红叶李的叶、 茎挥发油成分GC-MS分析及體外抗菌、 抗病毒活性研究[J]. 中药新药与临床药理, 2016, (2): 263-268.
[19]赵夏博, 梅文莉, 龚明福, 等. 降香挥发油的化学成分及抗菌活性研究[J]. 广东农业科学, 2012, 39(3): 95-96.
[20] Wu Y, Yuan J, E Y, et al. Effects of volatile organic compounds from Streptomyces albulus NJZJSA2 on growth of two fungal pathogens[J]. Journal of Basic Microbiology, 2015, 55(9): 1 104-1 117.
[21] Mitchell A M, Strobel G A, Moore E, et al. Volatile antimicrobials from Muscodor crispans, a novel endophytic fungus[J]. Microbiology, 2010, 156(1): 270-277.
[22] 孙建勋, 杨 飞, 王金梅, 等. 固相微萃取-气质联用法分析贵州产贯叶连翘叶挥发性成分[J]. 中国实验方剂学杂志, 2011, 17(11): 96-99.
[23] 王建刚. 藿香挥发性成分的GC-MS分析[J]. 食品科学, 2010, 31(8): 223-225.
[24] 赵 超, 程 力, 周 欣, 等. 固相微萃取/气相色谱/质谱法分析日本常山挥发性化学成分[J]. 精细化工, 2009(1): 21-23.

