翠柏二萜类成分及其抗炎活性研究
丁林芬 吴兴德 王双燕 涂文超 潘争红 郭亚东 宋流东
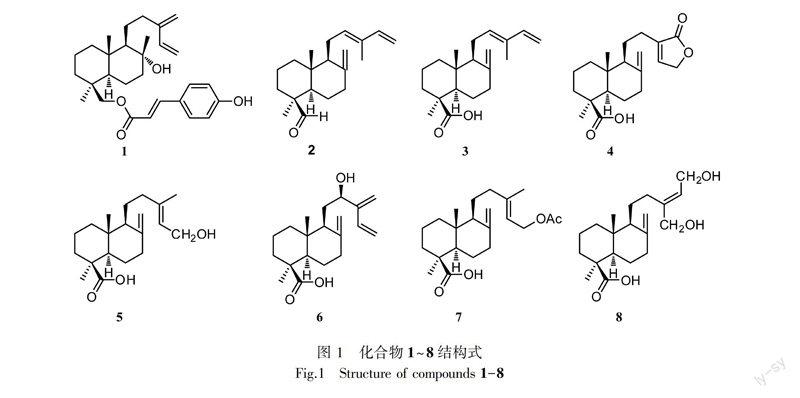

摘要: 采用正相硅胶、MCI、反相RP18和半制备液相等色谱技术, 对柏科翠柏属植物翠柏(Calocedrus macrolepis)中的二萜类成分及其抗炎活性进行了研究。结果表明:从中共分离得到8个二萜类化合物,分别鉴定为8hydroxylabda13(16),14dien19yl transcoumarate (1)、transcommunal (2)、transcommunic acid (3)、pinusolidic acid (4)、isocupressic acid (5)、fokihodgin F (6)、acetylisocupressic acid (7)、15,16dihydroxylabda8(17),13(E)dien19oic acid (8)。化合物1~8均为首次从该植物中分离得到。化合物7对LPS诱导的RAW264.7巨噬细胞释放NO具有显著的抑制作用,其IC50值为9.31 μmol·L1。
关键词: 柏科, 翠柏属, 翠柏, 二萜, 成分, 抗炎活性
中图分类号: Q946, R284.2
文献标识码: A
文章编号: 10003142(2017)05064206
Abstract: To study the diterpenoids from Calocedrus macrolepis and their antiinflammatory activities, the constituents were separated by silica gel, MCI, RP18, semipreparative HPLC and eight compounds were isolated. Their structures were characterized as: 8hydroxylabda13(16),14dien19yl transcoumarate (1), transcommunal (2), transcommunic acid (3), pinusolidic acid (4), isocupressic acid (5), fokihodgin F (6), acetylisocupressic acid (7), 15,16dihydroxylabda8(17),13(E)dien19oic acid (8). Compounds 18 were obtained from this plant for the first time. Among them, Compound 7 exhibited potent inhibitory effect on NO production in LPSinduced macrophages with IC50 values of 9.31 μmol·L1.
Key words: Cupressaceae, Calocedrus, C. macrolepis, diterpenoids, constituents, antiinflammatory activity
柏科(Cupressaceae)翠柏屬(Calocedrus)植物全球共2种和1变种,在我国分布的有翠柏(C. macrolepis)及其变种台湾翠柏(C. macrolepis var. formosana)。翠柏为常绿乔木,高大挺拔,树形优美,是极好的庭园树种,其树干可供建筑、桥梁、板料、家具等使用 (中国植物志编辑委员会,1978)。翠柏是一种古老的孑遗植物,1986年被《中国珍稀濒危植物名录》划定为国家三级保护植物,1999年《国家重点保护野生植物名录》将其列为国家二级保护植物,目前发现其主要分布于云南、贵州、广西及广东等地。翠柏属植物台湾翠柏的化学成分和药理作用研究较多(Hsieh et al, 2005, 2006, 2011),但关于翠柏化学成分的研究报道较少。王蕾等(2013)和Wu et al(2013)前期对翠柏进行初步化学成分研究,从中发现木脂素、萜类及酚类化合物。
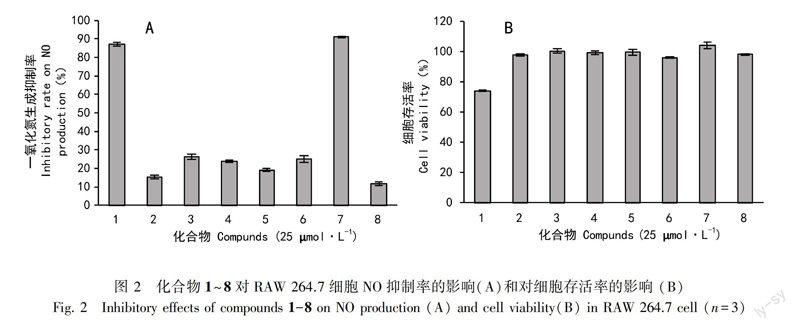
为了合理开发利用该植物,本课题组在前期的基础上继续对翠柏进行较深入的化学成分研究,从其95%乙醇提取物中分离得到8个二萜类化合物,分别鉴定为8hydroxylabda13(16),14dien19yl transcoumarate (1)、transcommunal (2)、transcommunic acid (3)、pinusolidic acid (4)、isocupressic acid (5)、fokihodgin F (6)、acetylisocupressic acid (7)、15,16dihydroxylabda8(17),13(E)dien19oic acid (8)。所有化合物均为首次从该植物中分离得到。同时,对分离得到的8个化合物进行抑制脂多糖(LPS)诱导RAW 264.7细胞释放NO活性测定,发现化合物7具有显著的抑制作用,其IC50值为9.31 μmol·L1,提示该植物具有潜在的抗炎活性。本研究进一步丰富了翠柏的化学物质基础,为其今后的开发与利用提供科学依据。
1材料与方法
1.1 材料与仪器
翠柏枝叶于2010年12月采自云南昆明植物园,并由中国科学院昆明植物研究所龚洵研究员鉴定,标本存放在昆明植物研究所植物化学与西部资源持续利用国家重点实验室。
美国APIQSTARTOF质谱仪,瑞士Bruker AM400核磁共振仪,瑞士Bruker AM500核磁共振仪,Agilent1200高效液相色谱仪,硅胶(100~200、200~300目)及TLC检测用硅胶GF254均为青岛海洋化工厂,反相填充材料RP18为Merk公司生产,MCI填充材料为MCIgel CHP20P,所有试剂均为分析纯。小鼠单核巨噬细胞RAW264.7购自中国科学院上海细胞库,DMEM培养基和胎牛血清购自美国Hyclone公司,Griess Reagent、LPS和MG132购自Sigma公司。
1.2 方法
1.2.1 提取与分离干燥翠柏枝叶样品15 kg,粉碎后用95% 乙醇(每次50 L) 在室温下冷浸3次,合并提取液,减压蒸馏浓缩除去有机溶剂后得粗提物,将该粗提物分配于水中,用乙酸乙酯萃取3次(每次5 L),得乙酸乙酯部分620 g。该部分用丙酮溶解,以石油醚-丙酮(1∶0→0∶1)为流动相梯度洗脱,得到5个部分(A~E)。馏分B(110 g)经中压液相色谱(MCI柱),用不同比例的甲醇水洗脱,经TLC检测,合并相同部分得到3个组分B1~B3。B1部分静置过夜,从中析出大量白色方晶,在石油醚-丙酮中重结晶得到化合物3 (15 mg),其母液经正相硅胶柱层析(石油醚-丙酮=20∶1)得到化合物2 (6 mg)。B2部分在甲醇析出一结晶并经甲醇反复重结晶得到化合物1 (25 mg)。馏分C(85 g)经中压液相色谱(MCI柱),用不同比例的甲醇水洗脱,经TLC检测,合并相同部分得到3个组分C1~C3。C1经过反复硅胶柱层析,石油醚-乙酸乙酯(9∶1→7∶3)洗脱,得到化合物8(24 mg)。C2部分经反复正相硅胶柱层析(石油醚-丙酮,氯仿-丙酮)和Sephadex LH20(氯仿∶甲醇=1∶1,或纯甲醇)凝胶纯化后得到化合物4 (21 mg),5 (70 mg),6 (40 mg),7 (5 mg)。
1.2.2 抗炎活性实验利用LPS诱导小鼠RAW 264.7巨噬细胞为检测模型,通过Griess试剂显色法检测NO的生成量(杨晓露等,2013),同批细胞应用MTT法检测细胞活力(Mosmann,1983)。具体实验步骤如下:将对数生长的RAW264.7细胞接种至96孔板,用1 μg·mL1 LPS进行诱导刺激,同时加入待测化合物处理(25 μmol·L1),并设不加药物组作对照;细胞培养24 h后,吸取上清液,加入Griess试剂,混匀,避光静置10 min,在570 nm波长下,利用酶联免疫检测仪读取各孔吸光收值。NO生成抑制率 (%) = (非药物处理组OD570 nm-样品组OD570 nm)/非药物处理组OD570 nm × 100%。对NO生成抑制率超过50%的化合物,设置1.56、3.12、6.25、12.50、25.00 μmol·L1等5个浓度梯度,进一步测定各浓度下的吸光值,应用Reed & Muench法计算IC50值(Reed & Muench, 1938)。
2結构鉴定和抗炎活性测试
2.1 结构鉴定
化合物 1白色粉末。ESIMS m/z: 475 [M + Na]+, 491 [M + K]+; 1H NMR (500 MHz, C5D5N) δ: 6.51 (1H, dd, J=17.5, 10.8 Hz, H14), 5.17 (1H, d, J=10.8 Hz, H15a), 5.63 (1H, d, J=17.5 Hz, H15b),
4.98 (1H, br s, H16a), 5.10 (1H, br s, H16b), 1.29 (3H, br s, CH317), 1.08 (3H, br s, CH318), 4.19 (1H, d, J=11.5 Hz, H19a), 4.55 (1H, d, J=11.5 Hz, H19b), 0.84 (3H, s, CH320), 6.72 (1H, d, J=16.0 Hz, H2′), 8.03 (1H, d, J=16.0 Hz, H3′), 7.67 (2H, d, J = 8.4 Hz, H5′, H9′), 7.19 (2H, d, J=8.4 Hz, H6′, H8′); 13C NMR(125 MHz, C5D5N) δ: 39.9 (C1), 18.5 (C2), 36.5 (C3), 37.6 (C4), 57.1 (C5), 21.2 (C6), 45.5 (C7), 73.1 (C8), 62.4 (C9), 39.1 (C10), 25.5 (C11), 35.9 (C12), 148.4 (C13), 139.6 (C14), 115.8 (C15), 113.9 (C16), 24.5 (C17), 27.7 (C18), 66.7 (C19), 16.3 (C20), 167.7 (C1′), 115.4 (C2′), 145.3 (C3′), 126.2 (C4′), 130.8 (C5′ and C9′), 116.9 (C6′and C8′), 161.6 (C7′)。以上数据与Feliciano et al (1988)报道一致,故鉴定化合物1为8hydroxylabda13(16),14dien19yl transcoumarate。
化合物 2白色固体。ESIMS m/z: 331 [M + HCOO]—; 1H NMR (400 MHz, CD3OD) δ: 5.38 (1H, t, J=6.4 Hz, H12), 6.29 (1H, dd, J=17.3, 10.8 Hz, H14), 5.03 (1H, d, J=17.3 Hz, H15a), 4.85 (1H, d, J=10.8 Hz, H15b), 4.84 (1H, s, H17a), 4.49 (1H, s, H17b), 1.74 (3H, s, CH316), 1.02 (3H, s, CH318), 0.62 (3H, s, CH320); 13C NMR (100 MHz, CD3OD) δ: 39.3 (C1), 20.4 (C2), 35.4 (C3), 48.6 (C4), 57.2 (C5), 39.8 (C6), 24.4 (C7), 148.9 (C8), 57.2 (C9), 41.1 (C10), 25.0 (C11), 134.7 (C12), 134.6 (C13), 142.8 (C14), 110.4 (C15), 12.1 (C16), 108.9 (C17), 24.8 (C18), 207.4 (C19), 14.2 (C20)。以上数据与Chiang et al (2003)报道一致,故鉴定化合物2为transcommunal。
化合物3无色油状物。 ESIMS m/z: 301 [MH]—; 1H NMR (400 MHz, CDCl3) δ: 5.42 (1H, t, J = 6.4 Hz, H12), 6.29 (1H, dd, J=17.4, 10.8 Hz, H14), 5.01 (1H, d, J = 17.4 Hz, H15a), 4.98 (1H, d, J=10.8 Hz, H15b), 1.71 (3H, s, CH316), 4.80 (1H, s, H17a), 4.43 (1H, s, H17b), 1.11 (3H, s, CH318), 0.62 (3H, s, CH320); 13C NMR (100 MHz, CDCl3) δ: 39.2 (C1), 19.9 (C2), 38.4 (C3), 44.0 (C4), 56.3 (C5), 37.9 (C6), 25.8 (C7), 147.9 (C8), 56.1 (C9), 40.3 (C10), 23.2 (C11), 133.9 (C12), 133.3 (C13), 141.5 (C14), 109.8 (C15), 11.7 (C16), 107.5 (C17), 29.0 (C18), 182.4 (C19), 12.8 (C20)。以上数据与Fukushima et al (2002)报道一致,故鉴定化合物3为transcommunic acid。
化合物4白色粉末。 ESIMS m/z: 331 [MH]—; 1H NMR (400 MHz, CDCl3) δ: 7.10 (1H, s, H14), 4.75 (2H, s, H15a and H15b), 4.87 (1H, br s, H17a), 4.57 (1H, br s, H17b), 1.20 (3H, s, CH318), 0.58 (3H, s, CH320); 13C NMR (100 MHz, CDCl3) δ: 39.1 (C1), 19.8 (C2), 38.6 (C3), 44.0 (C4), 56.3 (C5), 25.8 (C6), 37.9 (C7), 147.3 (C8), 56.1 (C9), 40.3 (C10), 21.8 (C11), 28.9 (C12), 144.0 (C13), 134.7 (C14), 70.1 (C15), 174.4 (C16), 106.8 (C17), 28.9 (C18), 184.3 (C19), 12.7 (C20)。以上數据与Fang et al (1989)报道一致,故鉴定化合物4为pinusolidic acid。
化合物5白色粉末。ESIMS m/z: 319 [MH]—; 1H NMR (400 MHz, CD3OD) δ: 5.31 (1H, m, H14), 4.07 (2H, d, J = 6.8 Hz, H15a and H15b), 1.66 (3H, s, CH316), 4.54 (1H, br s, H17a), 4.86 (1H, br s, H17b), 1.20 (3H, s, CH318), 0.63 (3H, s, CH320); 13C NMR (100 MHz, CD3OD) δ: 40.5 (Cl), 21.2 (C2), 39.4 (C3), 45.2 (C4), 56.6 (C5), 27.6 (C6), 39.6 (C7), 149.6 (C8), 57.5 (C9), 41.5 (Cl0), 23.1 (C11), 39.9 (C12), 140.1 (C13), 124.8 (C14), 59.4 (C15), 16.4 (C16), 106.9 (C17), 29.7 (C18), 181.3 (C19), 13.5 (C20)。以上数据与Su et al (1994)报道一致,故鉴定化合物5为isocupressic acid。
化合物6白色针晶。 ESIMS m/z: 317 [MH]—; 1H NMR (400 MHz, CDCl3) δ: 4.41 (1H, m, H12), 6.33 (1H, dd, J=17.8, 11.1 Hz, H14), 5.12 (1H, d, J = 11.1 Hz, H15a), 5.41 (1H, d, J=17.8 Hz, H15b), 5.14 (1H, br s, H16a), 5.21 (1H, br s, H16b), 4.52 (1H, br s, H17a), 4.88 (1H, br s, H17b), 1.24 (3H, s, CH318), 0.57 (3H, s, CH320); 13C NMR (100 MHz, CDCl3) δ: 38.7 (Cl), 19.8 (C2), 37.8 (C3), 44.2 (C4), 56.2 (C5), 26.1 (C6), 38.9 (C7), 148.7 (C8), 51.7 (C9), 40.1 (Cl0), 31.2 (C11), 69.9 (C12), 150.4 (C13), 136.0 (C14), 114.7 (C15), 113.3 (C16), 106.5 (C17), 26.1 (C18), 183.9 (C19), 12.8 (C20)。以上数据与Wu et al (2013)报道一致,故鉴定化合物6为fokihodgin F。
化合物7白色粉末。ESIMS m/z: 401 [M + K] +; 1H NMR (400 MHz, CD3OD) δ: 5.27 (1H, m, H14), 4.58 (2H, m, H15a and H15b), 1.69 (3H, s, CH316), 4.52 (1H, br s, H17a), 4.85 (1H, br s, H17b), 1.34 (3H, s, CH318), 0.62 (3H, s, CH320), 2.14 (3H, s, OCOCH3); 13C NMR (100 MHz, CD3OD) δ: 40.4 (Cl), 21.2 (C2), 39.3 (C3), 45.1 (C4), 56.4 (C5), 27.5 (C6), 39.3 (C7), 149.5 (C8), 57.5 (C9), 41.4 (Cl0), 22.9 (C11), 39.9 (C12), 143.8 (C13), 119.8 (C14), 62.3 (C15), 16.5 (C16), 106.9 (C17), 29.6 (C18), 181.1 (C19), 13.5 (C20), 21.2 (OCOCH3), 172.8 (OCOCH3)。以上数据与Popova et al (2009)报道一致,故鉴定化合物7为acetylisocupressic acid。
化合物8无色油状。 ESIMS m/z: 359 [M + Na] +; 1H NMR (400 MHz, CD3OD) δ: 5.43 (1H, t, J = 6.8 Hz, H14), 4.14 (2H, d, J = 6.8 Hz, H15a and H15b), 4.04 (2H, d, J = 8.4 Hz, H16a and H16b), 4.59 (1H, br s, H17a), 4.87 (1H, br s, H17b), 1.20 (3H, s, CH318), 0.64 (3H, s, CH320); 13C NMR (1 00 MHz, CD3OD) δ: 39.9 (Cl), 21.2 (C2), 39.3 (C3), 45.1 (C4), 57.5 (C5), 27.6 (C6), 40.4 (C7), 149.6 (C8), 56.9 (C9), 41.5 (Cl0), 23.4 (C11), 34.9 (C12), 143.3 (C13), 127.5 (C14), 58.8 (C15), 60.1 (C16), 107.1 (C17), 29.7 (C18), 181.4 (C19), 13.5 (C20)。以上数据与Ren & Ye (2006)报道一致,故鉴定化合物8为15,16dihydroxylabda8(17),13(E)dien19oic acid。
2.2 抗炎活性測试
利用LPS诱导刺激RAW 264.7巨噬细胞炎症模型,通过Griess法对上述8个化合物进行抗炎活性评价。除化合物1在25 μmol·L1的浓度下对RAW 264.7细胞具有一定的细胞毒性(图2),其余化合物对LPS诱导的RAW264.7巨噬细胞释放NO均具有不同程度的抑制作用, 其抑制率在11.50%~
3结论
采用色谱分离技术和结构鉴定方法,从采自云南昆明植物园翠柏中获得8个二萜类化合物,均为首次从该植物中分离得到。NO作为炎症组织损伤的重要致病因子,在急、慢性炎症反应的发生发展过程中发挥重要作用。当免疫细胞遭受微生物内毒素、炎症介质等刺激时,会生成大量的诱导型一氧化氮合成酶(iNOS),产生NO进行免疫应答。因此,本研究通过各化合物对LPS诱导的小鼠RAW264.7巨噬细胞产生NO的影响来评价各化合物的抗炎活性。结果表明化合物2~8对LPS诱导的RAW264.7巨噬细胞NO的释放均具有不同程度的抑制作用,尤其是化合物7的抑制作用最强, 其IC50值为9.31 μmol·L1。本研究阐明了翠柏抗炎作用的药效物质基础,为翠柏的进一步开发利用提供了科学依据。
参考文献:
CHIANG YM, LIU HK, LO JM, et al, 2003. Cytotoxic constituents of the leaves of Calocedruds formosana [J]. J Chin Chem Soc, 50 (1): 161-166
Editorial Committee of Flora of China, 1978. Flora of China [M]. Beijing: Science Press, 7: 325-327. [中国植物志编委会, 1978,中国植物志 [M]. 北京: 科学出版社, 7: 325-327.]
FANG JM, HSU KC, CHENG YS, 1989. Terpenoids from leaves of Calocedrus formosana [J]. Phytochemistry, 28 (4): 1173-1175.
FELICIANO AS, MEDARDE M, LOPEZ JL, et al, 1988. Terpenoids from leaves of Juniperus thurifera [J]. Phytochemistry, 27(7): 2241-2248.
FUKUSHIMA JI, YATAGAI M, OHIRA T, 2002. Abietanetype and labdanetype diterpenoids from the cones of Chamaecyparis obtusa [J]. J Wood Sci, 48 (4): 326-330.
HSIEH CL, TSENG MH, KUO, YH, 2005. Formosadimers A, B, and C from the bark of Calocedrus macrolepis var. formosana [J]. Chem Pharm Bull, 53 (11): 1463-1465.
HSIEH CL, TSENG MH, SHAO YY, et al, 2006. C35 terpenoids from the bark of Calocedrus macrolepis var. formosana with activity against human cancer cell lines [J]. J Nat Prod, 69 (11): 1611-1613.
HSIEH CL, TSENG MH, PAN RN, et al, 2011. Labdanecaryophyllic acid, a novel cytotoxic C35 terpenoid from Calocedrus macrolepis var. formosana [J]. Tetrahedron Lett, 52 (4): 515-517.
MOSMANN T, 1983. Rapid colorimetric assay for cellular growth and survival: Application to proliferation and cytotoxicity assays [J]. J Imm Methods, 65 (1): 55-63.
POPOVA MP, CHINOU IB, MAREKOV IN, et al, 2009. Terpenes with antimicrobial activity from Cretan propolis [J]. Phytochemistry, 70 (10): 1262-1271.
REED LJ, MUENCH H, 1938. A simple method of estimating fifty percent endpoints [J]. Am J Hyg, 27 (3): 493-497.
REN XY, YE Y, 2006. Labdane diterpenes from the seeds of Platycladus orientalis [J]. J Asian Nat Prod Res, 8 (8): 677-682.
SU WC, FANG JM, CHENG YS, 1994. Labdanes from Cryptomeria japonica [J]. Phytochemistry, 37 (4): 1109-1114.
WANG L, WANG SY, WU XD, et al, 2013. Study on chemical compositions of Calocedrus macrolepis [J]. J Kumming Med Univ, 34 (7): 8-11. [王蕾, 王双燕, 吴兴德, 等, 2013. 翠柏的化学成分研究 [J]. 昆明医科大学学报, 34 (7): 8-11.]
WU XD, HE J, LI XY, et al, 2013. Diterpenoids from the twigs and leaves of Fokienia hodginsii [J]. J Nat Prod, 76(6): 1032-1038.
WU XD, WANG SY, WANG L, et al, 2013. Labdane diterpenoids and lignans from Calocedrus macrolepis [J]. Fitoterapia, 85(1): 154-160.
YANG XL, LIU D, BIAN K, et al, 2013. Study on in vitro antiinflammatory activity of total flavonoids from Glycyrrhizae radix et Rhizoma and its ingredients [J]. Chin J Chin Mat Med, 38(1): 99-104. [楊晓露, 刘朵, 卞卡, 等, 2013. 甘草总黄酮及其成分体外抗炎活性及机制研究 [J]. 中国中药杂志, 38(1): 99-104.]

