基于Mn/γ-Al2O3催化剂的氯化氢制氯气反应热力学分析研究
刘凯强,李天文,王全龙,孙慧梅,孙晓辉
(烟台大学化学化工学院,山东烟台264005)
基于Mn/γ-Al2O3催化剂的氯化氢制氯气反应热力学分析研究
刘凯强,李天文,王全龙,孙慧梅,孙晓辉
(烟台大学化学化工学院,山东烟台264005)
提出一种利用锰化合物作为中间物进行氯化氢催化氧化制氯气的新机理。使用Math CAD、HSC等软件进行热力学分析,探究温度、进料比及压力对氯化氢催化氧化反应的影响,制备得到Mn/γ-Al2O3催化剂并对其性能做了评价实验。结果表明:热力学分析认为温度越低氯化氢转化率越高,但受反应动力学控制以及实验测定,温度升高有利于氯化氢的转化。当温度低于400℃时氯化氢转化率不足10%,当温度达到500℃左右时,转化率可达到60%以上,并且可以长时间保持活性。
氯化氢;催化剂;高温氧化;氯气
中国每年副产氯化氢总量接近400万t,随着二苯基甲烷二异氰酸酯(MDI)、甲苯二异氰酸酯(TDI)、甲烷氯化物等涉氯产品的大规模扩产和氯碱行业的发展。预计未来5 a,副产氯化氢总量将达到500万t/a。大量副产氯化氢难以处理且污染严重,已成为制约聚氨酯、氯碱、有机氟、农药、医药化工等众多行业发展的共性难题。针对于此,研究者提出了不同解决方法,包括电解法、直接氧化、催化氧化等。电解法的耗能高,直接氧化法的效率低,且设备复杂,反应过程中需要加入大量氧化剂,能耗也较大。相对来说,采用催化氧化法在保证催化剂寿命前提下可使副产氯化氢得到有效利用。
氯化氢催化氧化制氯气是实现工业氯资源闭路循环的绿色化工过程,以CuCl2为催化剂实现氯化氢氧化制氯气的方法早在19世纪70年代即已提出,但很长时间内未实现较好的工业化目标。主要存在的难度:1)难以开发出高效稳定的催化剂;2)氯化氢催化氧化为强腐蚀性可逆放热过程,对反应器的材质有较高的要求。目前,氯化氢催化氧化已实现工业化[1],但存在催化剂活性组分易流失、价格昂贵等缺陷。面对该问题,可以在选择使用以MnO2为活性组分催化剂的前提下,提高反应温度进行催化氧化反应。并且结合热力学平衡分析了反应的可行性。虽然未能达到催化氧化过程的较高转化率,但从反应停留时间、反应器的高径比、进料位置等方面做工程性的改进可有助于提高氯化氢转化率,最终实现副产氯化氢的工业化处理。
笔者利用锰化合物作为反应过程的中间物质[2],直接与氧气和氯化氢发生反应制备氯气,主要反应:
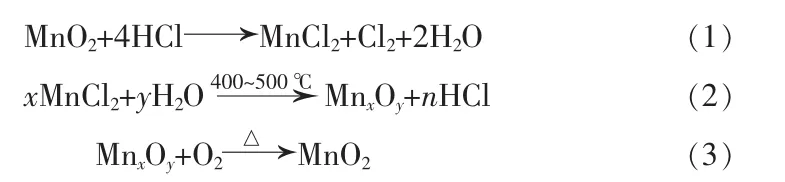
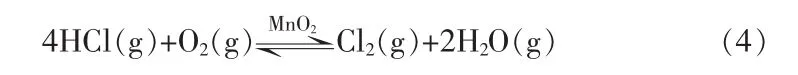
总反应方程式:其中,式(2)反应为总反应的决定步骤[2],Mn在反应过程中通过价态的不断转换使氯离子氧化为氯气,并且没有其他副产物的产生。本研究通过热力学计算与Mn/γ-Al2O3催化剂实验数据相比较,确定了该催化剂催化氧化制氯气较高的活性及寿命,并对反应过程中的工艺条件提出了要求。
1 实验内容
1.1 催化剂制备
Mn/γ-Al2O3催化剂采用浸渍法制备[3],制备方法和条件:称取定量KMnO4,用一定量蒸馏水溶解后浸渍到已制备好的γ-Al2O3三叶草形载体上。在真空干燥箱中,120℃条件下干燥2.5 h;放置于马弗炉中,400~600℃、空气气氛条件下焙烧5 h,得到氯化氢催化氧化以Mn为主要活性组分、K为活性助剂的复合型催化剂。
1.2 催化剂活性评价
Mn/γ-Al2O3催化剂是在固定床反应器中进行活性评价。反应器总高度由原料混合段、催化氧化反应段及催化剂床层支撑段三部分组成。固定床反应器直径为50mm,高为500mm,内装Mn/γ-Al2O3型催化剂300 g。外部用加热套加热,反应前先使用空气吹扫反应器,同时将反应器预热至360℃,将原料氯化氢、氧气等经流量计计量后经预热器通入反应器内部进行催化氧化反应,反应生成物经水洗后通入碱液吸收尾气。实验流程见图1。
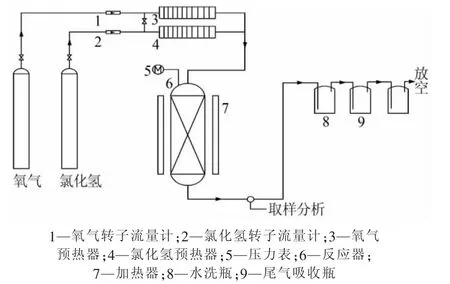
图1 实验流程装置示意图
实验过程中每隔30min取样一次,将气体产物从出口管通入到装有15mL、0.5mol/L的KI溶液的锥形瓶,锥形瓶中的液体先后用 0.1 mol/L的Na2S2O3溶液和0.1mol/L的NaOH溶液滴定,HCl气体的转化率按照以下公式计算:
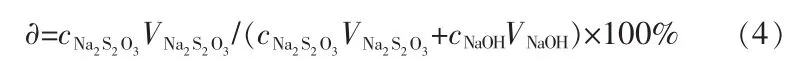
2 结果与讨论
2.1 热力学分析
氯化氢催化氧化反应为放热可逆反应,很多人对其平衡常数Ke做了研究计算。其中,文献[4-5]给出了较好的平衡表达式:
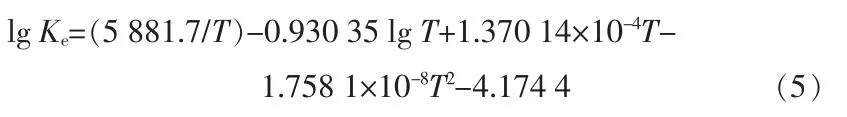
利用Math CAD软件,依据热力学平衡理论,研究了不同温度和HCl与O2进料比(体积比,下同)对氯化氢转化率的影响。氯化氢催化氧化反应平衡式:

其中,各物质的标准摩尔生成焓、标准摩尔熵及摩尔定压热容,见表1。
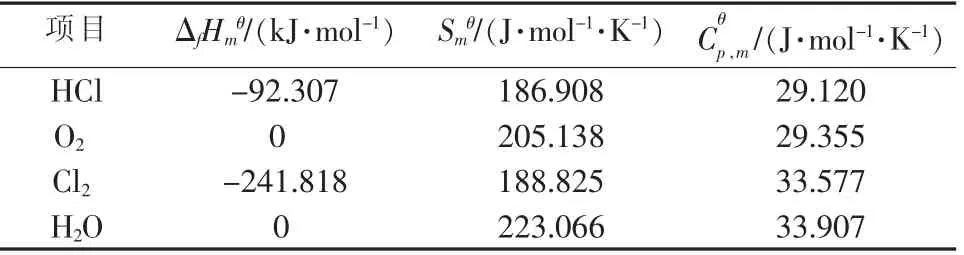
表1 反应物及产物基本物性参数
由表1数据可依次计算不同温度下的ΔrHmθ、ΔrSmθ,根据吉布斯函数计算公式ΔrGmθ=ΔrHmθ-TΔrSmθ和反应达到平衡时ΔrGmθ=-RT ln Kθ得到不同温度下反应的平衡转化率,可以与文献[4]给出的平衡常数Ke的计算结果对比,结果见表2。
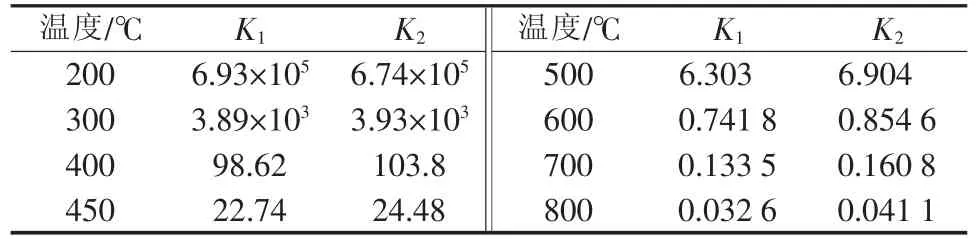
表2 理论计算与经验计算平衡常数结果比较
再根据传统的热力学计算方法得到平衡常数分压表达式:

氯化氢催化氧化过程无任何副反应,以HCl与O2的体积比为2∶1进料,利用式(3)计算得到了不同温度、压力条件下氯化氢反应转化率以及不同物质的量比条件下氯化氢热力学平衡转化率。
图2为根据吉布斯热力学模型使用Math CAD计算和利用HSC软件计算不同温度对氯化氢转化率的影响。由图2可见,2种方法得到的氯化氢转化率结果基本一致,随着反应温度的升高,反应逆向移动,此时越来越多的产物生成反应物,降低了氯化氢的转化率。从热力学角度分析,低温有利于反应的进行,但考虑到反应动力学规律,温度升高可提高反应速率[7],当达到一定温度后才能使反应达到较为理想的转化率。因此,选定合适的催化剂来降低活化能对反应的高效进行尤为重要。
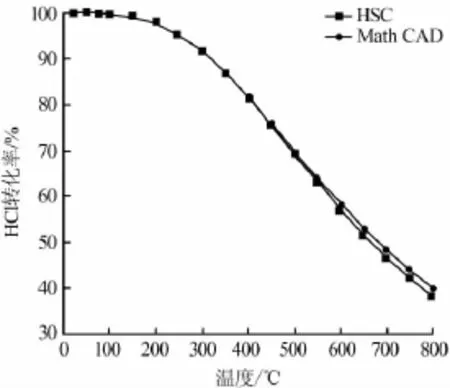
图2 温度对氯化氢转化率影响
图3、图4分别为压力和HCl与O2进料体积比对氯化氢转化率的影响。
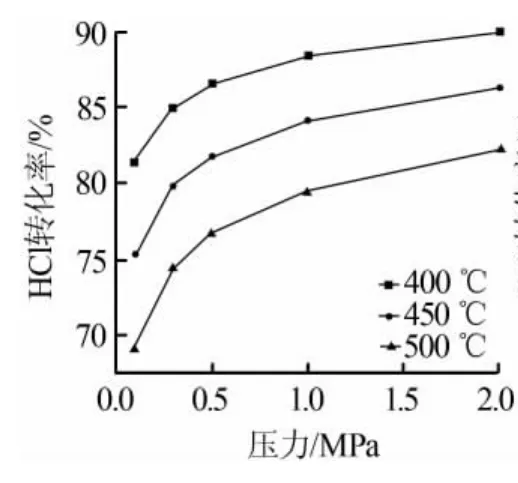
图3 压力对氯化氢转化率的影响
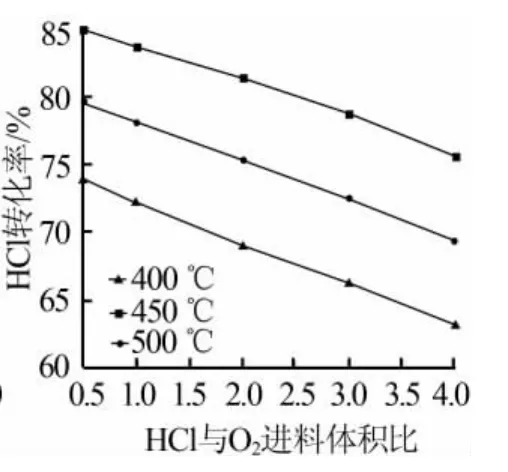
图4 HCl与O2进料比对氯化氢转化率影响
由图3和图4可以看出,反应压力和进料比对氯化氢转化率也有较大的影响。通过提高反应压力和增大氧气的进料量,可有效提升氯化氢的转化率。但在实际生产过程中,除了追求较高的转化率外,还需要控制反应温度、压力、进料比来满足工程应用。虽然反应压力增至2MPa时,氯化氢理论转化率可以达到90%,但对设备及管路的耐压、耐腐要求也随之增大。同样情况,提高氧气进料量也会增大氯化氢转化率,却对后续过程氯气和氧气的分离造成了比较大的困难。
通过上述热力学计算及分析,催化剂须保证在低温条件下具有较高的活性及寿命。但是活性较高的Cu和Ru催化剂在活化温度下都存在比较严重的流失现象[7],而催化剂的解决又是整个工艺的重中之重。从图2中不难发现,在反应温度为500℃、常压条件下,氯化氢理论转化率也可达到70%,当压力增高至0.5MPa时,氯化氢转化率可达到75%以上。另外控制氯化氢与氧气的进料比为(1~2)∶1,配合合适的工艺,则完全可满足长期工业生产需要。因此,在低温条件无法很好解决催化剂寿命情况下,通过提高反应温度,实验研究得到了Mn/γ-Al2O3催化剂。
2.2 实验结果
由催化剂机理可以看出,反应的中间产物为MnCl2,相比CuCl2和RuCl3等物质熔融点较高,可达到650℃。反应过程中锰盐不易挥发流失,高温条件下保证了催化剂寿命。在实验过程中,通过改变温度条件,测定了不同温度条件下氯化氢的转化率,结果见图5。
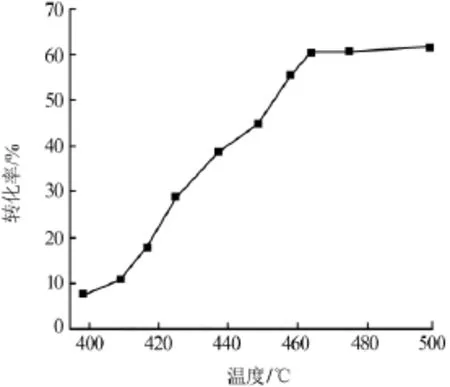
图5 实验温度对氯化氢转化率影响
从图5可以看出,在低于400℃条件下,Mn/ γ-Al2O3催化剂活性较低,氯化氢转化率不足10%,随着温度不断升高,催化剂显示出较好的活性,氯化氢转化率迅速升高。当温度升高至460℃以上时,氯化氢转化率继续升高但升高幅度减小。由实验结果来看,实验现象并不符合热力学计算得到的随温度升高氯化氢转化率降低的规律,但是从反应速率角度考虑,温度较低的条件下,活化能较高,不利于催化反应的进行。通过选择适当的催化剂,提高温度来降低反应活化能,促进反应正向进行,可增大氯化氢转化率。
3 结论
1)对氯化氢催化氧化制氯气反应热力学分析,可以看出升高反应温度不利于反应的正向进行,会降低氯化氢的转化率。但通过以氧化锰为活性组分的Mn/γ-Al2O3催化剂实验结果表明,低温条件下并未达到理想的转化率,相反,提高温度有利于增大氯化氢转化率。同时确定了HCl与O2进料比(体积比)为(1~2)∶1、反应压力控制在0.3~0.5MPa条件下,对实验研究及工程开发有较大意义。2)Mn/γ-Al2O3高温催化剂的研究有助于解决催化剂活性组分易流失的缺陷,并且该催化剂长期处于高温条件(500℃)下未出现活性组分下降,延长了催化剂寿命。
[1] 党杰,刘吉,史雪君,等.一种用于氯化氢制氯气的整体式催化剂及其制备方法:中国,101862674B[P].2012-02-08.
[2] Yang G,Sun Y,Zhang J,et al.Clean production of chlorine from hydrogen chloridewith Mn-compound as intermediate[J].Chinese JournalofChemicalEngineering,2014,23(2):435-440.
[3] 朱洪发.催化剂载体制备及应用技术[M].北京:石油工业出版
社,2002.
[4] Arnold CW,Kobe K A.Thermodynamicsof the Deacon process[J]. Chem.Eng.Progr.,1952,48(6):293-296.
[5] 王永,乔昶.氯化氢催化氧化制氯气工艺研究[J].化工技术与开发,2007,36(7):5-7.
[6] 冯看卡,卢冠忠,张建,等.用于氯化氢催化氧化制氯气的催化剂及其制备方法:中国,101862663A[P].2010.
[7] 杨成武,曹烁,左宜赞,等.氯化氢催化氧化制氯气催化剂的失活与再生[J].过程工程学报,2012,12(2):173-176.
联系方式:13505355865@163.com
Thermodynam icsanalysison preparation of chlorine from hydrogen chloride based on M n/γ-Al2O3catalyst
Liu Kaiqiang,LiTianwen,Wang Quanlong,Sun Huimei,Sun Xiaohui
(SchoolofChemistry and ChemicalEngineering,YantaiUniversity,Yantai264005,China)
A newmechanism for the catalytic oxidation ofhydrogen chloride to prepare chlorinewith Mn compound as intemediatewas put forward.Thermodynamic analysiswas carried outby Math CAD and HSC,and the effects of temperature,feed ratio,and pressure on hydrogen chloride catalytic oxidation were investigated.Mn/γ-Al2O3catalystwas prepared and a performance evaluation testwas conducted.Results showed that,the HCl conversion rate increased with the decrease of temperature by thermodynamic analysis.But controlled by reaction kinetics and experimental determination,high temperature was propitious to the transformation of HCl.When the temperature was lower than 400℃,HCl conversion rate was less than 10%,when the temperature reached about500℃,HCl conversion ratewasmore than 60%and could keep activity fora long time.
hydrogen chloride;catalyst;high-temperatureoxidation;chlorine
TQ133.1
A
1006-4990(2017)05-0082-04
2016-11-11
刘凯强(1990— ),男,硕士研究生,主要从事氯化氢催化氧化制氯气催化剂开发及配套工艺优化。
李天文

