主动脉夹层临床特征及预后分析
金 健
主动脉夹层临床特征及预后分析
金 健
目的 探讨主动脉夹层病人临床特征及预后相关影响因素。方法 收集深圳市南山区人民医院2010年6月—2016年6月住院治疗的主动脉夹层病人临床资料,按年龄、性别、Stanford分型分析临床特征,应用单因素及Logistic多元回归分析主动脉夹层预后的影响因素。结果 71例病人年龄54.06岁±15.18岁,87.3%合并高血压,StanfordA型40例(56.3%),StanfordB型31例(43.7%),12例死亡(16.9%)。单因素分析:分型、舒张压、意识障碍、休克、心包积液与预后相关。Logistic回归分析为心包积液导致主动脉夹层死亡的独立危险因素。结论 主动脉夹层以疼痛为突出表现,高血压与主动脉夹层密切相关,并发心包积液者死亡风险增加,临床应予高度重视。
主动脉夹层;临床特征;预后
动脉夹层(aortic dissection,AD)是血液通过主动脉内膜裂口进入主动脉壁并造成动脉壁的分离,是一种异常凶险的心血管疾病。起病急、进展快,临床表现复杂多样,早期易发生误诊及漏诊,死亡率高。现对我院2010年6月—2016年6月收治的主动脉夹层71例病人予分析,以提高对该病诊治水平。
1 资料与方法
1.1 研究对象 收集2010年6月—2016年6月在我院住院的71例主动脉夹层病人,发病2周之内,所有研究对象根据主动脉CTA或MRA确诊。
1.2 资料收集 收集病人年龄、性别、血压、心率、症状、并发症、辅助检查等结果,按Stanford标准分为A、B两型,观察住院病死率,分析死亡危险因素。
2 结 果
2.1 病人基本情况 71例病人,男59例(83.1%),女12例(16.9%);年龄54.06岁±15.18岁;合并高血压病62例(87.3%),马方综合征3例(4.2%),无合并其他动脉硬化因素者3例(4.2%);StanfordA型40例(56.3%),StanfordB型31例(43.7%);收缩压151.34 mmHg±43.91 mmHg、舒张压90.67 mmHg±28.09 mmHg;心率82.1次/min±18.58次/min,死亡率16.9%。
2.2 主动脉夹层病人临床特征 主动脉夹层病人由于病变夹层部位不同临床表现复杂多变。详见表1。
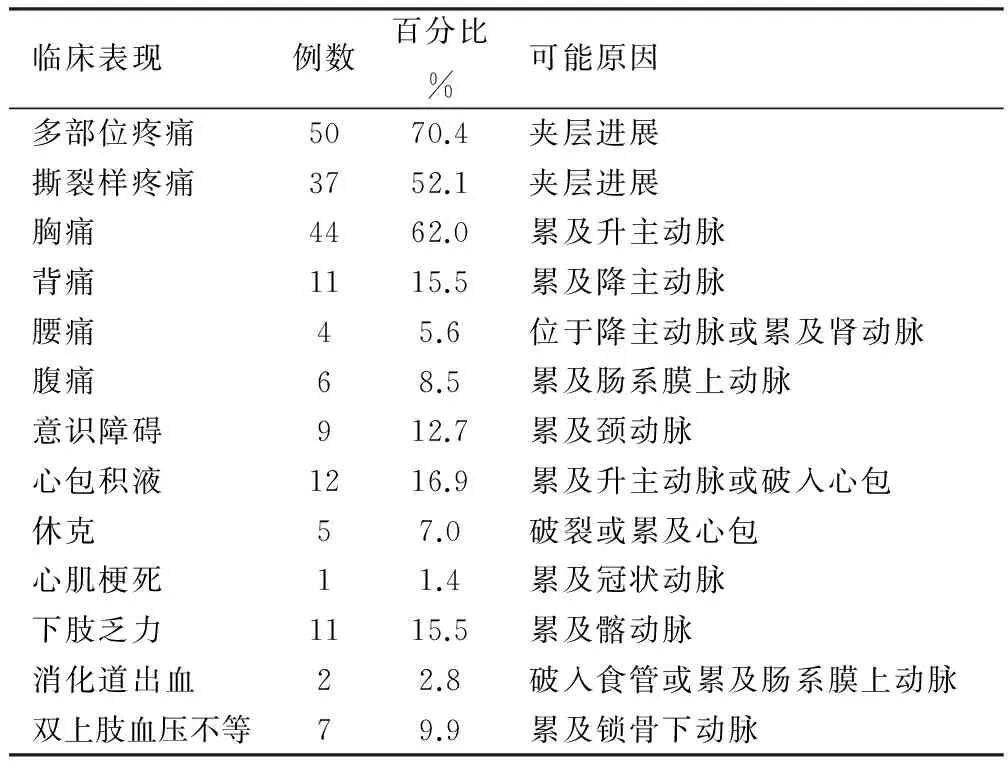
表1 主动脉夹层病人临床特征
2.3 影像学资料 心电图39例(54.9%)出现Q波,ST-T改变,房颤或AVB等。胸片检查27例(38.0%)见上纵隔影增宽。超声心动图检查55例(77.5%)可见主动脉内膜片或主动脉内径(根部)明显增宽。主动脉CTA或MRA可明确破口位置。
2.4 实验室检查 2例(2.8%)肌钙蛋白高,16例(22.5%)肌酐高,30例(42.3%)D二聚体升高。
2.5 预后及相关影响因素 共12例死亡,病死率16.9%。11例为StanfordA型(病死率27.5%),1例为StanfordB型(病死率3.2%)。将并发症、收缩压、舒张压、心率、性别、年龄、临床分型作为主动脉夹层的死亡危险因素进行单因素分析,详见表2。将单因素分析有统计学意义指标引入Logistic回归分析,结果显示:心包积液为主动脉夹层死亡的独立危险因素。详见表3。
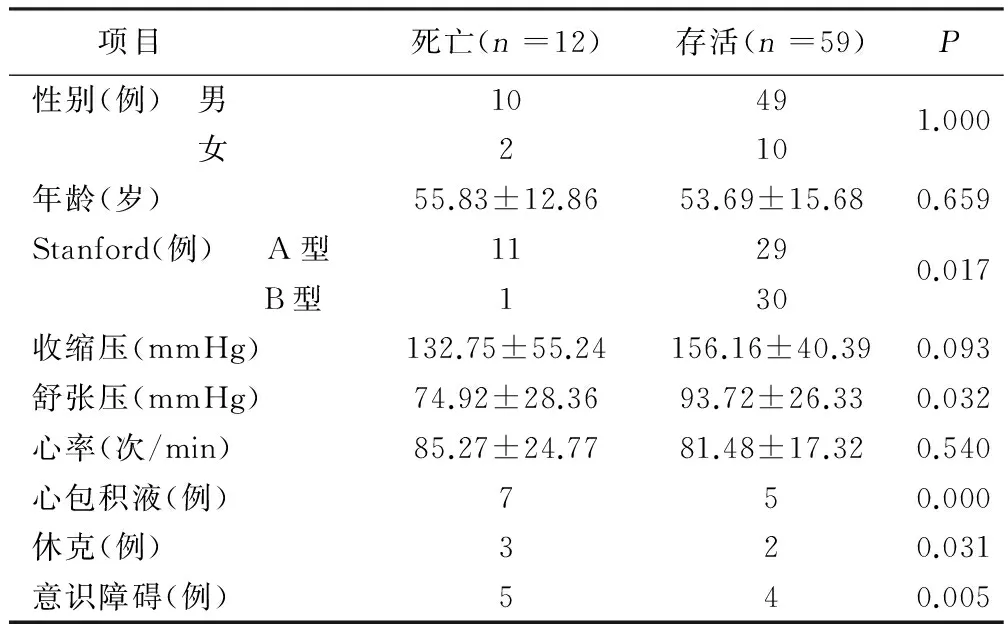
表2 主动脉夹层病人预后的单因素分析
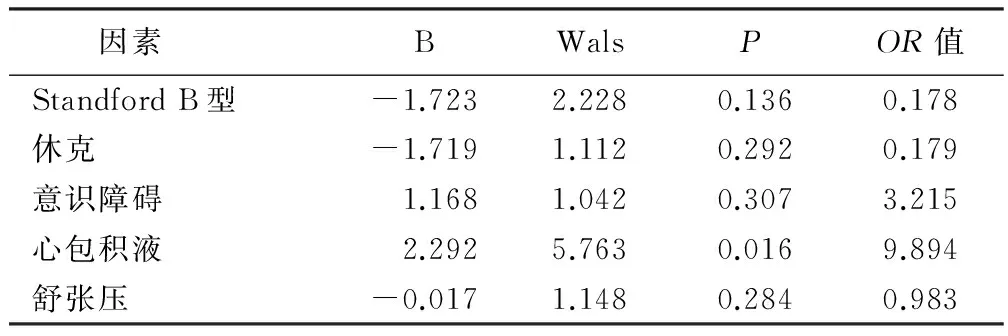
表3 主动脉夹层病人预后的Logistic回归分析
3 讨 论
AD是主动脉内膜撕裂,血液进入主动脉肌壁内,内膜逐渐剥离、扩张,形成真假腔。发病率虽低,但危害极大,未经治疗的病人发病初24 h内每小时死亡约1%,半数以上1周内死亡,70%2周内死亡[1]。死亡主要原因是瘤体破裂或重要器官供血动脉阻塞。国外报道,因急性胸痛就诊的病人中AD占0.5%,发病率男女比为2∶1~5∶1[2],本研究男女比例约4.9∶1;年龄54.06岁±15.18岁。
AD病因分先天性及后天性,前者为影响主动脉壁的遗传性结缔组织病,如马方综合征;后者包括高血压、动脉粥样硬化、医源性损伤、妊娠等。其中高血压与主动脉夹层密切相关,据报道有70%~90%病人有高血压[3-4]。本研究中高血压占87.3%。AD分为急性AD,其病程<2周;>2周为慢性。Stanford分型:累及升主动脉为A型;未累及升主动脉为B型。本研究A型40例(56.3%),B型31例(43.7%)。
主动脉夹层由于受累部位、范围和分型不同,临床表现复杂多样。疼痛为突出表现,典型疼痛为突发撕裂样剧痛伴大汗,并可向多部位转移。国外研究表明,疼痛可达95.5%,本研究中疼痛发生率95.7%,胸痛为主,其中撕裂样剧痛占52.1%,多部位疼痛占70.4%。与国外研究相似[5]。疼痛部位对病变累及范围有一定提示,前胸疼痛多为升主动脉夹层;背部、腹部疼痛多累及降主动脉。本研究极少数病人无典型疼痛,因晕厥、意识障碍、神经系统症状就诊,需引起重视。累及多系统的危重症应考虑本病,及时排查,避免误诊漏诊。
两侧肢体动脉搏动不对称是主动脉夹层特异性体征,本研究仅9.9%不对称,较文献报道38%低[6],可能为重视不够,部分病人未常规测量双上肢血压。主动脉损伤释放组织因子,假腔血栓形成激活内源凝血级联瀑布反应,同时激活纤溶系统,交联纤维蛋白的降解产物D二聚体。Suzuki等[7]发现,发病24 h内D-二聚体截断值为500 ng/mL时,其敏感性及特异性分别为96.6%和46.6%,阴性预测值为95%。Sodeck等[8]研究表明,D二聚体小于0.1 mg/L可排除主动脉夹层。本研究D二聚体42.3%升高,提示胸痛伴D二聚体高需考虑主动脉夹层。
心电图检查主动脉夹层不具有特异性,左室肥大伴ST-T改变常见,与高血压有关。影像学检查主要有胸片、超声、主动脉CTA及MRA。胸片作为AD筛选,主要征象为上纵隔或主动脉增宽。本研究胸片38%可见纵隔影增宽。心脏彩超可见升主动脉增宽,主动脉剥脱内膜片及真假腔,对A型夹层有诊断价值。但对远端AD诊断,其可靠性不够。本研究77.5%超声心动图检查可见阳性改变。CTA和MRA是诊断AD的可靠方法[9],主动脉CTA最常用,敏感性90%以上,特异性接近100%。MRA诊断敏感性和特异性与CTA接近,主要适用于严重肾功能不全者,缺陷是扫描时间长、不适合循环不稳定者,也禁用于磁性金属植入物者。本研究病人均由主动脉CTA或MRA确诊。
主动脉夹层药物治疗主要是联合硝普钠与β受体阻滞剂,控制心率60次/min~80次/min,收缩压100 mmHg~120 mmHg,或维持心、脑、肾等灌注所需的最低血压水平,降低左室收缩速率(dp/dt)。手术方式有两种:外科手术和主动脉腔内修复术(EVAR),EVAR通过各种腔内修复巧术(烟囱、开窗、模块分支支架)处理破口距左锁骨下动脉开口1.5 cm内的B型夹层。近年来针对部分病人采用内外科结合的主动脉弓杂交手术。A型夹层因更易发生破裂和心包填塞,应尽早外科干预。凡夹层破裂、疑似破裂或合并急性器官灌注不良、顽固性疼痛等危及生命的复杂B型夹层,应尽快行EVAR或外科手术,EVAR已成为复杂B型夹层一线治疗术。对无并发症的简单B型夹层,可先内科药物治疗观察两周,如破口未封闭、仍有造影剂渗入,待血管壁水肿消退后行介入治疗封闭内膜破裂口,本科室自开展EVAR,B型夹层院内死亡率降低至3.2%。
本研究主动脉夹层病人死亡多因素Logistic回归分析,心包积液为住院死亡的独立相关因素(P<0.05),与既往研究相似[10]。文献报道合并休克预后差。本研究部分休克病人经积极补液治疗,血压恢复,提示疼痛刺激使迷走神经张力增高或假腔大至循环血量减少也可导致低血压,甚至休克。多项国内外研究发现Stanford分型和病人的预后相关,仅用药物治疗的A型夹层病人院内死亡率高达55.9%[11]。本研究分型和病人预后差异无统计学意义,可能与样本量较少有关,尚需进一步研究。
[1] Meszaros I,Morocz J,Szlavi J,et al.Epidemiology and clinicopathology of aortic dissection[J].Chest,2000,117(5):1271-1278.
[2] Auer J,Berent R,Eber B.Aortic dissection:incidence.natural history and impact of surgery[J].J Clin Basic Cardiol,2000,3(3):151-154.
[3] 斐文楠,唐渝平.35例主动脉夹层的诊断及内科治疗[J].重庆医学,2007,36(11):1081.
[4] Howard DPJ,Banerjee A,Fairhead JF,et al.Population-based study of incidence and outcome of acute aortic dissection and premorbid risk factor control[J].Circulation,2013,127(20):2031-2037.
[5] Hagan PG,Nienaber CA,Isselbacher EM,et al.The International Registry of Acute Aortic Dissection(IRAD):new insights into on old disease[J].JAMA,2000,283(7):897-903.
[6] Khan IAl,Nair CK.Ciinicai,diagnostic,and management perspectives of aortic dissection[J].Chest,2002,122(1):311-328.
[7] Suzuki T,Distante A,Zizza A,et al.Diagnosis of acute aortic dissection by D-dimer:the International Registry of Acute Aortic Dissection Substudy on Biomarkers (IRAD-Bio) experience[J].Circulation,2009,119(20):2702-2707.
[8] Sodeck G,Domanovits H,Schillinger M,et al.D-dimer in ruling out acute aortic dissection:a systematic review and prospective cohort study[J].Eur Heart,2007,28(11):3067-3075.
[9] Thrumurthy SG,Karthikesalingam A,Patterson BO,et al.The diagnosis and management of aortic dissection[J].Vasc Endovascular Surg,2012,44(3):165.
[10] Mehta RH,Suzuki T,Hagan PG,et al.Predicting death in patients with acute type A aortic dissection[J].Acc Current Journal Review,2002,11(3):200-206.
[11] Aalberts JJ,Boonstra PW,Vanden Berg M,et al.In-hospital mortality and three-year survival after repaired acute type A aortic dissection[J].Neth Heart J,2009,17(6):226-231.
(本文编辑薛妮)
广东省深圳市南山区人民医院(广东深圳 518052),E-mail:cyjj2005@sohu.com
引用信息:金健.主动脉夹层临床特征及预后分析[J].中西医结合心脑血管病杂志,2017,15(8):982-984.
R543.1 R256.2
B
10.3969/j.issn.1672-1349.2017.08.026
1672-1349(2017)08-0982-03
2016-12-11)

