闭合性肝损伤术后出血的原因分析及防治
黄 超,张 坤,江 艺
·论 著·
闭合性肝损伤术后出血的原因分析及防治
黄 超,张 坤,江 艺
目的 分析闭合性肝损伤术后出血的原因并探讨其防治策略。方法 回顾性分析2003年9月~2016年9月南京军区福州总医院收治的63例闭合性肝损伤术后患者的临床资料,尤其是腹腔引流管的引流情况。按肝损伤的严重程度及术后引流管是否引流出脓液,分为轻度和严重肝损伤组,引流出脓液和未引流出组,均比较两组出血率的差异。根据肝损伤术后是否出血,分为出血与未出血组,比较两组术前凝血酶原时间(prothrombin time,PT)的差异。结果 63例闭合性肝损伤患者,23例(36.50%) 发生不同程度的出血,其中20例为肝切除术后。依据肝脏手术国际研究小组(ISGLS)肝切除术后出血(PHH)标准:A级4例,B级7例,C级9例。术后发生出血的中位时间为24h,发生出血至二次手术或介入止血的中位时间为3h。非手术治疗成功12例,二次手术治疗11例,其中9例为肝切除术后出现的大出血,术后48h内腹腔引流管引流出大量鲜红色或暗红色血液。术后出血患者死亡3例,病死率13.04%(3/23);其中2例为二次手术死亡,二次手术病死率18.2%(2/11)。严重肝损伤组的出血率明显高于轻度肝损伤组(P=0.047);肝损伤术后出血组的术前PT延长时间明显长于肝损伤术后未出血组(P=0.000);肝损伤术后引流出脓液组的出血率明显高于肝损伤术后未引流出组(P=0.01);提示肝损伤术后出血主要与血管隐匿性出血、肝损伤的严重程度、凝血功能障碍、创面感染有关。结论 出血是肝损伤术后的严重并发症,病死率高,主要为PHH。肝损伤术后出血主要与血管隐匿性出血、肝损伤的严重程度、凝血功能障碍、创面感染有关。肝损伤术后早期出血,首选非手术治疗;生命体征不稳或血红蛋白持续下降者需二次手术。术后根据不同的出血原因采取相应的治疗措施,可以最大程度地降低术后出血的病死率。
肝损伤; 肝切除; 出血; 引流; 手术
肝损伤在各种腹部创伤中占20%~30%,发病率仅次于脾损伤,位居第二[1],若不能及时、有效地医治,死亡率高达55%~75%。而肝切除术是严重肝损伤的主要手术方式之一。随着肝脏外科技术的发展,肝切除手术病死率已降至5%以下[2],但出血为肝损伤肝切除术后最严重的并发症,病情复杂,治疗棘手,发生率1%~8%,病死率则高达17%~80%[3],二次手术时创伤大、难度高。故了解肝损伤术后出血的原因对处理此类问题具有重要的指导意义。
临床资料
1 一般资料
回顾性分析2003年9月~2016年9月南京军区福州总医院收治的63例闭合性肝损伤术后患者的临床资料。排除因腹部穿透伤、合并腹腔其他脏器损伤、肝癌或血管瘤破裂出血手术治疗的患者。按照美国创伤外科学会-器官损伤分级(AAST-OIS)及影像学Becker分级,Ⅰ级、Ⅱ级为轻度肝损伤,Ⅲ级、Ⅳ级、Ⅴ级为严重肝损伤,肝损伤程度分级根据术中探查或上腹部CT检查确定:Ⅱ级13例,Ⅲ级21例,Ⅳ级25例,Ⅴ级4例。轻度与严重肝损伤组在年龄(P=0.227)、性别(P=0.958)、手术方式(P=0.122)的差异均无统计学意义,见表1。根据2011年肝脏手术国际研究小组(ISGLS)共识,肝切除术后出血(PHH)的诊断[4]需要在存在腹腔内出血的证据,如通过引流管持续失血或通过腹部成像(超声、CT及血管造影)发现腹腔内血肿、活动性出血的前提下,并满足以下任何一个或多个标准:(1)血红蛋白水平较术后基础水平下降30g/L;(2)任何原因引起术后血红蛋白下降需输浓缩红细胞;(3)需要放射介入(如栓塞)止血;(4)再次剖腹探查止血。根据PHH严重程度,分为A、B、C三级。A级:术后输血≤2U浓缩红细胞;B级:输血>2U浓缩红细胞,可能需要造影检查,但未行介入(栓塞等)治疗;C级:需要介入(栓塞)或者二次手术止血。

表1 肝脏损伤患者一般资料
2 手术方法
取上腹部正中切口,结扎肝圆韧带,常规探查腹、盆腔其他脏器。根据肝脏探查情况,选择不同的手术方式,手术方式包括:单纯肝破裂修补术、肝部分切除、肝段解剖性切除、纱布填塞。术中视血压情况使用Pringle法或不解剖肝门的半肝入肝血流阻断法行肝门阻断,阻断时间≤15min,根据手术情况重复阻断,间隔时间5min,并联合控制中心静脉压在5mmHg以下,同时控制动脉收缩压在80~90mmHg行肝切除。对于肝创面出血,根据管道大小,分别使用电凝止血、结扎止血、缝扎止血。术毕的肝创面处理应用电刀喷凝止血或氩氦刀喷凝止血,大血管出血使用Prolene线缝扎,并覆盖生物止血材料。常规于膈下及肝创面放置2根引流管。
3 手术情况
术中探查可见腹腔积血150~4 000mL,中位积血260mL。63例患者中,根据肝脏损伤情况,单纯肝破裂修补42例,肝Ⅶ/Ⅷ段切除10例,右半肝切除7例,肝Ⅱ/Ⅳ段切除术4例。其中1例术毕止血不满意使用了纱布填塞止血,但于术后第3天因多器官功能衰竭死亡。手术耗时104~508min,中位时间215min;术中出血量150~6 000mL,中位出血量300mL,见表2。

表2 肝损伤患者首次手术的一般情况
4 术后管理
术后即进入ICU病房。监测生命体征及腹腔引流量。术后给予抗感染、抑酸、保肝、营养、补液、维持水、电解质平衡及对症处理,当天加用止血药物。术后1、3、5、7d复查血常规、肝肾功能、电解质、凝血四项。发生出血时每间隔30~60min复查一次血常规、凝血四项。根据患者肝功能情况加或不加白蛋白支持治疗。根据腹腔引流情况复查腹部彩超或CT。肠外营养应用至患者过渡到正常饮食,患者一般情况稳定后,转入外科普通病房。
5 出血处理
发现出血后,立即给予心电监护,吸氧,静脉补液及给予止血药物等处理,监测血常规、凝血四项及引流液,根据血液指标及引流液决定是否输注浓缩红细胞、新鲜冰冻血浆、单采血小板、冷沉淀凝血因子及人纤维蛋白原。严密监测血常规及引流液的变化,对于非手术治疗后生命体征及血红蛋白稳定的患者,继续非手术治疗。患者病情稳定后行影像学检查(床旁彩超或CT等),以明确是否存在活动性出血及腹腔内血肿,根据情况行腹腔穿刺引流术,以防止积血积液继发腹腔感染等相关并发症。对于非手术治疗后血红蛋白仍下降或生命体征不稳定的患者,立即行二次手术止血。
6 术后出血情况
术后至出血间隔时间为2~240h,中位时间24h。23例术后出血患者,20例为PHH,死亡3例,死亡率13.04%。其中2例为二次手术死亡,再次手术病死率18.2%。这3例患者均为严重肝损伤(1例Ⅵ级,2例Ⅴ级),肝脏功能及血管严重受损、凝血功能差、持续失血,最终死于多器官功能衰竭,见表3。
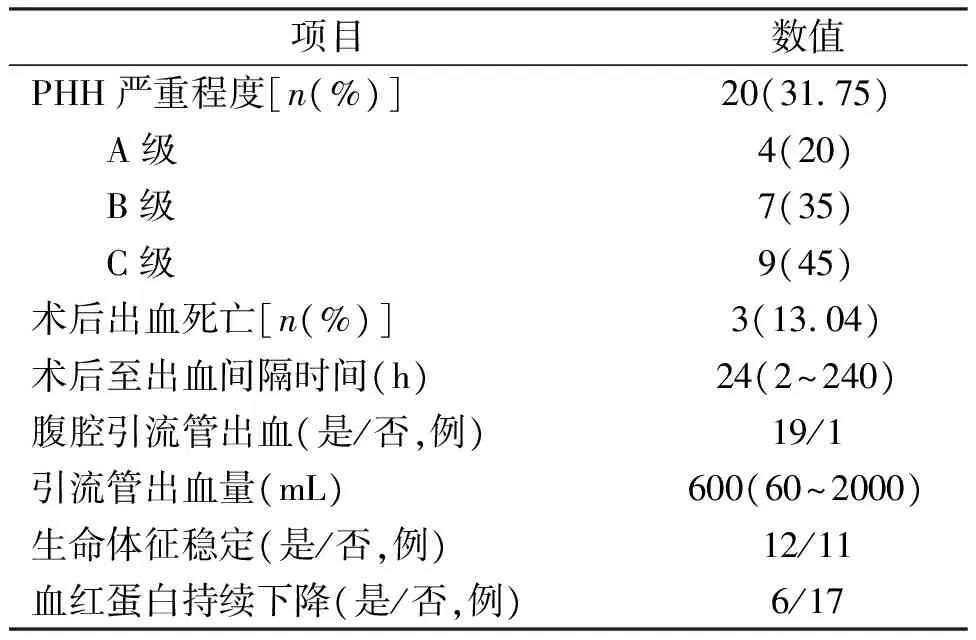
表3 肝损伤术后出血患者相关资料
7 二次手术或介入止血情况
23例术后出血患者,其中11例行二次手术或介入止血,时间为发现出血后1~6h,中位时间3h。出血情况为:肝静脉4例,门静脉1例,肝动脉3例,肝创面渗血3例。11例患者中行右半肝切除4例,Ⅶ/Ⅷ段肝切除2例,单纯肝破裂修补2例,肝Ⅱ/Ⅳ段切除术3例。所有患者均出现了引流管流出大量鲜红色或暗红色血液。二次手术止血方式均为缝扎,介入止血方式为肝动脉栓塞。二次手术9例均未行肝门阻断,1例因肝动脉活动性出血,导致手术视野模糊,行肝门阻断。患者术中输注浓缩红细胞中位量为6U,见表4。
8 统计学处理
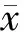
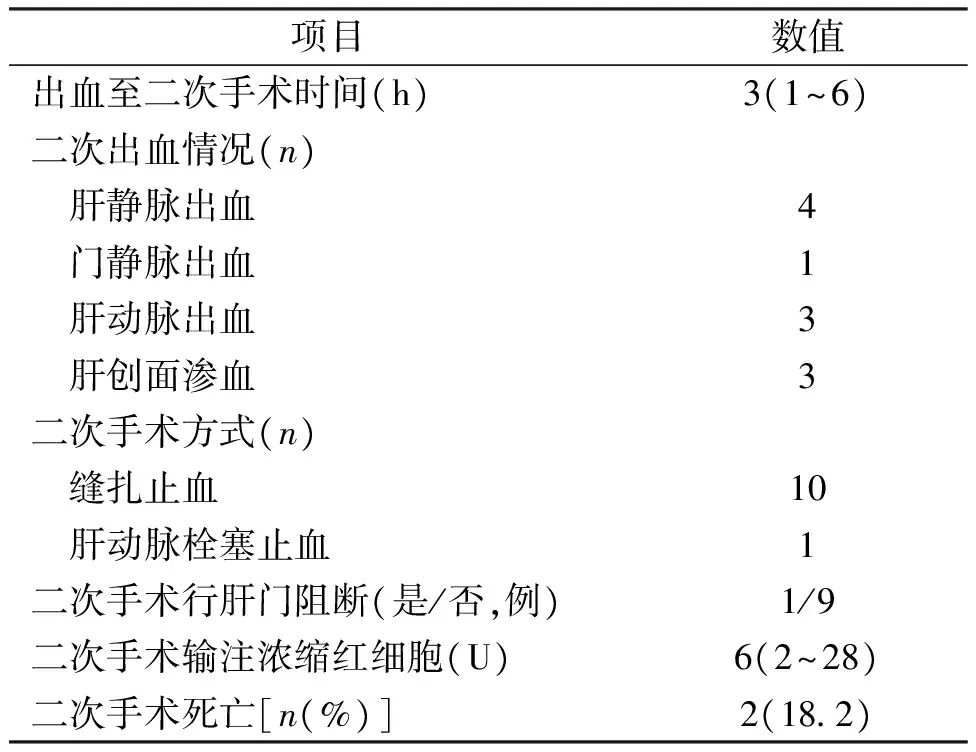
表4 肝损伤术后出血二次手术相关资料
结 果
1 轻度与严重肝损伤组术后出血率的比较
轻度与严重肝损伤组术后出血率的差异有统计学意义(P=0.047),表明严重肝损伤患者的出血率明显高于轻度肝损伤者,提示肝损伤术后出血与肝损伤的严重程度有关,见表5、图1。
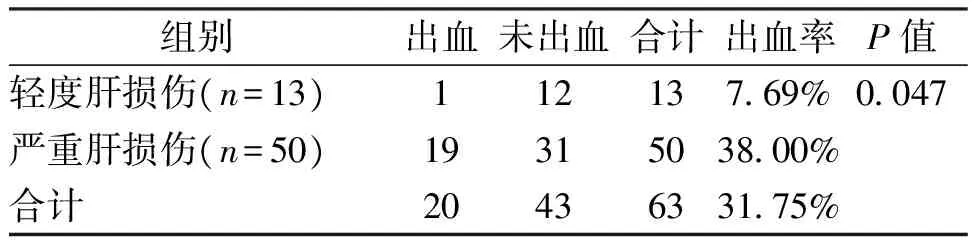
表5 轻度与严重肝损伤组术后出血率比较(n)

图1 肝损伤程度
2 肝损伤术后未出血与出血组术前PT的比较
肝损伤术后未出血与出血组术前PT的差异有统计学意义(P=0.000),表明肝损伤术后出血患者的术前PT延长时间明显长于肝损伤术后未出血者,提示肝损伤术后出血与凝血功能障碍有关,见表6。

表6 肝损伤术后未出血与出血组术前PT比较
3 肝损伤术后是否引流出脓液组出血率的比较
肝损伤术后是否引流出脓液组出血率的差异有统计学意义(P=0.01),表明肝损伤术后引流出脓液患者的出血率明显高于肝损伤术后未引流出者,提示肝损伤术后出血与创面感染有关,见表7、图2。

表7 肝损伤术后是否引流出脓液组出血率比较(n)
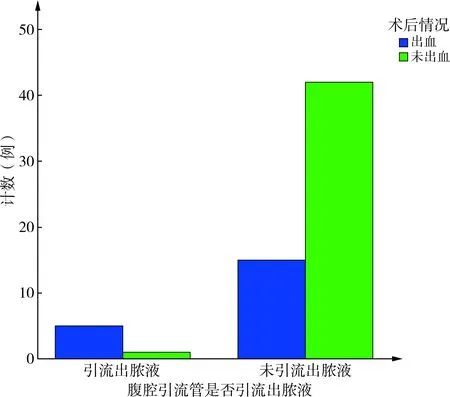
图2 腹腔引流管是否引流出脓液
讨 论
严重肝损伤以行肝切除术的治疗方式为主。肝脏解剖的特点及损伤的复杂性,使肝损伤术后出血的治疗具有一定的难度。术后如继发大出血则病死率明显增高。Lim等[5]研究报道,术中止血不确切及术后血管结扎线滑脱是PHH的常见原因。 Desai等[6]研究表明,肝切除术后大出血可以发生在术后数小时或数日之后,常由术中止血不彻底、血管处置不当,肝断面部分肝组织坏死、继发感染、引流不畅而使创面积液感染,凝血功能障碍等引起。本研究表明,肝损伤术后出血发生在2h~12d,出血原因主要与血管隐匿性出血、肝损伤的严重程度、凝血功能障碍、创面感染有关。Li等[7-8]认为,需要二次手术止血的PHH应在6h内进行,与6h后行手术止血者比较,6h内手术者死亡率明显下降。在本研究中,11例需要二次手术或介入止血的患者从发生出血到二次手术或介入止血的中位时间为3h。笔者对63例闭合性肝损伤术后患者的临床资料经过一系列的分析后,现就肝损伤术后出血的主要原因进行分析并探讨其防治策略。
1 血管隐匿性出血
部分肝损伤患者术中血压常不稳定,休克时血压下降,常可掩盖活动性出血。多发生在术后大量液体复苏的12~48h内,突然自腹腔引流管流出大量鲜红色或暗红色血液。主要原因:(1)术中止血不彻底,遗漏出血点;(2)术中血管处理不当及打结技术不娴熟;(3)肝断面处置不当。防治策略:术中应精细操作、仔细止血。根据管道大小,分别使用电凝止血、结扎止血、缝扎止血,术毕的肝创面处理应用电刀喷凝止血,有条件的医院可使用氩氦刀喷凝止血[9],本中心肝切除创面常规使用氩氦刀喷凝止血。大血管出血使用Prolene线缝扎,并覆盖生物止血材料。加强打结基本功的训练。根据肝断面的情况决定是否行对拢缝合,如肝断面距离合适,张力较小,可将肝断面对拢缝合,这有利于肝创面的止血;若张力较大,不可强行缝合,否则易造成术后肝血管的撕裂出血。本研究中就有2例因肝断面对拢缝合不当撕裂肝静脉引起大出血。此外,在病情允许的情况下,血压上升后检查有无活动出血尤为重要。本研究表明,55%(11/20)A、B级PHH患者可以通过止血药物、输血液制品、补液等非手术治疗治愈。ISGLS分级[4]A、B级PHH患者应首选非手术治疗,这样不仅可避免二次手术对患者的打击,也有助于肝功能的恢复;但若为C级,存在生命体征不稳定、血红蛋白持续下降或引流管持续失血,二次手术仍然是抢救的关键和绝对指征[4-10]。PHH A、B、C级院内死亡率分别为0、17%、50%[11]。PHH二次手术应该尽量遵循损害控制原则,避免进行肝脏阻断[8,12],除非大量的急性活动性出血导致手术视野模糊。本研究中二次手术9例均未行肝门阻断,1例因肝动脉活动性出血,导致手术视野模糊,行肝门阻断。因为肝门阻断会加重肝脏缺血再灌注损伤,从而加重肝脏损害影响凝血功能[13]。
2 肝损伤严重程度
严重肝损伤患者术中血压往往较低,甚至术前已处于休克状态。有些出血点甚至是主要出血点因血压低已无明显出血,甚至停止出血。多发生在术后大量液体复苏至血压上升到一定程度的2~7h内,突然自腹腔引流管流出大量鲜红色或暗红色血液,经临床止血药物、输血、补液等处理后,血压仍然不稳定、血红蛋白持续下降。循环不稳定加剧损害剩余肝,导致肝脏衰竭[14]。防治策略:对于严重肝损伤术后大出血,只有快速止血才是挽救患者生命的唯一选择,手术是止血和挽救生命的关键措施[15]。本研究提倡在快速输血、补液等的同时果断行手术止血。严重肝损伤首次手术方式的选择至关重要,肝Ⅴ、Ⅷ段的严重肝损伤,常伴有肝门静脉、肝动脉、肝静脉、胆管的损伤,肝脏表面可能会有大小不等的裂伤,也可能无明显裂伤,甚至肝包膜也保持完整。对此类深部损伤出血,只有充分显露深部的肝实质损伤部位,于直视下分别结扎破裂的胆管和血管,并清除肝失活组织,才是唯一可靠的方法。对于肝组织碎裂伤,断面水肿、模糊,术中不能明确出血血管,此时如果盲目缝扎,不但起不到止血作用,反而容易损伤肝内重要管道。陈邦飞等[16]报道,在这种情况下可从正常肝实质切开,直接缝扎需要结扎的胆管、血管并修补缝合肝创面,可明显减少肝切除比例及术后肝内血肿、肝内脓肿、胆瘘的发生,术后肝功能恢复快。吴雷等[17]研究表明,对于近肝静脉损伤的处理,采用肝血流分步阻断法能够控制出血,清晰显露损伤近肝静脉。依据血管损伤类型选择近肝静脉损伤修补或非解剖性肝切除。
3 凝血功能障碍
凝血功能障碍多发生在术后3~7d,腹腔引流管引出大量不凝血,常伴有不同程度的切口渗血和皮下瘀血,血小板计数进行性下降、凝血酶原时间、活化部分凝血活酶时间明显延长、纤维蛋白原下降。主要原因:(1)大量出血消耗凝血因子[18-19];(2)肝脏功能不全致合成的凝血因子减少:大量的输血进一步加剧急性肝损伤[14];大范围的肝切除使大量的肝组织丧失;缺血再灌注损伤[13];术中低血压持续时间长,肝组织灌注不足;(3)代谢性酸中毒、低体温、低钙[18]。防治策略:首次手术视血压情况采用Pringle法或不解剖肝门的半肝入肝血流阻断法[20]行肝门阻断联合控制中心静脉压在5mmHg以下[21],同时控制动脉收缩压在 80~90mmHg行肝切除及自体血液回输[22]。值得一提的是:重组活化凝血因子Ⅶ(recombinant activated coagulation factor Ⅶ,rFⅦa)能显著降低肝切除术中的输血要求[23]。手术室应保持恒定的环境温度,输注热血液制品[24]及晶体,注意电解质、酸碱平衡尤其是钙的补充和代谢性酸中毒的纠正以及术中使用暖风机有助于防止意外体温过低。术后病房注意保暖。本研究对于A、B级PHH给予抗纤维蛋白溶酶剂[25],如抑肽酶[26]、氨甲环酸、氨基己酸,维生素K、新鲜冰冻血浆、冷沉淀凝血因子、人纤维蛋白原、单采血小板[27]及保肝处理治愈。尤其是纤维蛋白原的补充:纤维蛋白原是凝血的基础,只有当纤维蛋白原>1. 0g/L时,凝血系统才能发挥正常的止血功能[18]。对于C级PHH,二次手术要慎重,手术时机要把握好。因为如果凝血功能障碍没有得到纠正而盲目地进行手术止血,不但没有治疗意义,而且可能会加速病情恶化。
4 创面感染
创面感染多发生于术后5~12d,出血前有感染的临床表现,腹腔引流管引流出少量鲜红色或暗红色血液,常混有脓液或坏死组织。也可表现为胆道出血,以排黑便为主,常伴有发热、黄疸、上腹痛等症状,出血多呈现周期性。白细胞升高,血红蛋白下降,胆红素升高,彩超或CT发现脓肿形成。主要原因:(1)残肝断面处遗留了过多的血供差或无血供组织;(2)肝切除时:肝静脉受损,残肝静脉回流障碍;胆管受损引起胆漏;(3)残肝断面术后引流不畅;(4)术后输血引起免疫抑制效应[28];(5)肝部分切除降低肝网状内皮系统的吞噬能力[29]。值得注意的是,术中虽然放置了引流管,但术后早期引流管就有可能已被血块或坏死的组织块所阻塞。相关文献表明[30-32],腹腔感染是肝脏损伤常见并发症;严重肝损伤,肝组织损伤广泛,部分肝组织缺血,若清创不完全,较易发生肝组织液化、坏死,形成肝内血肿,出现胆漏、出血;如引流不充分,则常出现膈下感染以及肝脓肿。肝创面局部感染可破坏肝组织血管引起少量出血,若继续发展可继发血管结扎线脱落,导致大出血。防治策略:感染性出血虽然发生晚,但常并发其他感染,预后一般较差,应以预防为主。首次手术应合理处置肝断面及保护好残肝的肝静脉和胆管。术后严密监控,保持术后引流管的通畅性,可间断生理盐水少量冲洗引流管防止引流管堵塞。术后一旦发生出血,主要采取抗感染、止血药物、输血液制品、增强免疫力、持续通畅引流、保肝等非手术治疗。药物非手术治疗无效或突发大出血,生命体征暂稳定时,如动脉性出血可行急诊动脉栓塞[33],静脉性出血或无法判断性质者则应急诊二次手术止血。
总之,肝损伤术后出血病死率高及出血原因各异,只有首次手术做到术前仔细评估,术中精细操作、彻底止血、妥善处理肝脏断面,术后严密监控、通畅引流,才能最大程度地降低肝损伤术后出血的发生率。也只有根据术后出血的不同原因采取相应的治疗措施,才能最大程度地降低肝损伤术后出血的病死率。
[1] Sikhondze WL,Madiba TE,Naidoo NM,et al.Predictors of outcome in patients requiring surgery for liver trauma[J].Injury,2007,38(1):65-70.
[2] 孟超.黄家驷外科学[M].北京:人民卫生出版社,2008:1704-1705.
[3] Poon RT,Fan ST,Lo CM,et al.Improving perioperative outcome expands the role of hepatectomy in management of benign and malignant hepatobiliary diseases:analysis of 1222 consecutive patients from a prospective database[J].Ann Surg,2004,240(4):698-710.
[4] Rahbari NN,Garden OJ,Padbury R,et al.Post-hepatectomy haemorrhage:a definition and grading by the International Study Group of Liver Surgery (ISGLS)[J].HPB(Oxford),2011,13(8):528-535.
[5] Lim C,Dokmak S,Farges O,et al.Reoperation for post-hepatectomy hemorrhage:increased risk of mortality[J].Langenbecks Arch Surg,2014,399(6):735-740.
[6] Desai KK,Dikdan GS,Shareef A,et al.Ischemic preconditioning of the liver:a few perspectives from the bench to bedside translation[J].Liver Transplant,2008,14(11):1569-1577.
[7] Li A,Wu B,Zhou W,et al.Post-hepatectomy haemorrhage:a single-centre experience[J].HPB(Oxford),2014,16(11):965-971.
[8] Yang T,Li L,Zhong Q,et al.Risk factors of hospital mortality after re-laparotomy for post-hepatectomy hemorrhage[J].World J Surg,2013,37(10):2394-2401.
[9] Postema RR,Plaisiert PW,ten Kate FJ,et al.Haemostasis after partial hepatectomy using argon beam coagulation[J].Br J Surg,1993,80(12):1563-1565.
[10] Jin S,Fu Q,Wuyun G,et al.Management of post-hepatectomy complications[J].World J Gastroenterol,2013,19(44):7983-7991.
[11] Reissfelder C,Rahbari NN,Koch M,et al.Postoperative course and clinical significance of biochemical blood tests following hepatic resection[J].Br J Surg,2011,98(6):836-844.
[12] Heriot AG,Karanjia ND.A review of techniques for liver resection[J].Ann R Coll Surg Engl,2002,84(6):371-380.
[13] Jaeschke H.Molecular mechanisms of hepatic ischemia-reperfusion injury and preconditioning[J].Am J Physiol Gastrointest Liver Physiol,2003,284(1):G15-26.
[14] Richardson AJ,Laurence JM,Lam VW.Portal triad clamping versus other methods of vascular control in liver resection:a systematic review and meta-analysis[J].HPB(Oxford),2012,14(6):355-364.
[15] Lee SK,Carrillo EH.Advances and changes in the management of liver injuries[J].Am Surg,2007,73(3):201-206.
[16] 陈邦飞,徐洪波,陶礼钧,等.肝切开缝扎及肝清创切除术治疗肝外伤的疗效评价[J].中华创伤杂志,2005,21(6):470-472.
[17] 吴雷,王学国,赵红岩,等.肝血流分步阻断法在外伤性近肝静脉损伤救治中的应用[J].肝胆胰外科杂志,2016,28(5):405-407.
[18] Silva MA,Muralidharan V,Mirza DF.The management of coagulopathy and blood loss in liver surgery[C].Seminars in hematology.WB Saunders,2004,41:132-139.
[19] Shirabe K,Kajiyama K,Harimoto N,et al.Risk factors for massive bleeding during major hepatectomy[J].World J Surg,2010,34(7):1555-1562.
[20] 黄兴华,胡还章,江艺.半肝入肝血流阻断法与第一肝门血流阻断法在肝癌切除术中应用的比较[J].中华解剖与临床杂志,2015,20(6):546-551.
[21] Cunningham JD,Fong Y,Shriver C,et al.One hundred consecutive hepatic resections:blood loss,transfusion,and operative technique[J].Archives Surg,1994,129(10):1050-1056.
[22] Hendriks HG,van der Meer J,Klompmaker IJ,et al.Blood loss in orthotopic liver transplantation:a retrospective analysis of transfusion requirements and the effects of autotransfusion of cell saver blood in 164 consecutive patients[J].Blood Coagul Fibrinolysis,2000,11:S87-93.
[23] Hendriks HG,Meijer K,de Wolf JT,et al.Effects of recombinant activated factor VII on coagulation measured by thromboelastography in liver transplantation[J].Blood Coagul Fibrinolysis,2002,13(4):309-313.
[24] Bernthal EM.Inadvertent hypothermia prevention:the anaesthetic nurses’ role[J].Br J Nurs,1999,8(1):17-25.
[25] Porte RJ,Leebeek FW.Pharmacological strategies to decrease transfusion requirements in patients undergoing surgery[J].Drugs,2002,62(15):2193-2211.
[26] Pereboom IT,de Boer MT,Porte RJ,et al.Aprotinin and nafamostat mesilate in liver surgery:effect on blood loss[J].Dig Surg,2007,24(4):282-287.
[27] Boylan JF,Klinck JR,Sandler AN,et al.Tranexamic acid reduces blood loss,transfusion requirements,and coagulation factor use in primary orthotopic liver transplantation[J].Anesthesiology,1996,85(5):1043-1048.
[28] Jensen LS,Andersen AJ,Christiansen PM,et al.Postoperative infection and natural killer cell function following blood transfusion in patients undergoing elective colorectal surgery[J].Br J Surg,1992,79(6):513-516.
[29] Schindl MJ,Millar AM,Redhead DN,et al.The adaptive response of the reticuloendothelial system to major liver resection in humans[J].Ann Surg,2006,243(4):507-514.
[30] 何平,高劲谋,胡平,等.肝脏损伤并发腹腔感染的防治[J].创伤外科杂志,2016,18(9):519-521.
[31] Hommes M,Navsaria PH,Schipper IB,et al.Management of blunt liver trauma in 134 severely injured patients[J].Injury,2015,46(5):837-842.
[32] Ward J,Alarcon L,Peitzman AB.Management of blunt liver injury:what is new[J].Eur J Trauma Emerg Surg,2015,41(3):229-237.
[33] 郑本波,张祖建.经导管肝动脉栓塞在治疗外伤性肝破裂出血中的应用[J].肝胆外科杂志,2015,23(5):14.
(本文编辑: 魏巧姝)
Causes analysis and management strategies for postoperativehaemorrhage of blunt liver injury
HUANGChao,ZHANGKun,JIANGYi
(Department of Hepatobiliary Surgery,Fuzong Medical College of Fujian Medical University,Fuzhou General Hospital of Nanjing Military Command,Fuzhou 350025,China)
Objective To analyse the causes and the management strategies for postoperative haemorrhage of blunt liver injury. Methods Clinical data,especially the situation of peritoneal drainage tube of 63 patients with blunt liver injury after surgery was reviewed retrospectively in the Fuzhou General Hospital of Nanjing Military Command between Sep. 2003 and Sep. 2016. According to the severity of liver injury and whether postoperative drainage tube discharged pus,they were respectively divided into mild group and severe group,drainage group and no drainage group to compare differences in bleeding rates. In the light of whether postoperative hemorrhage occurred,they were divided into bleeding group and no bleeding group to compare differences in preoperative prothrombintime (PT). Results Twenty-three cases (36.50%)of 63 cases of blunt liver trauma developed various degrees of haemorrhage,including post-hepatectomy in 20 cases,of which 4 cases were grade A,7 cases were grade B,and 9 cases were grade C by the standard of post-hepatectomy haemorrhage(PHH) of the International Study Group of Liver Surgery(ISGLS).The median time of postoperative haemorrhage occurrence was 24 hours,and was 3 hours from diagnosis of postoperative bleeding to reoperation or intervention. Twelve cases were successfully treated by nonoperative treatment,and eleven cases were treated by second operation,of which nine cases were PHH,with peritoneal drainage of numerous bright or dark red blood in postoperative 48h. Three patients died of postoperative hemorrhage,including two patients of second surgery and the mortality rate was 13.04% (3/23),and reoperation mortality was 18.2% (2/11). Bleeding rates of severe injury group and the drainage group were significantly higher than those of the mild injury group and no drainage group (P=0.047 andP=0.01 ). The extension time of PT in patients with postoperative bleeding was significantly longer than those without bleeding (P=0.000),indicating that postoperative bleeding in liver injury patients may be related to occult bleeding,severity of the injury,coagulation dysfunction and wound infection. Conclusion Bleeding was a serious postoperative complication after liver injury,and the mortality was high,mainly for PHH. Postoperative hemorrhage after liver injury was primarily related to vascular occult bleeding,the severity of liver injury,coagulation dysfunction,and wound infection. Early bleeding of postoperative of liver injury preferred nonoperative treatment,and patients with unstable vital signs or persistent declining of hemoglobin required second surgery. Taking corresponding treatment measures according to different bleeding causes can minimize postoperative bleeding mortality.
liver injury; hepatectomy; postoperative haemorrhage; drainage; operation
南京军区医学科研重大专项基金资助(CNJ15J002;14ZX22)
350025 福州,福建医科大学福总临床医学院(南京军区福州总医院肝胆外科)
江艺,E-mail:jiangyi8183@163.com
1009-4237(2017)04-0244-07
R 657.3
A 【DOI】 10.3969/j.issn.1009-4237.2017.04.002
2016-09-25;
2016-11-20)

