1株绵羊溶血性曼氏杆菌的分离鉴定及致病性研究
李基棕+李文良+毛立+郝飞+杨蕾蕾+张纹纹+江杰元


摘要:为确定导致绵羊细菌性感染死亡的病原,从送检病死绵羊肺脏中分离纯化出1株细菌,并对其进行培养特性观察、生化反应、PCR鉴定、药敏试验和动物致病性试验。结果显示,分离纯化的细菌为革兰氏阴性短杆菌,经生化反应和PCR鉴定为溶血性曼氏杆菌;该细菌对庆大霉素、头孢噻肟高度敏感;对青霉素、四环素、红霉素、利福平、卡那霉素、恩诺沙星和大观霉素耐药;将1×109 CFU/mL菌液10倍系列稀释后感染6~8周龄小白鼠,该细菌对小白鼠的半数致死量为1×106.2 CFU/mL;死亡动物的剖检病变与发病绵羊类似,并从病变器官内分离到细菌。本研究为进一步探讨溶血性曼氏杆菌的致病机理奠定了基础。
关键词:绵羊;溶血性曼氏杆菌;分离鉴定;致病性
中图分类号: S855.1+2文献标志码: A文章编号:1002-1302(2017)07-0156-03
溶血性曼氏桿菌(Mannheimia haemolytica,Mh)别称溶血性巴氏杆菌,该菌属于机会致病菌,可长期寄生于牛、绵羊、山羊等反刍动物及其他动物上呼吸道[1-2]。当受到外界环境骤变、长途运输等刺激出现应激反应,动物机体抵抗力下降,病菌可趁机侵入从而致病,病毒和支原体感染如绵羊肺炎支原体、多杀性巴氏杆菌、副流感病毒等,可使得机体对溶血性曼氏杆菌更易感[3-4]。它能够引起牛、羊肺炎,新生羔羊的急性败血症,给养牛业和养羊业带来较大的经济损失[5]。
2015年底,安徽宣城某养羊场发生疫情,死亡率达10%以上,发病羊主要表现为咳嗽、喘气、流鼻涕等呼吸道症状,剖检病变主要为肺脏出血、充血、水肿、实变。从发病羊肺脏中分离出1株菌株,通过生化鉴定和PCR鉴定,确定该分离株为溶血性曼氏杆菌。
1材料与方法
1.1主要试剂
绵羊鲜血琼脂培养基、微量生化反应管、抗菌药物药敏纸片均购自浙江杭州微生物试剂公司;Taq DNA聚合酶、dNTP、DNA Marker等均购自北京全氏金生物技术有限公司。其他试剂均为国产分析纯。
1.2试验动物
6~8周龄BALB/c小鼠,购自扬州大学比较医学中心。
1.3病原的分离
无菌采集绵羊肺脏组织块接种于鲜血琼脂平板上,培养24 h后,挑取单个菌落进行纯化。挑取纯化的菌落涂片进行革兰氏染色镜检。
1.4生化试验
将纯化的菌落按照常规方法接种于葡萄糖、麦芽糖、甘露醇等生化鉴定管中,置于37 ℃恒温培养箱中培养,观察其生化特性。
1.5PCR鉴定
参照Alexander等基于lkt基因设计的溶血性曼氏杆菌特异性引物(LktF:5′-GCAGGAGGTGATTATTAAAGTGG-3′;LktR:CAGCAGTTATTGTCATACCTGAAC)[4]进行PCR扩增,预期扩增片段大小为206 bp。
以纯培养细菌的染色体DNA为模板,PCR反应体系为25 μL:Taq DNA聚合酶0.5 μL,DNA模板2 μL,引物P1、P2各1 μL,10×PCR buffer 2.5 μL,dNTPs 1 μL,无菌水18 μL。反应程序:94 ℃ 5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 10 min。反应结束后取PCR产物于1.2%的琼脂糖凝胶中电泳检测。将目的片段切胶回收,并与pMD19-T载体连接,转化DH5α感受态细胞,经鉴定正确后送南京金斯瑞生物技术有限公司测序。1.6耐药性试验
采用纸片扩散法进行药敏试验,将分离的溶血性曼氏杆菌均匀涂布于鲜血琼脂平板上,然后将药敏纸片紧贴于琼脂表面,37 ℃培养24 h,测量抑菌圈直径。
1.7小鼠致病性试验
将分离纯化的菌株接种于含犊牛血清的LB液体培养基中,37 ℃培养24 h,取菌液10倍系列稀释,进行活菌平板计数。取小鼠30只,随机分为6组,将计数后的菌液进行腹腔注射,菌液(108、107、106、105、104 CFU/mL)0.2 mL/只,测定其致病性。对照组注射等量的培养基。对死亡小鼠进行剖检,观察组织病变,同时采集肺、脾、肝进行细菌分离培养。
2结果与分析
2.1细菌的分离培养
病原菌在绵羊鲜血琼脂平板上培养24 h后,形成圆形、光滑、湿润、半透明、不溶血的小菌落。革兰氏染色呈短小、多个的阴性菌(图1)。
2.2生化鉴定
该菌可发酵葡萄糖、麦芽糖、鼠李糖、L-阿拉伯糖、甘露醇,不发酵乳糖、吲哚、甘露糖,符合曼氏杆菌生化特性。
2.3PCR鉴定
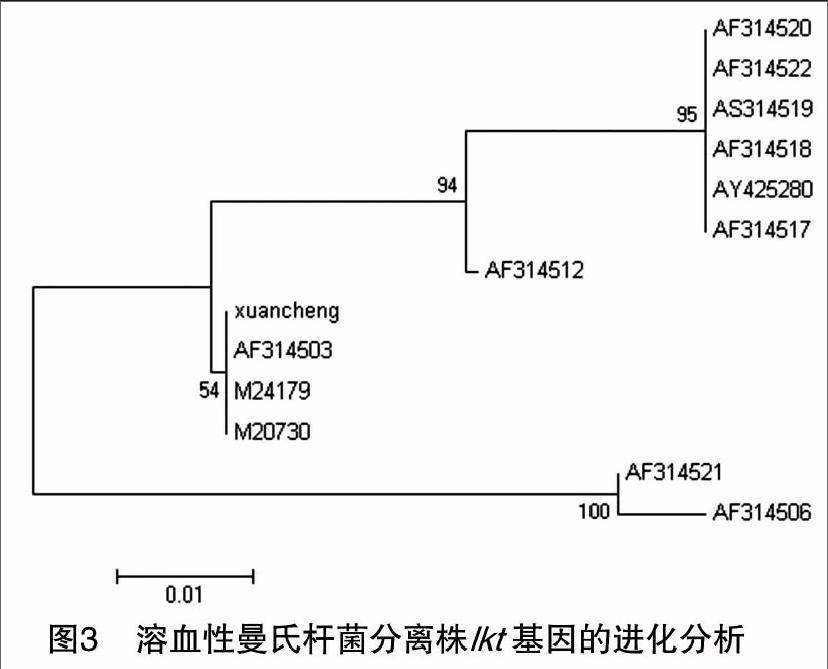
将分离的病原菌进行PCR扩增,得到与预期结果相符合的206 bp的特异性核酸片段(图2)。测序结果表明,该分离株与GenBank中登录的AF314503、M24179、M20730、AF314512、AF314520、AF314522、AS314519、AF314518、AY425280、AF314517、AF314521、AF314506同源性较高,均在94%以上。进化树分析发现,该毒株与AF314503、M24179、M20730亲缘关系最近,共同组成1组微小分支(图3)。
2.4药敏试验
对分离到的菌株进行药敏试验,结果表明,该细菌仅对庆大霉素和头孢噻肟高度敏感;对链霉素、阿奇霉素、头孢曲松和氨苄西林中度敏感;对青霉素、四环素、红霉素、利福平、卡那霉素、恩诺沙星和大观霉素不敏感(表1)。
2.5致病性试验
过夜培养的细菌经平板计数,菌液细菌数为1×109 CFU/mL,取菌液10倍系列稀释腹腔接种小鼠,6 h后108 、107 CFU/mL 剂量组均有不同程度的发病,12 h后除105 、104 CFU/mL组外均出现死亡,对照组小鼠未见异常(表2)。因此,该分离菌对6~8周龄BALB/c小鼠的LD50为106.2 CFU/mL。
表2不同稀释度溶血性曼氏杆菌的致病性试验
试验动物不同稀释度的致死数10102103104105LD50
(CFU/mL)试验鼠5/55/53/50/50/5106.2
3讨论
溶血性曼氏杆菌是牛和羊鼻咽部的共生菌,主要引起肺炎、新生羔羊败血症、羊乳腺炎等,也是犊牛“船运热”的主要病原。目前,该病原流行较广,Shanthalingam等从40份发病羊肺脏中分离到8株溶血性曼氏杆菌[6];冯旭飞等对四川地区临床采集的120份肺组织和鼻拭子进行检测,结果检出率达51.67%[7];李娟等、徐慧等和李雪霞等分别证实了该病原在江苏、新疆和云南地区的流行[5,9-10]。
本研究从发病羊肺脏中分离并纯化细菌,经菌落形态、生化特征和PCR鉴定,最终确定其为溶血性曼氏杆菌。综合临床症状、染色镜检可以有效缩小病原菌范围,结合PCR和测序鉴定,能够更加准确地确定该病原。致病性结果表明,108、107 CFU/mL剂量组感染小白鼠后,6 h出现不同程度发病症状,表现为精神沉郁、食欲废绝等,12 h相继出现死亡,而对照组未见异常。死亡小鼠的剖检病变为肺脏充血,肝脏和脾脏肿大等,从死亡小鼠脏器中分离出与感染菌株形态特征一致的菌株。
抗生素的使用是养殖户预防和治疗疾病的重要手段,细菌的耐药性是困扰养殖户的一大难题。本研究的试验结果表明,溶血性曼氏杆菌对庆大霉素和头孢噻肟高度敏感;对青霉素、四环素、红霉素、利福平、卡那霉素、恩诺沙星和大观霉素等药物产生了耐药性,与冯旭飞等[6]、Katsuda等[11]和 Lubbers 等[12]报道不尽相同,说明不同地域分离株耐药性存在一定差异。该试验结果也为发病羊群正确合理用药提供参考。
目前,疫苗免疫是控制溶血性曼氏杆菌病的重要措施之一,由于各血清型之间交叉免疫保护性较低,疫苗的免疫谱窄,以至于本病未能得到有效的控制。因此,有待于研发预防溶血性曼氏杆菌病更佳的疫苗[13-14]。
参考文献:
[1]Rice J A,Carrasco-Medina L C,Hodgins D C,et al. Mannheimia haemolytica and bovine respiratory disease[J]. Animal Health Research Reviews,2008,8(2):117-128.
[2]陈艳红,颜忠,查振林,等. 溶血性曼氏杆菌致病机制的研究进展[J]. 中国畜牧兽医,2010,37(12):153-155.
[3]韩猛立,康立超,钟发刚,等. 细菌性牛呼吸道疾病的研究进展[J]. 中国畜牧兽医,2013,40(5):165-172.
[4]Alexander T W,Cook S R,Yanke L J,et al. A multiplex polymerase chain reaction assay for the identification of Mannheimia haemolytica,Mannheimia glucosidal and Mannheimia ruminalis[J]. Veterinary Microbiology,2008,130(1/2):165-175.
[5]李娟,刘阳,彭欠欠,等. 羊溶血性曼氏杆菌的分离与鉴定[J]. 黑龙江畜牧兽医,2013(20):96-97.
[6]Shanthalingam S,Goldy A,Bavananthasivam J,et al. PCR assay detects Mannheimia haemolytica in culture-negative pneumonic lung tissues of bighorn sheep(Ovis canadensis) from outbreaks in the western USA,2009-2010[J]. Journal of Wildlife Diseases,2014,50(1):1-10.
[7]馮旭飞,刀筱芳,王志敏,等. 绵羊肺脏中溶血性曼氏杆菌的分离鉴定及其药物敏感性分析[J]. 中国畜牧兽医,2014,41(8):224-228.
[8]冯旭飞,刀筱芳,李定菲,等. 溶血性曼氏杆菌和多杀性巴氏杆菌双重 PCR 检测方法的建立及应用[J]. 中国兽医科学,2014,44(6):624-629.
[9]徐慧,贺云霞,龚玉梅,等. 溶血性曼氏杆菌的分离鉴定[J]. 黑龙江畜牧兽医(科技版),2009(12):97-98.
[10]李雪霞,李富祥,赵文华,等. 云南羊溶血性曼氏杆菌的分离鉴定及药敏试验[J]. 上海畜牧兽医通讯,2014(1):36-38.
[11]Katsuda K,Kohmoto M,Mikami O. Relationship between serotype and the antimicrobial susceptibility of Mannheimia haemolytica isolates collected between 1991 and 2010[J]. Research in Veterinary Science,2013,94(2):205-208.
[12]Lubbers B,Hanzlicek G. Antimicrobial multidrug resistance and coresistance patterns of Mannheimia haemolytica isolated from bovine respiratory disease cases—a three-year (2009—2011) retrospective analysis[J]. Journal of Veterinary Diagnostic Investigation,2013,25(3):413-417.
[13]Ayalew S,Confer A,Hartson S,et al. Immunoproteomic analyses of outer membrane proteins of Mannheimia haemolytica and identification of potential vaccine candidates[J]. Proteomics,2010,10(11):2151-2164.
[14]Confer A,Ayalew S,Panciera R,et al. Recombinant Mannheimia haemolytica serotype 1 outer membrane protein PlpE enhances commercial M. haemolytica vaccine-induced resistance against serotype 6 challenge[J]. Vaccine,2006,24(13):2248-2255.

