基于ITS2条形码和化学指纹鉴别何首乌及其伪品
尚飞能,方海兰,段宝忠,2*
(1.大理大学药学与化学学院,云南大理 671000;2.中国中医科学院中药研究所,北京 100071)
基于ITS2条形码和化学指纹鉴别何首乌及其伪品
尚飞能1,方海兰1,段宝忠1,2*
(1.大理大学药学与化学学院,云南大理 671000;2.中国中医科学院中药研究所,北京 100071)
目的:研究何首乌及其伪品的分子和化学鉴别方法,为其用药安全提供保障。方法:采用DNA条形码和高效液相色谱法,比较何首乌及其伪品酱头ITS2条形码和HPLC化学指纹图谱的差异。结果:何首乌及酱头ITS2长度分别为193 bp和206 bp,何首乌种内K2P遗传距离小于酱头的种间距离,且两者化学指纹存在明显差异。结论:DNA条形码和化学指纹图谱方法,是鉴别何首乌及伪品的有效手段。
何首乌;伪品;DNA条形码;化学指纹;ITS2
何首乌为蓼科植物何首乌Polygonum multijiorum Thunb.的干燥块根,具有解毒、润肠通便、补肝肾、乌须发等功效〔1〕,作为大宗常用药材,被广泛应用在药品、保健品及日用化工等领域。笔者前期调研发现,同属植物酱头Polygonum denticulatum C.C. Huang的块根,在云南药材市场上常与何首乌互相混用,对临床用药安全存在较大的安全隐患。目前,有关何首乌与混用品酱头的鉴定仅见外观性状、显微结构、薄层色谱以及trnL-trnF、matK等分子鉴定的相关报道〔2-4〕,但这些方法易受到生物体生长发育、外在环境变化及主观因素等影响〔5〕。鉴于此,研究DNA条形码及化学指纹图谱法对何首乌及其混用品酱头的鉴别具有现实意义。
高效液相指纹图谱方法具有快速,稳定,且可直观的观察到所检测样品成分差异情况的优点。近年来,DNA条形码技术已成为物种鉴定的研究热点和传统鉴别的重要补充〔6〕,同时ITS2条形码被证实是中药材鉴定的首选片段,该技术不受药材本身性状和外界因素影响,具有简便高效、重复性好、可实现对未知物种的鉴定且鉴定结果准确等优点〔7〕。本实验利用DNA条形码和高效液相色谱技术,建立何首乌及其混用品酱头的鉴别方法,以期为何首乌药材的用药安全及质量控制提供参考。
1 材料、仪器与试剂
1.1材料8批药材样品购于药材市场,经大理大学段宝忠副教授鉴定为何首乌Polygonum multiflora Thunb.和酱头Polygonum denticulatum C.C.Huang。见图1~2。凭证标本保存于大理大学药学与化学学院生药标本室。同时从GenBank数据库中下载何首乌和酱头的ITS2序列各3条。见表1。
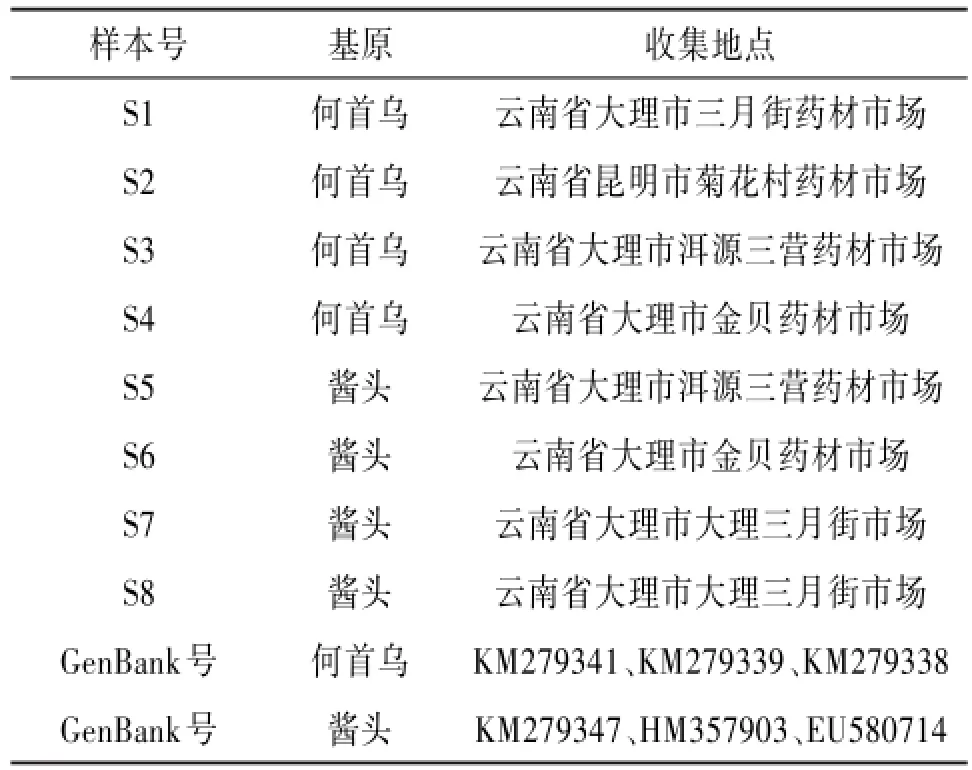
表1 样品及下载序列信息

图1 何首乌药材

图2 酱头药材
1.2仪器植物组织研磨仪(Retsch MM400,Ger⁃many);PCR仪(Applied Biosystems®,2720,USA);ABI 3730XL测序仪(Applied Biosystems Co.,USA)。Agi⁃lent1200高效液相色谱系统(Agilent Technologies,USA),包括四元梯度泵、自动进样器、柱温箱、G1314C/DVWD检测器、Chemstation工作站;Agilent Zorbax SB C18色谱柱(4.6 mm×250 mm,5μm,USA)。超声仪(昆山市超声仪器有限公司,KQ-400KDE);电子分析天平(AND GH-252);电热鼓风干燥箱(上海市嵩明实验仪器厂,01A-2B);中药粉碎机(天津泰斯特仪器有限公司,FY-135)。
1.3试剂植物组织提取试剂盒(Tiangen Biotech Co.,China)和2×Taq plus PCR Master Mix均购于北京天根生物技术有限公司;通用引物ITS2(2F:5’-ATGCGATACTTGGTGAAT-3’,3R:5’-GACCCTT CTCCAGACTACAAT-3’)由北京美吉生物医药科技有限公司合成。色谱级甲醇、乙腈(Fisher Scientific,Fairlawn New Jersey),水为超纯水,其他试剂均为分析纯。
2 方法
2.1 DNA提取、PCR扩增、测序和序列分析
2.1.1 DNA提取 分别取何首乌及伪品酱头药材根的内部约40 mg,用植物组织研磨仪研磨成细粉(2 min,40 Hz/min);总DNA提取在植物组织提取试剂盒的基础上进行了改进。取样后,使用核分离缓冲液(100 mmol/L Tris-HCl,pH 8.0;20 mmol/L EDTA(乙二胺四乙酸),pH 8.0;0.7 mmol/L NaCl;2%PVP40(聚乙烯吡咯烷酮40);2%β-巯基乙醇)抽提2次;水浴温度为54℃,水浴时间6 h;水浴后,使用氯仿-异戊醇(24∶1)抽提2~3次。采用NanoDrop 2000(Thermo Scientific,USA)测定A260/A280比值及DNA浓度。
2.1.2 PCR扩增和测序 参考文献〔8〕方法进行PCR扩增。PCR反应体积为25μL,体系内含2×Taq plus PCR Master Mix 12.5μL,上下游引物各1μL(10μmol/L),总DNA 1μL,ddH2O 9.5μL。PCR扩增程序:94℃预变性5 min,再进行40个循环(94℃变性30 s,50℃退火30 s,72℃延伸45 s),最后72℃延伸10 min。PCR扩增产物经纯化后使用ABI 3730 XL测序仪进行双向测序。
2.1.3 序列分析 使用序列拼接软件CodonCode Aligner V 5.1.5(CodonCode Co.,USA)对测序峰图进行校对和序列拼接,去除低质量序列及引物区。应用MEGA 6.05计算种间和种内K2P(Kimura 2-parameter)遗传距离,并构建NJ系统发育聚类树,利用bootstrap(1 000次重复)检验各分支的支持率。
2.2 HPLC指纹图谱分析
2.2.1 供试品溶液 取药材粉末(过40目筛)1 g加入到具塞三角烧瓶中,加甲醇25 mL,精密称定,超声提取30 min,冷却至室温,用甲醇补足失重,摇匀,过滤,取滤液,用0.45μm微孔滤膜过滤,即得。
2.2.2 色谱条件及系统适用性 色谱柱为Agilent 1 200 series 20RBAX SB-C18柱(5μm,4.6 mm×150 mm);流动相为乙腈(A)-0.1%磷酸(B);梯度洗脱70 min;0~5 min,5%A;5~10 min,5%~15%A;10~30 min,15%~30%A;30~50 min,30%~70%A;50~65 min,70%~100%A;65~70 min,100%~5%A;流速为1.0 mL/min,柱温为30℃,进样量20μL。
3 结果与分析
3.1 ITS2序列特征和种内种间差异分析4份何首乌药材的ITS2序列的长度均为193 bp,GC含量为79.0%~80.0%,平均GC含量为80.0%。4份酱头的ITS2序列的长度均为206 bp,GC含量为68.0%~ 70.0%,平均GC含量为69.0%。何首乌种内K2P遗传距离为0.000~0.005,平均距离为0.003。酱头种内K2P遗传距离为0.005~0.025,平均距离为0.012。何首乌与酱头种间遗传距离为1.249~1.294,平均距离为1.260。
3.2 NJ树结果分析采用邻接法构建系统发育树,对8份样本及GenBank下载的6份ITS2序列进行整合分析。结果表明样品S1~S4和KM279341、KM279339、KM279338单独聚为一枝,样品S5~S8与KM279347、HM357903、EU580714单独聚为一枝,二者均表现出良好的单系性。见图3。因此,利用ITS2序列能够有效的鉴定何首乌与其混用品酱头。
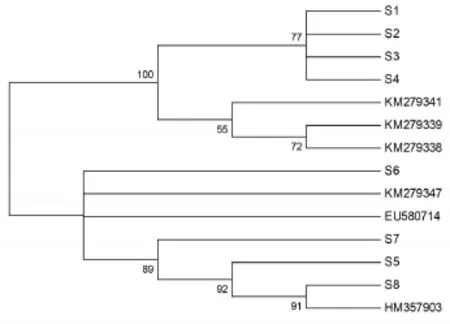
图3 基于ITS2序列构建的何首乌及酱头NJ图
3.3化学色谱比较分析按照《中药质量标准分析方法验证指导原则》操作,以各峰保留时间计算高效液相色谱方法的精密度、稳定性和重现性的RSD值,各值均小于1.21%。8份药材样品分别记录HPLC色谱图,根据保留时间标定共有色谱峰,两种药材的代表色谱图见图4,从图4可看出,在该色谱条件下,何首乌和酱头化学色谱图差异明显,何首乌的色谱峰明显多于酱头,二者仅有4个共有峰,上述结果表明二者化学成分差异较大。因此,实际应用中,因其外形相似而把酱头误作何首乌使用,对临床用药安全具有极大隐患。
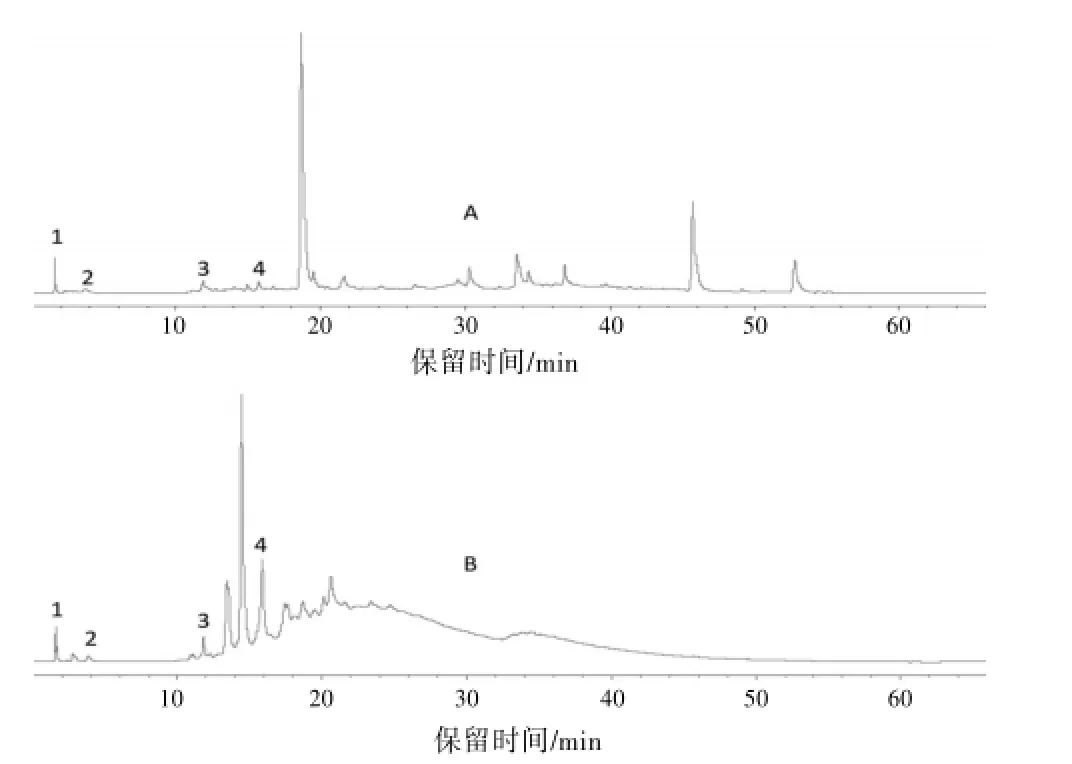
图4 何首乌及酱头药材HPLC色谱图
4 结论
随着中医药产业及中药保健品的迅速发展,市场对中药材的供需矛盾加剧,中药材原材料的真伪关系到药品的安全性和有效性,确保中药材原料的来源可靠,质量稳定,是当前生产中迫切需要解决的问题。本实验结果表明,基于ITS2条形码和化学指纹图谱可有效鉴别何首乌药材及其伪品,二者HPLC指纹图谱显示其化学成分差异显著,两者不可替代使用,应引起生产者、使用者的注意。DNA条形码技术可根据中药材DNA分子信息鉴定其物种基原,实现药材的真伪鉴定〔9-10〕;化学指纹图谱方法可通过指纹图谱差异对其真伪进行判断,并可实现成分定量评价药材质量〔11〕。二者相对独立,结果可互为补充,其联用为易混淆中药材的真伪鉴别及生产质量控制提供了有效手段。
〔1〕国家药典委员会.中华人民共和国药典〔M〕.北京:中国医药科技出版社,2015.
〔2〕夏从龙,李龙星.何首乌与伪品酱头的鉴别〔J〕.时珍国医国药,2003,14(9):540.
〔3〕生书晶,严萍,郑传进,等.何首乌及其常见混淆品的matK基因序列分析及鉴别〔J〕.中药材,2010,33(11):1707-1711.
〔4〕郑传进,生书晶,赵树进.基于trnL-trnF序列分析的何首乌PCR-RFLP分子鉴别〔J〕.中药材,2012,35(4):543-547.
〔5〕方海兰,夏从龙,段宝忠,等.基于DNA条形码的中药材种子种苗鉴定研究:以重楼为例〔J〕.中药材,2016,39(5):986-990.
〔6〕陈士林,姚辉,韩建萍,等.中药材DNA条形码分子鉴定指导原则〔J〕.中国中药杂志,2013,38(2):141-148.
〔7〕陈士林,姚辉,宋经元,等.基于DNA barcoding(条形码)技术的中药材鉴定〔J〕.世界科学技术-中医药现代化,2007,9(3):7-12.
〔8〕CHEN S,YAO H,HAN J,et al.Validation of the ITS2 re⁃gion as a novel DNA barcode for identifying medicinal plantspecies〔J〕.PLoS ONE,2010,5(1):8613.
〔9〕熊波,赵志礼,倪梁红,等.DNA条形码技术在中药鉴定中的应用、局限性与展望〔J〕.中药材,2015,38(10):2202-2206.
〔10〕陈士林,郭宝林,张贵君,等.中药鉴定学新技术新方法研究进展〔J〕.中国中药杂志,2012,37(8):1043-1055.
〔11〕易伦朝,吴海,梁逸曾.色谱指纹图谱与中药质量控制〔J〕.色谱,2008,26(2):166-171.
Identification of Polygonum multiflora and Its Adulterants based on ITS2 Barcode and ChemicalFingerprint
Shang Feineng1,Fang Hailan1,Duan Baozhong1,2*
(1.College of Pharmacy and Chemistry,Dali University,Dali,Yunnan 671000,China;2.Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences,Beijing 100071,China)
Objective:To develop a rapid identification method to discriminate Polygonum multiflorum and its adulterants,and to guarantee the quality and safety in medication.Methods:DNA barcode and high performance liquid chromatography(HPLC)were used to compare the ITS2 barcode and the HPLC chemical fingerprint between Polygonum multiflorum and Polygonum denticulatum.Results:The ITS2 length of Polygonum multiflorum and Polygonum denticulatum were 193 bp and 206 bp,respectively.The intraspectific K2P genetic distance of Polygonum multiflorum was shorter than the intraspectific distance of Polygonum denticulatum. Furthermore,there were obvious differences between their chemical fingerprints.Conclusion:DNA barcode and chemical fingerprint both can be used to identify Polygonum multiflorum and its adulterants effectively.
Polygonum multiflorum;adulterants;DNA barcode;chemicalfingerprint;ITS2
R282.5
A
2096-2266(2017)04-0012-04
10.3969/j.issn.2096-2266.2017.04.004
(责任编辑 李 杨)
国家自然科学基金资助项目(31460084);云南省中青年学术技术带头人后备人才项目(2015HB058);云南省教育厅科学研究基金资助项目(2014Z135)
2016-11-17
2016-12-16
尚飞能,硕士研究生,主要从事中药资源与鉴定.
*通信作者:段宝忠,副教授.

