盐穗木盐相关转录因子HcSCL13基因启动子的克隆及活性初步分析
樊寿德 王艳
(新疆大学生命科学与技术学院 新疆生物资源基因工程重点实验室,乌鲁木齐 830046)
盐穗木盐相关转录因子HcSCL13基因启动子的克隆及活性初步分析
樊寿德 王艳
(新疆大学生命科学与技术学院 新疆生物资源基因工程重点实验室,乌鲁木齐 830046)
为探明盐穗木盐相关转录因子基因HcSCL13的表达调控规律,利用基因组步移法成功克隆获得该基因2 200 bp 的启动子序列。PlantCARE数据库分析结果表明,该启动子不仅含有启动子区的核心元件 CAAT-box和 TATA-box,还包含多个与逆境应答有关的顺式调控元件。将克隆获得的 HcSCL13转录因子基因启动子序列定向替换pBI121载体上的35S启动子,构建融合表达载体并转染模式植物拟南芥,对转基因拟南芥进行GUS组织化学染色。结果显示转基因拟南芥整株被染色,提示该启动子具有表达活性且可能为组成型启动子。
盐穗木转录因子HcSCL13基因;染色体步移;启动子克隆;元件及启动活性分析
基因的表达可受转录、翻译等不同水平上的调控。转录水平的调控在植物基因调控中发挥着重要作用,涉及多种顺式作用元件和反式作用因子。启动子作为转录水平上重要的调控元件,通常是指位于基因上游,紧邻转录起始位点的一段提供RNA聚合酶识别和结合的DNA序列,通过与特定的转录因子结合,控制基因转录的起始、效率及时空特异性。启动子的特定基序也可响应激素(生长素、脱落酸、赤霉素、茉莉酸、油菜素内酯、水杨酸)[1,2]和环境胁迫(冷胁迫、伤害胁迫、干旱胁迫及高盐胁迫)等[3,4],从而调节下游基因应对环境变化。因此,对启动子及其基序进行分析有助于进一步了解下游基因的表达模式及生理调节。在转基因植物研究中,组成型启动子,如35S[5,6]、Actin[7]和 Ubipuitin[8,9]的启动子,已被广泛应用。
GRAS家族是一类植物特有的转录调控因子,由最初发现的3个家族成员GAI、RGA和SCR的特征字母命名[10]。目前已在拟南芥、水稻、葡萄、佛手、胡杨、枳、番茄、烟草等多种植物中发现GRAS家族基因,根据模式植物拟南芥和水稻基因组中的33个及57个GRAS家族成员可将GRAS家族分成8个分支,分别为:SCL3、SHR、PAT1、LISCL、DELLA、SCR、LS和HAM[11]。在植物中GRAS蛋白数量众多,功能多样,是许多重要生长发育过程中的关键调控蛋白。近年来陆续报道关于GRAS家族蛋白在植物逆境胁迫中发挥重要作用,已成为研究的热点。Torres-Galea等[12]检测拟南芥PAT1分支AtSCL13表达模式时发现,在盐、干旱、低温等非生物胁迫及植物激素刺激下均能诱导表达AtSCL13;同属PAT1分支的佛手GRAS基因,在低温胁迫下其表达明显上调[13];徐凯等[14]从水稻中克隆了GRAS基因OsGRAS23,能提高转基因水稻对干旱胁迫的耐受性;从甘蓝型油菜中分离的GRAS基因 BnLAS,能使转基因植株叶片气孔密度增加,同时增加了叶表面蜡质的分泌,从而增强了植株对干旱的耐受性[15];马洪双等[16]从胡杨中克隆了GRAS基因PeSCL7,该基因定位在细胞核中,并能够显著提高转基因拟南芥对干旱和盐的耐受性;山葡萄PAT1分支基因VaPAT1能够同时提高转基因拟南芥对冷、干旱和盐胁迫的耐受性[17];刚毛柽柳GRAS基因启动子序列含有多个与逆境应答有关的顺式调控元件以及一些光响应元件,可能在植物的逆境胁迫响应和光响应中起作用[18]。尽管GRAS家族参与植物抗逆功能的研究越来越多,但有关该家族基因启动子如何在转录水平进行调控鲜有报道。
盐穗木(Halostachys caspica)是盐生、旱生稀盐多汁半灌木,生长于荒漠地区盐碱地、盐湖边及河岸,具有重要生态价值的盐生植物[19-22],成为研究盐碱胁迫机制和进行抗旱耐盐碱胁迫基因及启动子克隆的理想材料。HcSCL13是盐穗木中发现的第一个具有典型C端保守结构域的GRAS转录因子家族基因,隶属该家族PAT1分支,与拟南芥AtSCL13同源性最高,实时荧光定量PCR结果显示HcSCL13基因在盐胁迫条件下表达量显著上升[23],推测其可能在盐穗木耐盐机制中发挥重要作用。
本实验基于小组前期克隆获得的盐穗木HcSCL13基因全长,设计特异性引物,采用染色体步移技术克隆获得了该基因的启动子序列,使用PlantCARE数据库对启动子序列进行分析,同时构建偶联GUS报告基因的植物表达载体 PHcSCL13∶GUS,通过GUS组织化学染色分析HcSCL13基因启动子的活性,旨在为研究HcSCL13基因参与盐胁迫响应的调控模式和信号转导途径提供参考。
1 材料与方法
1.1 材料
盐穗木种子(Halostachys caspica Drob.)采自新疆103团通古特沙漠。在温室中于营养土、珍珠岩和蛭石(2∶1∶1)的混合基质中进行种子萌发,平均培养温度25℃,光照时间16 h/d,相对湿度40%。以生长3个月左右的盐穗木幼苗作为实验材料,提取基因组DNA。
野生型拟南芥(Arabidopsis thaliana)为Col生态型。拟南芥种子经4℃春化2 d,次氯酸钠表面消毒后,播种于1/2MS固体培养基上,8 d后将幼苗转移至营养土中生长约4周,花序浸染法进行转染。
植物基因组提取试剂盒、PCR回收纯化试剂盒、Taq DNA 聚合酶购自TIANGEN公司;Genome Walking Kit试 剂 盒、Ex Taq酶、pMD18-T Vector、限制性内切酶Hind III、Xba I购自TaKaRa公司;In-Fusion HD Cloning Kit购自Clontech公司;E. coli DH5α感受态细胞购自北京全式金公司;其它抗生素类均为国产分析纯。
1.2 方法
1.2.1 HcSCL13基因启动子克隆及其序列分析 称取盐穗木同化枝0.1 g,按照植物基因组提取试剂盒(天根生化科技有限公司,北京)说明书提取盐穗木基因组DNA,基因组的浓度和纯度用NanoDropTM分光光度计和琼脂糖凝胶电泳进行检测。
以盐穗木基因组DNA为模板,根据TaKaRa公司Genome Walking Kit说明书,以HcSCL13 基因序列设计巢式PCR特异性引物SP1、SP2、SP3。首先以纯化后的盐穗木基因组DNA为模板,根据试剂盒PCR反应体系,分别以试剂盒中提供的4种独特简并引物AP1、AP2、AP3、AP4及HcSCL13基因特异性引物SP1进行第一轮巢式PCR。再取第一轮巢式PCR反应产物1 μL作为第二轮巢式PCR反应的模板,上一轮对应的简并引物为上游引物,SP2为下游引物,进行第二轮巢式PCR。取第二轮巢式PCR反应产物1 μL作为模板,再以上一轮对应的简并引物为上游引物,SP3引物为下游引物,进行第三轮巢式PCR,经过三轮PCR得到HcSCL13基因上游的侧翼序列。
使用PCR回收试剂盒(天根生化科技有限公司,北京)对第三轮巢式 PCR产物进行回收纯化。将回收产物与pMD18-T载体连接,转化大肠杆菌DH5α后挑取单克隆菌,菌液PCR验证后,送上海生物工程有限公司测序。利用DNAMAN对测序结果与HcSCL13 5' UTR区进行比对,并根据拼接完好的启动子序列结果设计特异性引物,以盐穗木基因组DNA 为模板进行 PCR扩增,从而进一步验证克隆得到的启动子序列的正确性。采用PlantCARE在线分析软件对克隆获得的启动子序列进行分析,预测其可能存在的顺式作用元件。
1.2.2 植物表达载体PHcSCL13∶GUS 的构建 为分析盐穗木HcSCL13启动子的活性以及其时空表达特异性,用HcSCL13基因启动子PHcSCL13定向替换植物表达载体pBI121上启动GUS基因的35S启动子,使之与GUS基因融合,构建如图1所示。根据HcSCL13基因启动子的序列设计特异性引物,HcSCL13PGU1:5'-GATTACGCCAAGCTTGGGAACA TGACATGGATTACGA-3'(下划线标记为 Hind III酶切位点),HcSCL13PGU2:5'-CCGGGGATCCTCTAG ACCGAGAATAGCACAATCTGACTCTAT-3'(下划线标记为 Xba I 酶切位点)。
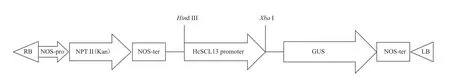
图1 构建HcSCL13基因启动子偶联GUS报告基因的植物表达载体示意图
以测序正确含有盐穗木HcSCL13启动子的克隆载体为模板,HcSCL13PGU1和HcSCL13PGU2为特异引物进行扩增,使用限制性内切酶 Hind III和 Xba I对植物表达载体pBI121进行双酶切,胶回收后,使用 In-Fusion HD Cloning Kit试剂盒对回收带有酶切位点的启动子PCR产物和酶切的载体进行连接。连接产物转化大肠杆菌DH5α,采用酶切鉴定和测序方法确定HcSCL13启动子是否已置换35S启动子,将成功构建的重组载体命名为PHcSCL13∶GUS。
1.2.3 PHcSCL13∶GUS对拟南芥的遗传转化及抗性苗筛选 将构建正确的植物表达载体pBI121-PHcSCL13∶GUS采用冻融法转化农杆菌菌株GV3101,并挑取菌落进行PCR 鉴定,阳性克隆用于拟南芥的转化。采用农杆菌花序浸染法转化野生型拟南芥,温室培养收种。利用50 μg/mL卡那霉素筛选T0代转PHcSCL13∶GUS阳性苗,单株收种。提取卡那霉素抗性拟南芥基因组DNA,进行基因组PCR鉴定。
1.2.4 GUS活性组织染色分析 参照Jefferson等[24]方法测定T1代转基因拟南芥GUS报告基因的表达情况。将待染色的外植体浸泡在GUS染色液(50 mmol/L磷酸钠缓冲液、0.1% Triton X-100、1 mmol/L K3[Fe(CN)6]、1 mmol/L K4[Fe(CN)6]、1 mmol/L X-Gluc)中,置于37℃中保温过夜,用75%乙醇冲洗脱色,直至底色完全消失,在体视镜下拍照观察结果。
2 结果
2.1 HcSCL13基因启动子克隆
利用染色体步移技术的原理,通过简并引物AP3与设计的3条特异性引物进行3轮巢式PCR反应,得到一条长约2 kb的启动子片段(图2),回收该片段并连接至pMD18-T克隆载体上,通过序列测定和比对,该序列长2 200 bp,且其3'端与HcSCL13基因序列的一致性达到了98%,说明扩增得到的侧翼序列是HcSCL13基因上游的启动子序列。

图2 HcSCL13基因启动子的克隆
2.2 盐穗木HcSCL13基因启动子生物信息学分析
利用PlantCARE在线生物信息学软件对所获得的2 200 bp HcSCL13基因启动子序列进行相关预测分析。结果显示克隆获得的HcSCL13基因启动子区域不仅包含启动子区的核心元件CAAT-box和TATA-box,多个光响应元件 GAG-motif、GA-motif、Box I和chs-CMA2a。还含有多个与逆境应答有关的顺式调控元件(图3),如MBS、LTR、ERE、Box I、TCA-motif和TC-rich repeats等顺式作用元件(表1)。
2.3 植物表达载体的构建
使用Hind III和Xba I限制性内切酶对重组质粒pBI121-PHcSCL13进行双酶切,得到与目的片段长度一致的单一条带,表明HcSCL13启动子已经插入到pBI121载体中,构建成功(图4)。
2.4 转基因拟南芥抗性苗鉴定
通过花序浸染法将偶联有GUS报告基因的HcSCL13启动子转入拟南芥,经卡那霉素抗性筛选获得20株抗性植株。以HcSCL13PGU1和HcSCL13PGU2为特异性引物对抗性植株进行PCR检测,部分结果如图5所示,所检测植株的扩增结果与预期一致,表明抗性植株均含有HcSCL13启动子片段。
2.5 转基因拟南芥的GUS的染色分析
以T1代PHcSCL13∶GUS转基因拟南芥为实验材料,将萌发生长7 d和15 d的幼苗进行GUS组织化学染色。结果显示(图6),在不同生长发育阶段转PHcSCL13∶GUS基因T1代拟南芥幼苗的叶片和根部均检测到GUS活性的蓝色信号,而在非转基因拟南芥的各个部位均未检测到GUS活性,各组织未见染色,呈白色。
3 讨论
GRAS作为植物特异性转录因子,广泛存在于多种植物中。尽管目前已对该家族部分基因的功能开展了相关研究,但有关其调控机理的报道还很少。本研究利用基因组步移技术克隆获得了盐穗木GRAS家族转录因子HcSCL13基因2 200 bp的启动子序列,与同源基因拟南芥AtSCL13启动子长度近似(2 800 bp)。通过生物信息学对该启动子进行分析预测,含有如下顺式作用元件:O2-site、GAG-motif、GA-motif、LTR、MBS、ARE、Box I、chs-CMA2a、TC-rich repeats、TCA-element、ERE、TATA-box和TCT-motif。其中,GAG-motif、GA-motif、Box I和chs-CMA2a、TCT-motif[25-27]为多个对光响应的元件,是常见的受光调节启动子中的顺式作用元件,能够调节基因受光诱导后的转录活性。与已报道的拟南芥AtSCL13基因启动[28]子相似,推测其为受光诱导的启动子,也可能参与了对植物光敏色素的信号转导。
此外,HcSCL13作为积极响应盐胁迫的转录因子基因,在该启动子上还发现了与胁迫相关的一些顺式作用元件,这些元件的非生物逆境应答特性在以往的研究中已有较多的报道。LTR是与低温胁迫相关的启动子调控序列[29]。MBS元件与干旱等多种非生物逆境胁迫相关,能够作为反式作用因子MYB蛋白的结合位点[30,31]。ARE与厌氧应答相关[32]。TC-rich repeats是植物应对逆境胁迫时响应的元件,参与多种生物与非生物胁迫应答[33]。TCA-element参与水杨酸反应,该顺式作用元件能在不同非生物胁迫下通过调控防御基因的表达,提高植物对胁迫的耐受性[34,35]。GCC box作为乙烯响应元件ERE的保守序列,能够调节植物对乙烯的响应[36]。推测这些顺式作用元件可能调节了HcSCL13 基因在盐等逆境下的表达,进而再通过 HcSCL13 所介导的信号路径调节下游相关胁迫基因的表达以应对各种非生物胁迫,从而表现出复杂的调控方式。

图3 HcSCL13基因启动子顺式作用元件分析
通过对PHcSCL13∶GUS转基因拟南芥7 d和15 d两个不同生长发育阶段的组织化学染色证明了HcSCL13启动子在非胁迫条件下能够持续有效地启动下游GUS报告基因的表达,但是该启动子具有多个光响应原件,在缺乏光照条件下能否启动GUS基因的表达还有待于进一步验证。同时,盐等非生物胁迫是否会影响GUS活性也有待于深入研究。
4 结论
本研究获得了盐穗木转录因子HcSCL13基因的启动子,通过PantCARE在线软件分析该启动子序列的顺式作用元件,发现了一些与光响应、非生物胁迫(干旱、低温)、激素(水杨酸、乙烯)、及逆境响应的顺式作用元件。GUS组织化学染色结果表明该启动子具有活性。

表1 HcSCL13转录因子基因启动子核心作用元件

图4 植物表达载体pBI121-PHcSCL13的酶切鉴定

图5 转基因植株PCR鉴定

图6 转pBI121-HcSCL13:GUS拟南芥幼苗的GUS组织化学染色
[1]Tang W, Chen H, Xu C, et al. Development of insect-resistant transgenic indica rice with a synthetic cry1C* gene[J]. Molecular Breeding, 2006, 18(1):1-10.
[2]Zhang ZL, Xie Z, Zou X, et al. A rice WRKY gene encodes a transcriptional repressor of the gibberellin signaling pathway in aleurone cells[J]. Plant Physiology, 2004, 134(4):1500-1513.
[3]Duan H, Schuler MA. Differential expression and evolution of the Arabidopsis CYP86A subfamily[J]. Plant Physiology, 2005, 137(3):1067-1081.
[4]Dubouzet JG, Sakuma Y, Ito Y, et al. OsDREB genes in rice, Oryza sativa L. , encode transcription activators that function in drought-, high-salt and cold-responsive gene expression[J]. The Plant Journal, 2003, 33(4):751-763.
[5]Korobczak A, Aksamit A, kaszewicz M, et al. The potato glucosyltransferase gene promoter is environmentally regulated[J]. Plant Science, 2005, 168(2):339-348.
[6]Cheng X, Sardana R, Kaplan H, et al. Agrobacterium-transformed rice plants expressing synthetic cryIA(b)and cryIA(c)genes are highly toxic to striped stem borer and yellow stem borer[J]. Proceedings of the National Academy of Sciences, 1998, 95(6):2767-2772.
[7]Alam MF, Datta K, Abrigo E, et al. Transgenic insect-resistant maintainer line(IR68899B)for improvement of hybrid rice[J]. Plant Cell Reports, 1999, 18(18):572-575.
[8]Tu J, Zhang G, Datta K, et al. Field performance of transgenic elite commercial hybrid rice expressing Bacillus thuringiensisendotoxin[J]. Nature Biotechnology, 2000, 18(10):1101-1104.
[9]Chen H, Tang W, Xu C, et al. Transgenic indica rice plants harboring a synthetic cry2A* gene of Bacillus thuringiensis exhibit enhanced resistance against lepidopteran rice pests[J]. Theoretical and applied genetics, 2005, 111(7):1330-1337.
[10]Bolle C. The role of GRAS proteins in plant signal transduction and development[J]. Planta, 2004, 218(5):683-692.
[11] Hirsch S, Kim J, Muñoz A, et al. GRAS proteins form a DNA binding complex to induce gene expression during nodulation signaling in Medicago truncatula[J]. The Plant Cell, 2009, 21(2):545-557.
[12] Torres-Galea P, Hirtreiter B, Bolle C. Two GRAS proteins, SCARECROW-LIKE21 and PHYTOCHROME A SIGNAL TRANSDUCTION1, function cooperatively in phytochrome A signal transduction[J]. Plant Physiology, 2013, 161(1):291-304.
[13]石瑞, 曹诣斌, 陈文荣, 等. 佛手GRAS基因的克隆及表达分析[J]. 浙江师范大学学报:自然科学版, 2011, 34(4):446-451.
[14]Xu K, Chen S, Li T, et al. OsGRAS23, a rice GRAS transcription factor gene, is involved in drought stress response through regulating expression of stress-responsive genes[J]. BMC plant biology, 2014, 15(1):1-13.
[15]杨明贵. 甘蓝型油菜 GRAS 家族基因 BnLAS 的分离和功能分析[D]. 武汉:华中农业大学, 2010.
[16]Ma HS. The salt- and drought-inducible poplar GRAS protein SCL7 confers salt and drought tolerance in Arabidopsis thaliana[J]. Journal of Experimental Botany, 2010, 61(14):4011-4019.
[17]Yuan Y, Fang L, Karungo SK, et al. Overexpression of VaPAT1, a GRAS transcription factor from Vitis amurensis, confers abiotic stress tolerance in Arabidopsis[J]. Plant Cell Reports, 2015, 35(3):1-12.
[18]李雪燕, 金胶胶, 赵玉琳, 等. 柽柳GRAS转录因子基因启动子克隆和表达分析[J]. 中国农学通报, 2016, 2016(2):28-32.
[19]关波, 胡有贞, 张富春, 等. 盐穗木甜菜碱醛脱氢酶基因(BADH)的克隆及其在盐胁迫下的表达分析[J]. 植物生理学通讯, 2010, 46(1):47-50.
[20]郭华军, 焦远年, 邸超, 等. 拟南芥转录因子GRAS家族基因群响应渗透和干旱胁迫的初步探索[J]. 植物学报, 2009, 44(3):290-299.
[21]郭华军. 拟南芥转录因子GRAS家族SCL15基因对干旱胁迫的响应分析[D]. 杨凌:西北农林科技大学, 2009.
[22]彭丹, 张霞, 张富春. 盐穗木过氧化氢酶基因的克隆与功能分析[J]. 西北植物学报, 2014, 33(10):1933-1939.
[23]周莲洁, 杨中敏, 张富春, 等. 新疆盐穗木GRAS转录因子基因克隆及表达分析[J]. 西北植物学报, 2013, 33(6):1091-1097.
[24]Jefferson RA, Kavanagh TA, Bevan MW. GUS fusions:betaglucuronidase as a sensitive and versatile gene fusion marker in higher plants[J]. Embo Journal, 1987, 6(13):3901-3907.
[25]王亚男, 刘晓楠, 戚伟, 等. 青香蕉苹果α-法尼烯合酶基因启动子的克隆及序列分析[J]. 科技视界, 2016, 2016(13):101-102.
[26]Song J, Wang Z. Molecular cloning, expression and characterization of a phenylalanine ammonia-lyase gene(SmPAL1)from Salvia miltiorrhiza[J]. Molecular Biology Reports, 2009, 36(5):939-952.
[27]Imura Y, Seki H, Toyoda K, et al. Contrary operations of Box-I element of pea phenylalanine ammonia-lyase gene 1 promoter for organ-specific expression[J]. Plant Physiology & Biochemistry, 2001, 39(5):355-362.
[28]Cai G, Cao K. PAT1, a new member of the GRAS family, is involved in phytochrome A signal transduction[J]. Genes & Development, 2000, 14(10):1269-1278.
[29]Dunn MA, Goddard NJ, Zhang L, et al. Low-temperature-responsive barley genes have different control mechanisms[J]. Plant Molecular Biology, 1994, 24(6):879-888.
[30]Sugimoto K, Takeda S, Hirochika H. MYB-related transcription factor NtMYB2 induced by wounding and elicitors is a regulator of the tobacco retrotransposon Tto1 and defense-related genes[J]. Plant Cell, 2000, 12(12):2511-2528.
[31]Li PC, Yu SW, Shen J, et al. The transcriptional response of apple alcohol acyltransferase(MdAAT2)to salicylic acid and ethylene is mediated through two apple MYB TFs in transgenic tobacco[J]. Plant Molecular Biology, 2014, 85(6):627-638.
[32]Gallo-Ebert C, Donigan M, Liu HY, et al. The yeavast anaerobic response element AR1b regulates aerobic antifungal drugdependent sterol gene expression[J]. Journal of Biological Chemistry, 2013, 288(49):35466-35477.
[33]Winkler WC, Grundy FJ, Murphy BA, et al. The GA motif:an RNA element common to bacterial antitermination systems, rRNA, and eukaryotic RNAs[J]. RNA, 2001, 7(8):1165-1172.
[34]Goldsbrough AP, Albrecht H, Stratford R. Salicylic acid-inducible binding of a tobacco nuclear protein to a 10 bp sequence which is highly conserved amongst stress-inducible genes[J]. Plant Journal for Cell & Molecular Biology, 1993, 3(4):563-571.
[35]Mou S, Liu Z, Guan D, et al. Functional analysis and expressional characterization of rice ankyrin repeat-containing protein, Os PIANK1, in basal defense against Magnaporthe oryzae attack[J]. PLoS One, 2013, 8(3):2764-2767.
[36]Ohme-Takagi M, Shinshi H. Ethylene-inducible DNA binding proteins that interact with an ethylene-responsive element[J]. Plant Cell, 1995, 7(2):173-182.
(责任编辑 马鑫)
Cloning and Activity Analysis of Promoter of GRAS Transcription Factor Gene HcSCL13 from Halostachys caspica
FAN Shou-de WANG Yan
(Xinjiang Key Laboratory of Biological Resources and Genetic Engineering,College of Life Science and Technology,Xinjiang University,Urumqi 830046)
In order to explore the expression characteristic and function of GRAS transcription factor gene HcSCL13 from Halostachys caspica,the 2 200 bp sequence of promoter was cloned using the genomic walking method. The analysis results using the PlantCARE software suggested that the promoter sequence contained not only the core elements such as CAAT-box and TATA-box,but also some cis-element related to the stress response. The 35S promoter sequence of the pBI121 expression vector was replaced by the HcSCL13 promoter sequence to construct the fusion expression vector. Then,the fusion expression vector was transformed into Arabidopsis thaliana by flora method and the T1 seedlings were stained by GUS. The results of GUS staining showed that the whole transformed A. thaliana seedlings were stained,indicating that the HcSCL13 gene promoter had expression activity,and it might be constitutive promoter.
transcription factor gene HcSCL13;genomic walking method;promoter cloning;analysis of cis-acting element and promoter activity
10.13560/j.cnki.biotech.bull.1985.2017.05.019
2016-09-26
国家青年自然科学基金项目(31400729)
樊寿德,硕士研究生,研究方向:植物抗逆的生理生化与分子机制;E-mail:fanshoude123@163.com
王艳,博士,副教授,研究方向:植物抗逆的生理生化与分子机制;E-mail:wangyanxju@126.com

