鰤鱼诺卡氏菌DmpA基因的克隆及亚细胞定位研究
夏立群陈锐敏廖保山徐亮苏泽杰童邦卓
(1. 广东海洋大学水产学院,湛江 524088;2. 广东省水产经济动物病原生物学及流行病学重点实验室,湛江 524088;3. 广东省教育厅水产经济动物病害控制重点实验室,湛江 524088)
鰤鱼诺卡氏菌DmpA基因的克隆及亚细胞定位研究
夏立群1,2,3陈锐敏1廖保山1徐亮1苏泽杰1童邦卓1
(1. 广东海洋大学水产学院,湛江 524088;2. 广东省水产经济动物病原生物学及流行病学重点实验室,湛江 524088;3. 广东省教育厅水产经济动物病害控制重点实验室,湛江 524088)
鰤鱼诺卡氏菌(Nocardia seriolae)是鱼类诺卡氏菌病的主要病原,为兼性胞内菌。生物信息学分析显示鰤鱼诺卡氏菌DmpA基因的表达产物为分泌蛋白,且可能定位于宿主细胞的线粒体上。通过构建重组质粒pEGFP-DmpA和pcDNA-DmpA、鰤鱼诺卡氏菌胞外产物鉴定、亚细胞定位、过表达等方法,对鰤鱼诺卡氏菌DmpA基因进行了克隆、亚细胞定位及初步功能研究。结果表明在鰤鱼诺卡氏菌胞外产物中鉴定到了DmpA蛋白,证实其为分泌蛋白。亚细胞定位研究发现DmpA-GFP融合蛋白均匀地分布在FHM细胞中,与线粒体分布不重合,说明DmpA蛋白并不定位在线粒体上。DmpA-GFP融合蛋白的表达会改变FHM细胞线粒体的分布为团块状。DmpA在细胞中的过量表达对细胞核无明显影响,表明该基因无诱导细胞凋亡的功能。通过对鰤鱼诺卡氏菌DmpA的克隆、亚细胞定位和过表达研究,为进一步研究该基因的功能和深入了解鰤鱼诺卡氏菌的致病机理奠定了基础。
鰤鱼诺卡氏菌;DmpA基因;分泌蛋白;亚细胞定位
鰤鱼诺卡氏菌(Nocardia seriolae)是鱼类诺卡氏菌病的主要致病菌,当鱼类免疫力低下时,可通过饵料、鳃或伤口感染,并引发鱼体发生慢性系统性肉芽肿疾病[1]。鰤鱼诺卡氏菌可感染乌鳢(Channa maculata)、卵形鲳鲹(Trachinotus ovatus)、大黄鱼(Larimichthys crocea)等20多种海、淡水鱼类,导致鱼类慢性死亡,或由于引发体表溃疡而降低成鱼商品价值,加之发病率逐年增加,对鱼类养殖业危害也越来越严重[2-4]。
鰤鱼诺卡氏菌在分类学上属放线菌目、诺卡氏菌科、诺卡氏菌属,为革兰氏阳性菌[5]。鰤鱼诺卡氏菌是一种兼性胞内寄生菌,在其感染过程中,菌体会被鱼体吞噬细胞,主要是巨噬细胞吞噬。鰤鱼诺卡氏菌能在巨噬细胞内存活,并可随着巨噬细胞的迁移而扩散感染到鱼体的各个器官[6]。病原菌逃避巨噬细胞杀灭的机制一直是相关疾病学研究的关注热点,研究发现各种病原菌的胞内生存机制各有特色、不尽相同。有研究表明胞内寄生菌可通过调控吞噬细胞的线粒体、细胞骨架、溶酶体、诱导或抑制巨噬细胞的凋亡或坏死等途径,进而影响其清除病原菌的能力[7]。目前,鰤鱼诺卡氏菌致病过程中,逃避巨噬细胞杀灭的途径及其与鱼体细胞的相互作用机制尚不明确。
病原放线菌致病性相关的蛋白质组学研究揭示,病原放线菌的分泌蛋白与其致病性紧密相关,特别是一些具有生物降解活性的蛋白酶和酯酶类分泌蛋白,可能是病原放线菌的重要致病因子[8]。鰤鱼诺卡氏菌ZJ0503株全基因组序列分析发现一个DmpA基因,可能编码一种分泌蛋白,功能预测显示该基因兼具L-氨肽酶(L-aminopeptidase)和D-酯酶(D-esterase)的功能。本研究对鰤鱼诺卡氏菌DmpA基因进行克隆,并通过胞外产物鉴定、亚细胞定位、过表达等方法开展研究,以期对鰤鱼诺卡氏菌DmpA的功能进行初步研究,为深入了解鰤鱼诺卡氏菌的分子致病机理奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株、细胞和质粒 鰤鱼诺卡氏菌(N. seridea)ZJ0503菌株从海水网箱养殖的患病卵形鲳鲹(T. ovatus)中分离到并由本实验室保存;胖头鲤细胞(FHM)、质粒pEGFP-N1、质粒pcDNA 3.1-His A、大肠杆菌受体菌DH5α由本实验室保存提供。
1.1.2 工具酶和试剂 KOD -Plus-Neo高保真聚合酶购自Toyobo公司;限制性核酸内切酶Bgl II,Sal I,Kpn I,Xho I,T4 连接酶,DNA 片段纯化试剂盒均购于TaKaRa公司;细菌基因组DNA 提取试剂盒购自Tiangen公司;E.Z.N.ATM去内毒素质粒提取试剂盒(Endo-Free plasmid mini kit)购自Omega公司;L-15细胞培养液,胰酶购自Gibco公司;转染试剂Lipofectamine 2000、Opti-MEM,线粒体红色荧光探针MitoTracker Red CMXRos购自Invitrogen 公司;细胞核染色剂DAPI购自Sigma公司;透析袋(截留分子量3500)、玻璃纸购自上海源叶生物科技有限公司;线粒体膜电位检测试剂盒(JC-1)购自碧云天生物技术公司;其它试剂均为国产分析纯。
1.2 方法
1.2.1 鰤鱼诺卡氏菌DmpA基因的克隆与DmpA融合表达载体的构建 鰤鱼诺卡氏菌ZJ0503总DNA的提取按照细菌基因组DNA提取试剂盒(Tiangen)说明书进行。根据鰤鱼诺卡氏菌ZJ0503全基因组[9](accession number:JNCT01000000)DmpA基因(ORF 2563,nucleotide position:28849-29919)的序列和质粒pEGFP-N1、pcDNA 3.1-His A的MCS酶切位点设计引物。引物设计采用的软件为Primer premier 5.0,引物由生工生物工程(上海)股份有限公司合成,其核苷酸序列见表1。

表1 本研究中所使用的引物
以鰤鱼诺卡氏菌ZJ0503总DNA为模板进行PCR扩增,参照KOD-Plus-Neo高保真聚合酶说明书设置PCR扩增体系:10× PCR Buffer for KODPlus-Neo 5 μL,dNTP(2 mmol/L)5 μL,MgSO4(25 mmol/L)3 μL,引物pEGFP-F(10 μmol/L)和pEGFP-R(10 μmol/L)各2 μL,模板DNA 1 μL,KOD -Plus-Neo高保真聚合酶(1 U/μL)1 μL,加ddH2O 补足至50 μL。PCR的扩增条件为:98℃预变性2 min;98℃ 10 s,55℃ 15 s,68℃ 1 min,共30个循环;68℃ 延伸5 min。将PCR产物通过1%琼脂凝胶电泳检测。PCR 产物经DNA 片段纯化试剂盒纯化后,与质粒pEGFP-N1进行双酶切后16℃连接。连接产物转化入大肠杆菌DH5α。经菌落PCR鉴定后,阳性克隆送生工生物工程(上海)股份有限公司测序。构建成功的融合表达载体命名为pEGFPDmpA。
1.2.2 鰤鱼诺卡氏菌DmpA基因的生物信息学分析 根据鰤鱼诺卡氏菌DmpA基因测序结果,使用DNAMAN进行脱氧核糖核苷酸的翻译;用clustalX和GeneDoc软件进行氨基酸多重序列比对分析;利用NCBI BLAST(http://www.ncbi.nlm.nih.gov/BLAST/)对DmpA的蛋白序列进行序列同源性比对和相似性分析;运用MEGA6进行生物进化树的构建;采用 LocTree 3(http://cubic.bioc.columbia.edu/cgi/var/ nair/loctree/query)进行蛋白亚细胞定位的预测;用SignalP 4.1(http://www.cbs.dtu.dk/services/SignalP/)进行信号肽的预测;通过Intropro(http://www.ebi. ac.uk/interpro/)对蛋白家族成员进行分析和功能预测。
1.2.3 鰤鱼诺卡氏菌胞外产物的制备与鉴定 将鰤鱼诺卡氏菌在改良培养基[10]平板上培养3-5 d后,挑取单菌落制备成菌悬液。将灭菌后的玻璃纸平铺在改良培养基平板上,并使其紧贴培养基。取100 μL菌悬液均匀涂布于铺有玻璃纸的培养基上,于28℃恒温培养箱培养3-5 d。用镊子将生长有菌落的玻璃纸从培养基上剥离,用无菌PBS将玻璃纸上的菌落冲洗入无菌烧杯中。将收集的菌液转入50 mL离心管中,8000×g,4℃,离心20 min。离心后的上清液,经0.22 μm 微孔滤膜除菌后,转移至透析袋中,超纯水中4℃透析10-16 h,期间换透析液3次。透析后的样品转入50 mL离心管,于-80℃将液体冷冻成固体后,放入真空冷冻干燥机中冻干。冻干后的胞外产物样品送深圳微菲生物科技有限公司进行蛋白质shotgun LC-MS质谱鉴定。
苏秋琴将癞阿小从柳红身上移开,见他无声无息的,她就用脚踢踢他,也没有动静,苏秋琴不免惊慌起来,这家伙不会被我砸死了吧?她叫柳红,柳红却傻呆呆地坐在地上,两眼朝着她放火。这鬼天气,热得人都发疯了。苏秋琴攀住柳红的双肩拼命地摇,柳红嗖地站起身来,捡了一块西瓜,狠狠地拍到癞阿小的脸上。
1.2.4 鰤鱼诺卡氏菌DmpA的亚细胞定位 按E.Z.N.ATM去内毒素质粒提取试剂盒说明书提取无内毒素质粒pEGFP-DmpA和pEGFP-N1质粒。FHM细胞用含10%小牛血清的L-15培养液培养,将FHM细胞传代至24 孔细胞培养板中,于25℃恒温培养箱中培养,当细胞覆盖率约为70%时进行转染。转染方法参照Lipofectamin 2000说明书进行,每孔转染需1 μg 质粒和2 μL 转染试剂(lipofectamin 2000)。转染48 h后,参照MitoTracker Red CMXRos说明书进行线粒体红色荧光探针染色和细胞核染色,具体步骤如下:吸出细胞培养液后,每孔加入125 μL预热至28℃的MitoTracker Red CMXRos工作液(300 nmol/L,使用无血清细胞培养液稀释),于28℃避光孵育45 min。染色结束后用PBS漂洗2-3次,用预热至室温的3.7%多聚甲醛固定30 min,用PBS漂洗2-3次。用预冷至-20℃的冰乙醇透化细胞7 min,用PBS漂洗2-3次。每孔加入200 μL DAPI(1 μg/mL)避光染细胞核10 min,PBS 漂洗3 次后,在荧光显微镜(Leica)下观察拍照。
1.2.5 鰤鱼诺卡氏菌DmpA基因真核表达对细胞核的影响 构建鰤鱼诺卡氏菌DmpA基因的真核表达载体pcDNA-DmpA:使用的引物为pcDNA-F和pcDNA-R(表1),PCR扩增体系和PCR扩增条件与步骤1.2.1相同,PCR产物与质粒pcDNA 3.1-His A酶切连接后,阳性克隆送测序。构建成功的真核过表达重组质粒命名为pcDNA-DmpA。将质粒pcDNADmpA和pcDNA 3.1-His A分别转染培养于24孔板的FHM细胞,转染方法参见步骤1.2.4。在转染后48 h,将细胞固定、透化后经DAPI(1 μg/mL)避光染核10 min,于在荧光显微镜(Leica)下观察转染后FHM细胞核的变化情况。以饥饿诱导凋亡的FHM细胞为阳性对照。
2 结果
2.1 鰤鱼诺卡氏菌DmpA基因的克隆与DmpA-GFP融合表达载体的构建
鰤鱼诺卡氏菌DmpA基因的高保真PCR扩增产物,用1%的琼脂糖凝胶作电泳分析,获得长度大小为1 000 bp左右的目的条带(图1),与理论长度1 071 bp相符合。测序结果证明重组质粒pEGFPDmpA的插入片段序列与鰤鱼诺卡氏菌ZJ0503全基因组测序的DmpA基因(ORF 2563)序列完全一致,表明重组质粒pEGFP-DmpA构建成功。
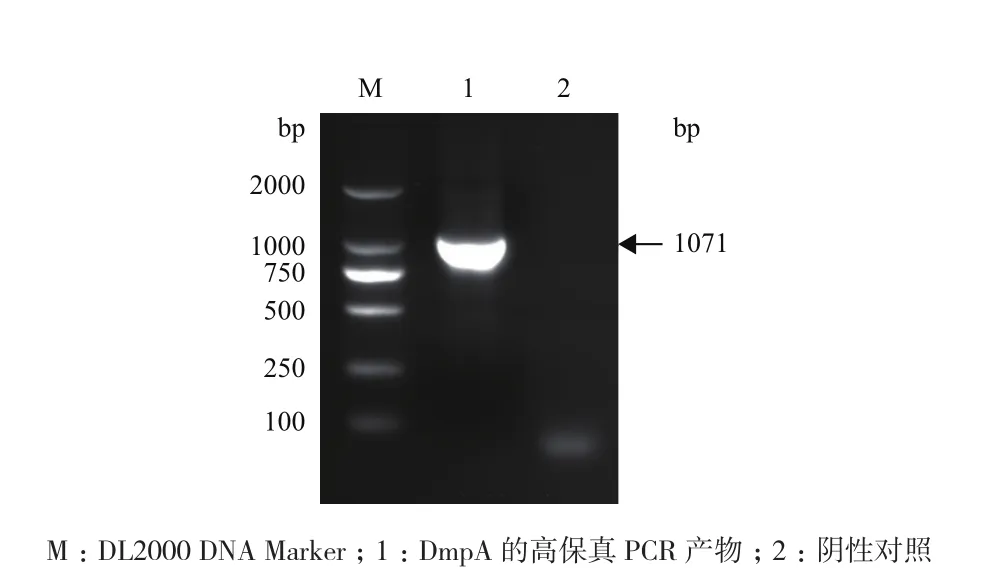
图1 鰤鱼诺卡氏菌DmpA基因PCR 扩增电泳结果
2.2 鰤鱼诺卡氏菌DmpA基因的生物信息学分析
鰤鱼诺卡氏菌DmpA基因(ORF 2563)是长1 071 bp 的开放阅读框,编码356个氨基酸(图2),预测的分子量为35.3 kD,理论的等电点值为4.62。
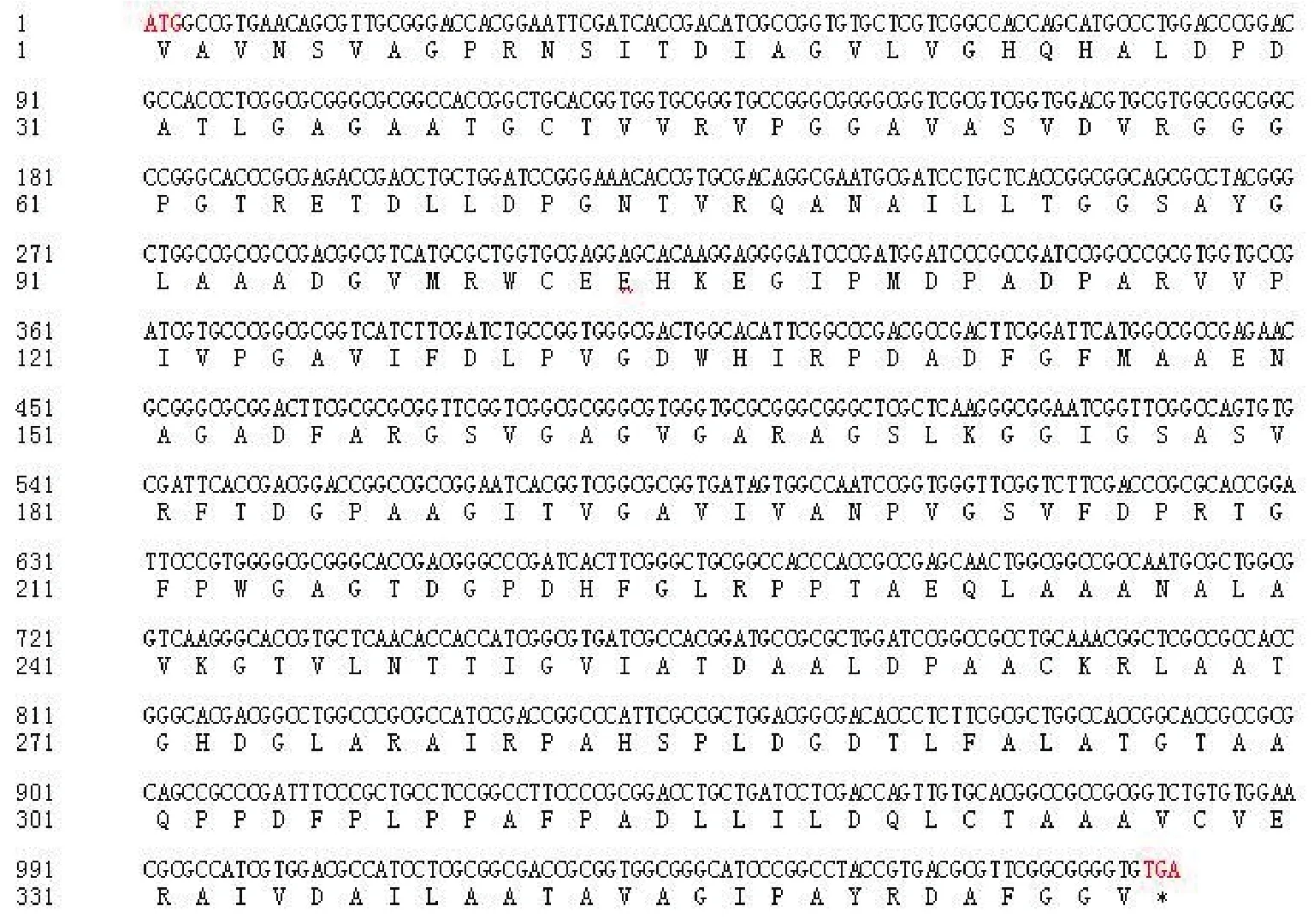
图2 鰤鱼诺卡氏菌DmpA基因的核苷酸序列及其推定的氨基酸序列(*表示终止子)
LocTree预测鰤鱼诺卡氏菌DmpA基因编码的蛋白,在原核生物中为分泌蛋白,而在真核生物细胞中定位于线粒体。推测鰤鱼诺卡氏菌DmpA基因的表达产物可能会是该病原菌的分泌蛋白;作为一种兼性胞内菌,鰤鱼诺卡氏菌的该分泌蛋白在宿主细胞内可能会定位于线粒体。经SignalP分析表明,鰤鱼诺卡氏菌DmpA基因编码的蛋白没有信号肽,推测其分泌到细菌胞外的过程中没有经过信号肽剪切。
通过NCBI对鰤鱼诺卡氏菌DmpA基因的推定氨基酸序列进行Protein BLAST分析,发现另外两种鱼类致病诺卡氏菌,杀鲑诺卡氏菌(N. salmonicida)和星状诺卡氏菌(N. asteroids),也存在DmpA同源类似物。BLAST结果显示鰤鱼诺卡氏菌DmpA与其他诺卡氏菌属物种同源类似物的同源性为81%-93%,与红球菌属(Rhodococcus)物种DmpA的同源性为68%-71%。利用DNAMAN对选取的8个放线菌目物种同源类似物进行多重列对比,结果(图3)显示鰤鱼诺卡氏菌DmpA与这些物种相似性为75%以上的氨基酸高达67.1%,说明DmpA在放线菌目是较为保守的蛋白。DmpA氨基酸序列系统进化树显示诺卡氏菌属细菌先聚为一枝,之后与红球菌属细菌聚为一枝,最后和分枝杆菌属(Mycobacterium)细菌相聚(图4)。

图3 不同物种DmpA氨基酸序列多重比对分析
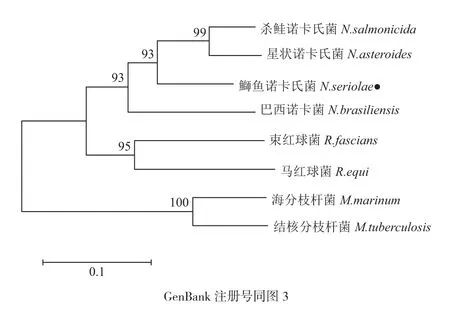
图4 基于DmpA同源类似物氨基酸序列绘制的系统发生树
鰤鱼诺卡氏菌DmpA功能预测结果显示其兼具L-氨肽酶(L-aminopeptidase)和D-酯酶(D-esterase)的功能,属于S58肽酶家族,是能从蛋白质和多肽N端选择性切除氨基酸残基的外切蛋白酶。DmpA是一个由375个氨基酸残基组成的N末端氨肽酶,具有α亚基(位于2-249号残基间)和β亚基(位于250-375残基之间)。DmpA通过前体的N端蛋氨酸的脱除和Gly-249-Ser-250间肽键的断裂达到激活效果,其兼具L型水解酶和D-丙氨酸-酯酶/酰胺酶的功能[11,12]。为了实现DmpA水解酶的活性,底物的α氨基要处于自由状态,若N末端残基是L型结构则水解效果更佳。鰤鱼诺卡氏菌DmpA还具有nylC-like结构域,nylC基因可编码尼龙低聚物分解酶(Nylon oligomers degrading enzyme)。
2.3 鰤鱼诺卡氏菌DmpA为分泌蛋白的鉴定
通过制备鰤鱼诺卡氏菌胞外产物并进行Shotgun质谱鉴定,结果显示多次鉴定到了属于鰤鱼诺卡氏菌DmpA 的一个肽段“VPGGAVASVDVR”,证明鰤鱼诺卡氏菌DmpA基因编码的蛋白出现在鰤鱼诺卡氏菌的胞外产物中,是分泌蛋白。
2.4 鰤鱼诺卡氏菌DmpA的亚细胞定位
将鰤鱼诺卡氏菌DmpA基因连接到真核表达质粒pEGFP-N1中,成功构建了真核表达重组质粒pEGFP-DmpA。该质粒转染到真核细胞后,能在自身携带的SV40早期启动子的作用下表达一个羧基末端带有增强型绿色荧光蛋白标签(Green fluorescent protein,GFP)的DmpA-GFP融合蛋白,从而通过绿色荧光蛋白的细胞内定位来研究DmpA的亚细胞定位。
实验以空载体pEGFP-N1为对照。将pEGFPDmpA和pEGFP-N1转染FHM细胞,转染后48 h,用MitoTracker Red CMXRos和DAPI染色,并于荧光显微镜下观察。结果(图5)显示,pEGFP-N1转染的FHM细胞,其绿色荧光呈全细胞分布,线粒体围绕细胞核呈环状分布,细胞核边缘较光滑,染色均匀,无细胞凋亡特征(图5右);pEGFP-DmpA转染FHM细胞后绿色荧光在细胞核和细胞质中都存在,呈全细胞分布,与线粒体分布不重合,说明DmpAGFP融合蛋白并不定位于线粒体上。有DmpA-GFP融合蛋白绿色荧光的细胞,其细胞核常出现边缘褶皱,推测DmpA在FHM细胞中的表达可能会导致细胞凋亡;DmpA-GFP融合蛋白的表达会改变FHM细胞线粒体的分布:在大多数阳性转染pEGFPDmpA的细胞中,线粒体的分布模式被改变,不再是pEGFP-N1空质粒转染后的围绕细胞核的环状分布模式,而是线粒体分布呈团块状(图5左)。
2.5 鰤鱼诺卡氏菌DmpA过表达对细胞核的影响
真核表达重组质粒pcDNA-DmpA转染到FHM细胞中,可持续高水平表达鰤鱼诺卡氏菌DmpA。将pcDNA-DmpA 和pcDNA3.1 his A转染FHM细胞后48 h,经DAPI染色,观察细胞核的状态。结果显示,与对照组pcDNA3.1 his A(图6-A)相比,转染pcDNA-DmpA的FHM细胞,核并未出现固缩浓染、核裂解、凋亡小体等明显的细胞凋亡特征(图6-C),表明DmpA在FHM细胞的过表达并不会引起细胞凋亡。阳性对照FHM细胞中,饥饿诱导了明显的凋亡,其细胞核出现了核裂解和凋亡小体等凋亡特征(图6-B)。

图5 带GFP标签的鰤鱼诺卡氏菌DmpA融合蛋白在FHM细胞内的定位
3 讨论
本研究成功克隆了鰤鱼诺卡氏菌DmpA基因,并鉴定其所编码的蛋白存在于鰤鱼诺卡氏菌的胞外产物中,为一种分泌蛋白。对鰤鱼诺卡氏菌DmpA进行功能预测,结果显示DmpA属于S58肽酶家族,兼具L-氨肽酶和D-酯酶的功能[11,12]。氨肽酶是一类从蛋白质和多肽N端选择性切除氨基酸残基的外切蛋白酶[13]。而酯酶可调控酯类的代谢,研究表明结核分枝杆菌的致病性和耐受性与其较高的酯类物质含量密切相关[14]。病原放线菌分泌蛋白质组学研究显示,一些具有生物降解活性的蛋白酶和酯酶是重要的致病因子[15]。鰤鱼诺卡氏菌DmpA还与nylC具有相似的结构域。相关研究显示黄杆菌(Flavobacterium)nylC基因编码的产物EIII是尼龙低聚物分解酶(nylon oligomers degrading enzyme),可以水解尼龙低聚物并消化6-氨基已酰乙酸低聚物所形成的聚合物[16]。假结核棒杆菌(Corynebacterium pseudotuberculosis)的分泌蛋白质组中鉴定到了NlpC/P60蛋白质[17]。鰤鱼诺卡氏菌DmpA作为一种具有氨肽酶和酯酶活性的分泌蛋白,很可能是鰤鱼诺卡氏菌的致病因子,在鰤鱼诺卡氏菌的致病过程中具有一定的作用。
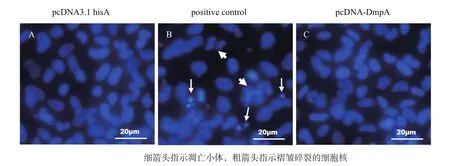
图6 转染pcDNA-DmpA后FHM细胞的细胞核观察
基因的亚细胞定位可以为其功能研究提供重要线索。LocTree预测鰤鱼诺卡氏菌的DmpA蛋白,在原核生物中为分泌蛋白,而在真核生物细胞中定位于线粒体。鰤鱼诺卡氏菌的胞外产物鉴定证实鰤鱼诺卡氏菌DmpA蛋白的确为一种分泌蛋白。通过构建带绿色荧光标签的真核表达质粒pEGFP-DmpA,对鰤鱼诺卡氏菌DmpA蛋白进行真核细胞的亚细胞定位研究,结果表明DmpA蛋白呈全细胞分布,与线粒体分布并不重合,因此其在真核细胞中并不是定位于线粒体的。同时,结果显示DmpA蛋白的表达常常伴随着细胞核褶皱、线粒体的分布呈团块状的变化,这有可能是由于DmpA蛋白影响到了宿主细胞的蛋白和酶代谢,因而改变了细胞核形态和线粒体的分布。研究显示病原菌可通过分泌蛋白或直接将毒力蛋白注入宿主细胞发挥致病作用。当病原菌毒力蛋白进入宿主细胞内,就会通过改变宿主细胞的细胞骨架、膜运输、信号转导等,以利于细菌在其中生存和增殖。
诺卡氏属病原菌在被与宿主巨噬细胞吞噬后,可以抵抗巨噬细胞杀灭并在其内存活,这一过程中诺卡氏菌的常用策略就是诱导巨噬细胞的凋亡[18,19]。目前诺卡氏菌诱导巨噬细胞凋亡的机制尚不十分明确,推测可能与其分泌蛋白等毒力因子相关。质粒pcDNA3.1 his A具有CMV启动子(Cytomegalovirus immediate-early promoter),转染到真核动物细胞后,能够对插入的基因进行持续的高水平表达。本研究将pcDNA-DmpA转染FHM后,观察细胞核的状态。结果显示,与对照组相比,鰤鱼诺卡氏菌DmpA蛋白在FHM细胞的过表达并未引起细胞核出现固缩浓染、核裂解、凋亡小体等明显的细胞凋亡特征,表明DmpA蛋白不能诱导宿主细胞的凋亡。
通过对鰤鱼诺卡氏菌DmpA的克隆、亚细胞定位和过表达研究,为进一步研究该基因的功能奠定了基础,也为深入了解鰤鱼诺卡氏菌早期感染鱼体的致病机理提供线索,为鱼类诺卡氏菌病的防治奠定理论基础。
4 结论
成功构建了鰤鱼诺卡氏菌DmpA的真核表达质粒pEGFP-DmpA和pcDNA-DmpA。鰤鱼诺卡氏菌胞外产物质谱鉴定表明DmpA蛋白为分泌蛋白。亚细胞定位研究发现DmpA-GFP融合蛋白均匀地分布在FHM细胞中,并未定位在线粒体上。DmpA-GFP融合蛋白的表达会改变FHM细胞线粒体的分布为团块状。过表达研究表明DmpA无诱导细胞凋亡的功能。
[1]袁思平, 王国良, 金珊. 养殖鱼类致病诺卡氏菌研究进展[J].微生物学通报, 2006, 33(2):137-141.
[2]黄郁葱, 简纪常, 吴灶和, 等. 卵形鲳鲹结节病病原的分离与鉴定[J]. 广东海洋大学学报, 2008, 28(4):49-53.
[3]Labrie L, Ng J, Tan Z, Komar C, Ho E, Grisez L. 2008. Nocardial infections in fish:an emerging problem in both freshwater and marine aquaculture systems in Asia[G]// Bondad-Reansato M, Mohan CV, Crumlish M, Subasinghe R. Diseases in Asian aquaculture VI. Fish Health Section. Philippines:Asian Fisheries Society, 2008:297-312.
[4]Elkesh A, Kantham KPL, Shinn AP, et al. Systemic nocardiosis in a Mediterranean population of cultured meagre, Argyrosomus regius, Asso(Perciformes:Sciaenidae)[J]. Journal of Fish Diseases, 2013, 36(2):141-149.
[5]张建丽, 刘志恒. 诺卡氏菌型放线菌的分类[J]. 微生物学报, 2001, 41(4):513-517.
[6]Beaman B L, Beaman L. Nocardia species:host-parasite relationships[J]. Clinical Microbiology Reviews, 1994, 7(2):213-264.
[7]罗云蔓, 郭晓奎, 姜叙诚. 病原菌逃避单核-巨噬细胞杀灭策略的研究进展[J]. 微生物与感染, 2010, 5(2):117-120.
[8]张瑶, 徐平, 李文均, 等. 放线菌蛋白质组学研究进展[J]. 生物工程学报, 2014, 30(7):1044-1058.
[9]Xia L, Cai J, Wang B, et al. Draft genome sequence of Nocardia seriolae ZJ0503, a fish pathogen isolated from Trachinotus ovatus in China[J]. Genome Announcements, 2015, 3(1):e01223-14.
[10]夏立群, 王蓓, 夏洪丽, 等. 鰤鱼诺卡氏菌培养条件及培养基的优化[J]. 南方水产科学, 2013, 9(3):51-56.
[11]Laurence F, Colette G, Abdellatif C, et al. The DmpA aminopetidase from ochrobactrum antropi LMG7991 is the prototype of a new terminal nucleophile hydrolase family[J]. Biochemical Journal, 1999, 341(Pt 1):147-155.
[12] Komeda H, Asano Y. A DmpA-homologous protein from Pseudomonas sp. is a dipeptidase specific for beta-alanyl dipeptides[J]. FEBS Journal, 2005, 272(12):3075-3084.
[13]高新星. 枯草芽孢杆菌氨肽酶分泌表达、分子改造及生理功能研究[D]. 无锡:江南大学, 2014.
[14]党光辉. 结核分枝杆菌酯酶的表达、纯化、结晶及理化特性研究[D]. 福州:福建农林大学, 2013.
[15]Holland C, Mak TN, Zimnyarndt U, et al. Proteomic identification of secreted proteins of Propionibacterium acnes[J]. Bmc Microbiology, 2010, 10(1):1-11.
[16]Negoro S, Kakudo S, Urabe I, et al. A new nylon oligomer degradation gene(nylC)on plasmid pOAD2 from a Flavobacterium sp. [J]. Journal of Bacteriology, 1992, 174(24):7948-7953.
[17]Seyffert N, Pacheco LG, Silva WM, et al. Preliminary serological secretome analysis of Corynebacterium pseudotuberculosis[J]. Journal of Integrated OMICS, 2011, 1(2):193-197.
[18]Barry DP, Beaman BL. Nocardia asteroides, strain GUH-2 induces proteasome inhibition and apoptotic death of cultured cells[J]. Research in Microbiology, 2007, 158(1):86-96.
[19]Beaman BL, Beaman L. Nocardia species:host-parasite relationships[J]. Clinical Microbiology Reviews, 1994, 7(2):213-64.
(责任编辑 狄艳红)
Gene Cloning and Subcellular Localization of DmpA from Nocardia seriolae
XIA Li-qun1,2,3CHEN Rui-min1LIAO Bao-shan1XU Liang1SU Ze-jie1TONG Bang-zhuo1
(1. Fisheries College of Guangdong Ocean University,Zhanjiang 524088;2. Guangdong Provincial Key Laboratory of Pathogenic Biology and Epidemiology for Aquatic Economic Animals,Zhanjiang 524088;3. Key Laboratory of Diseases Controlling for Aquatic Economic Animals of Guangdong Higher Education Institutions,Zhanjiang 524088)
Nocardia seriolae,a facultative intracellular bacterium,is the main pathogen of fish nocardiosis. Bioinformatics analysis showed that the DmpA gene of N. seriolae encoded a secreted protein,and may be co-located with mitochondria of the host cell. In this study,the recombinant plasmids pEGFP-DmpA and pcDNA-DmpA were constructed,extracellular product of N. seriolae was identified,and the subcellular localization and over-expression of DmpA were carried out. The results showed that the protein DmpA was identified in the extracellular products of N. seriolae,and confirmed as a secreted protein. Subcellular localization of DmpA-GFP fusion proteins were evenly distributed in the whole cell of FHM cells,and were not coincided with the distribution of mitochondria,indicating that the protein DmpA was not co-localized with the mitochondria. The expression of DmpA changed the distribution of mitochondria into lumps in the FHM cell. The overexpression of DmpA in FHM cells had no significant effect on the nucleus,revealing that the gene had no function on inducing cell apoptosis. The cloning,subcellular localization and over-expression of DmpA from N. seriolae laid the foundation for further studying the function of the gene and promoting the understanding of the pathogenic mechanism of N. seriolae.
Nocardia seriolae;gene DmpA;secreted protein;subcellular localization
10.13560/j.cnki.biotech.bull.1985.2016-0968
2016-10-27
广东省科技发展专项资金项目(2016A050502061),广东省自然科学基金(2014A030313602),深圳大鹏新区产业发展专项资金项目(KY20160207),广东省攀登计划项目(pdjh2016b0234)
夏立群,女,副教授,硕士生导师,研究方向:水生动物病原生物学;E-mail:11465668@qq.com

