重组毒素rCCK96-104PE38 靶向结肠癌生物特性研究
张嵩柳溪林李萌常江高世奇胡盼柳增善
(1. 吉林大学动物医学学院 人兽共患病研究所教育部重点实验室,长春 130062;2. 吉林大学中日联谊医院,长春 130033)
重组毒素rCCK96-104PE38 靶向结肠癌生物特性研究
张嵩1柳溪林2李萌1常江1高世奇1胡盼1柳增善1
(1. 吉林大学动物医学学院 人兽共患病研究所教育部重点实验室,长春 130062;2. 吉林大学中日联谊医院,长春 130033)
旨在原核表达并纯化新型重组毒素rCCK96-104PE38,验证其对结肠癌细胞的靶向杀伤作用。使用基因扩增技术将反向编译的胆囊收缩素CCK96-104与绿脓杆菌外毒素PE38融合,构建原核表达载体。利用Ni-NTA亲和层析进行纯化。通过结肠癌细胞体外杀伤实验以及结肠癌裸鼠模型的治疗验证rCCK96-104PE38的抗肿瘤能力。结果显示,扩增出的rCCK96-104PE38序列正确,成功利用pET-28a原核表达系统实现了活性表达。纯化后的重组蛋白能够在体外诱导结肠癌细胞凋亡,并能抑制裸鼠模型体内的肿瘤生长。成功制备高纯度、无标签的rCCK96-104PE38重组免疫毒素,体内、体外实验证实其具有抑制结肠癌的能力。
重组毒素;结肠癌;胆囊收缩素;绿脓杆菌外毒素
结肠癌是人类高发恶性肿瘤之一,其发病率一直呈上升趋势,全球每年患结肠癌的病例超过100万人[1]。目前,结肠癌的治疗手段以手术治疗为主,辅以化疗、放疗等治疗手段,针对结肠癌的常用抗肿瘤药物包括5-Fu(5-氟尿嘧啶)、伊立替康、奥沙利铂、卡培他滨等[2],但术后肿瘤易复发,且副作用不容忽视。近年来,基因治疗药物、免疫治疗药物等靶向治疗药物得到了快速发展[3],为结肠癌的治疗开辟了新途径。
分子靶向治疗是以肿瘤细胞过度表达的分子作为靶位,选择针对性的阻断剂,能够作用于肿瘤细胞生长、运动等的信号传导通路或诱导免疫因子识别并消灭肿瘤细胞等途径,从而使肿瘤细胞生长变慢或者发展停止[4,5]。研究发现,在胃肠道肿瘤发生发展的过程中,胆囊收缩素2型受体(CCK2R)在肿瘤细胞中的表达显著高于正常细胞,在部分结肠癌、大肠癌、胃癌细胞系中的过表达更加突出[6-9],是结直肠癌诊断和治疗的理想靶点。
本研究根据结肠癌与正常组织表面CCK2R数量与亲和力的巨大差异,利用基因工程技术构建新型重组毒素rCCK96-104PE38,即截取全长CCK的第96-104号氨基酸,反向重组后作为导向单元与具有高效细胞毒性的PE38(绿脓杆菌外毒素)结合,获得可以靶向高效杀伤结肠癌细胞的分子药物,并通过结肠癌体内体外实验探索其靶向特性,为临床前试验奠定基础。
1 材料与方法
1.1 材料
1.1.1 主要试剂 Ex Taq DNA聚合酶、限制性内切酶Nhe I和BamH I、低分子量蛋白Marker、DL2000核酸Marker、pMD-18T Kit、T4连接酶均购自日本TaKaRa公司;胶回收Kit、质粒小提Kit购自美国Axygen公司;卡那霉素、氨苄青霉素、IPTG购自北京鼎国公司;Ni-NTA亲和层析介质、Tricorn 10/150玻璃柱购自瑞典GE公司;rTEV酶购自北京索莱宝公司;胎牛血清、RPMI1640培养基购自美国Gibco公司;PVDF膜购自美国Millipore公司;荧光染料Dylight 488,HRP标记羊抗鼠IgG抗体购自上海艾博抗公司;PE38单克隆抗体3B9为本实验室制备;其他化学试剂均为国产分析纯。
1.1.2 质粒、菌株、细胞、裸鼠 pET-28a质粒购自德国Novagen公司;pET-rG17PE38重组质粒、感受态BL21(DE3)PLysS、感受态DH5α、人肝细胞LO2、大肠癌细胞系SW116、结肠癌细胞系HCT8、SW620、SW480均为本实验室保存,裸鼠购自上海斯莱克实验动物有限公司。
1.2 方法
1.2.1 rCCK96-104PE38原核表达菌株的构建
1.2.1.1 引物 以本实验室构建并保存到pET-rG17PE38为模板,利用PCR方法将反向的CCK96-104片段基因与PE38基因进行融合,并引入了rTEV酶特异性切割位点,人工合成引物为:其中,下划线分别为Nhe I和BamH I酶切位点。

1.2.1.2 原核表达载体的构建 将PCR产物与pET-28a质粒分别进行双酶切,然后通过1%琼脂糖凝胶电泳鉴定双酶切效果,并使用胶回收试剂盒回收目的基因和载体片段,使用T4连接酶水浴16℃过夜连接,连接产物转化到BL21(DE3)PLysS感受态细胞中。
1.2.2 重组毒素 rCCK96-104PE38的表达与鉴定
1.2.2.1 低温诱导表达 将重组菌按1∶100的比例接入LB培养基(Kana 50 ng/mL)中,于37℃ 7,1.5 h后,将培养箱温度降至16℃ 6将培养箱温度IPTG至终浓度0.1 mmol/L,摇培18 h。
1.2.2.2 Western blot 鉴定 将表达的rCCK96-104PE38重组蛋白进行 SDS-PAGE凝胶电泳,再通过电转仪转移到PVDF膜上,使用5%脱脂奶粉4℃封闭过夜后,先后加入PE38的单克隆抗体3B9(本实验室制备),和HRP标记羊抗鼠IgG二抗。最后加入ECL化学发光显色液显色呈像。
1.2.3 重组毒素 rCCK96-104PE38的纯化
1.2.3.1 Ni-NTA亲和层析 使用ÄKTA蛋白纯化仪进行纯化。首先用5-10个柱体积的Ni-NTA亲和层析平衡缓冲液Buffer A(50 mmol/L Tris-HCl,0.5 mol/L NaCl,10 mmol/L咪唑,10%甘油,pH7.0)充分平衡Ni-NTA亲和层析柱;将超声上清注入缓慢注入层析柱,再用洗脱缓冲液Buffer B(50 mmol/L Tris-HCl,0.5 mol/L NaCl,500 mmol/L咪唑,10%甘油,pH7.0)调节混合液咪唑浓度按梯度洗脱下目的蛋白。
1.2.3.2 rTEV酶切除组氨酸标签 加入rTEV酶对组氨酸标签切割,再通过Ni-NTA亲和层析获得切割标签后的目的蛋白。
1.2.4 重组毒素rCCK96-104PE38体外抑瘤实验
1.2.4.1 rCCK96-104PE38体外肿瘤细胞杀伤活性检测 将对数生长期的HCT116细胞以及人肝细胞LO2分别经胰酶消化后,以5×103个细胞/孔铺在96孔细胞培养板中,待细胞贴壁后加入终浓度为2 000 ng/mL的rCCK96-104PE38,用CCK-8试剂盒测定不同时间点重组毒素对肿瘤细胞的抑制率。
1.2.4.2 受体免疫荧光检测 在培养好的HCT116细胞中加入4%多聚甲醛固定30 min;5%胎牛血清封闭30 min;加入终浓度为2 000 ng/mL rCCK96-104PE38KDEL重组蛋白,37℃孵育10 min,再先后孵育PE38单抗和荧光二抗,通过荧光显微镜观察。
1.2.4.3 肿瘤抑制率测定 在对数生长期的人正常肝细胞、结肠癌细胞系HCT116、HCT8、SW620、胃癌细胞系BGC823、黑色素瘤B16、宫颈癌细胞系HeLa中,加入不同浓度的rCCK96-104PE38重组蛋白,孵育48 h后,使用CCK-8试剂盒测定肿瘤抑制率及IC50值。
1.2.5 重组毒素rCCK96-104PE38动物体内抑瘤实验
1.2.5.1 免疫缺陷鼠肿瘤模型的建立 取1×107个HCT116细胞溶于200 μL生理盐水中,用注射器注入裸鼠右前肢腋下。7 d后观察小鼠注射部位是否出现肿块。
1.2.5.2 rCCK96-104PE38治疗肿瘤模型 选取肿瘤体积达到50-100 mm3的肿瘤模型小鼠30只,平均分成6组,G1组:每日每只注射200 μL生理盐水;G2组:每日每只注射5 mg/kg rCCK96-104PE38;G3组:每日每只注射10 mg/kg rCCK96-104PE38;G4组:每日每只注射20 mg/kg rCCK96-104PE38;G5组:每日每只注射10 mg/kg奥沙利铂;G6组:每日每只注射10 mg/kg奥沙利铂和10 mg/kg rCCK96-104PE38。注射方式为尾静脉注射,连续注射14 d,治疗结束后将小鼠处死,记录瘤重、瘤体积,体重等指标。
2 结果
2.1 rCCK96-104PE38重组毒素的表达与鉴定结果
如图1所示,经10% SDS-PAGE电泳分析,诱导后的重组菌株在40 kD附近表达重组蛋白,与设计的rCCK96-104PE38大小相符。Western blot结果表明,该重组蛋白能与PE38抗体特异性结合。
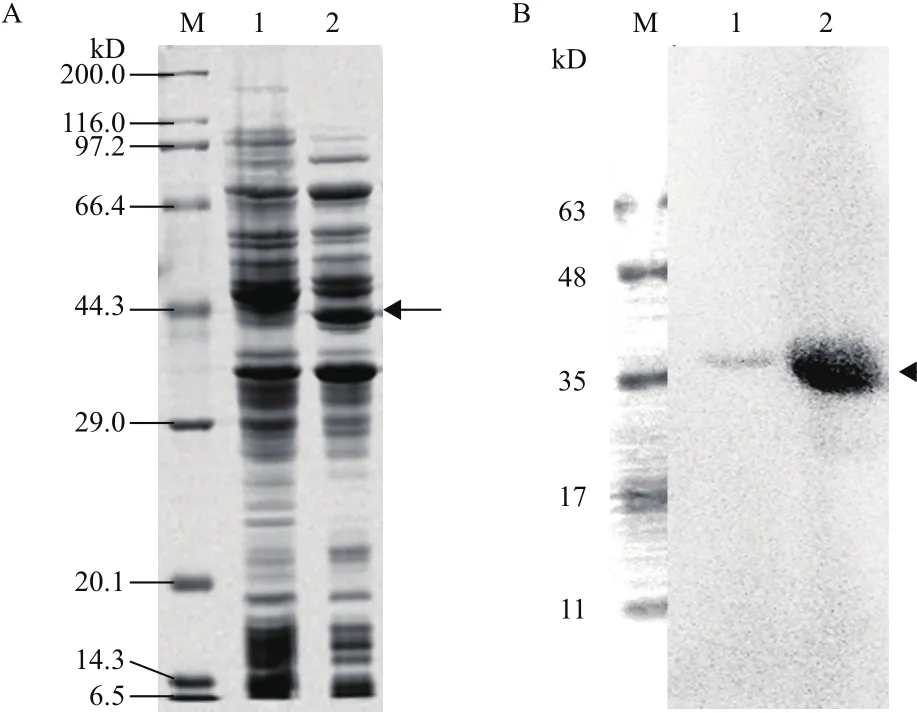
图1 重组蛋白rCCK96-104PE38的SDS-PAGE重组蛋白表达(A)与Western-blot鉴定结果(B)
2.2 Ni-NTA亲和层析纯化结果
经10% SDS-PAGE凝胶电泳分析,结果(图2)显示,在300-450 mmol/L咪唑浓度下,重组蛋白rCCK96-104PE38被洗脱下来。
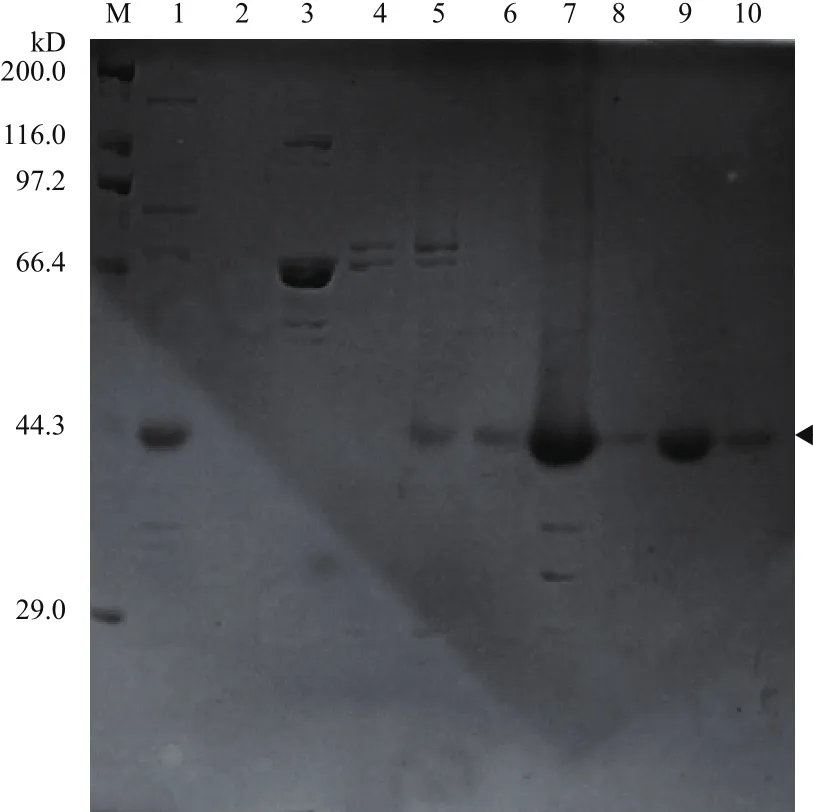
图2 Ni-NTA金属螯合亲和层析纯化(梯度洗脱)
2.3 肿瘤抑制曲线
如图3所示,在培养基中加入rCCK96-104PE38后,结肠癌细胞HCT116迅速凋亡,其致凋亡速率与PE毒素相近,而对人正常肝细胞没有显著影响;而PE毒素不仅能杀死肿瘤细胞,也能够致死正常的肝细胞,显示出对真核细胞的广谱杀伤性。

图3 抑制曲线
2.4 rCCK96-104PE38在靶细胞上的定位
通过间接免疫荧光实验,发现rCCK96-104PE38重组蛋白能够特异性的吸附在结肠癌细胞HCT116表面,而在肝细胞LO2上检测不到强的绿色荧光;PE毒素在HCT116及LO2细胞上均有结合,见图4。
2.5 rCCK96-104PE38对不同细胞的抑制效果
通过CCK8法测定不同浓度的重组蛋白对不同细胞的抑制率,并使用SPSS统计分析软件计算获得相应的IC50值(半抑制浓度)。如表1所示,rCCK96-104PE38对结肠癌细胞系的抑制效果最好,对胃癌细胞BGC823也有一定的作用,而对黑色素瘤B16、宫颈癌HeLa、人肝脏细胞LO2均没有显著抑制效果,与预期相符。

图4 间接免疫荧光检测rCCK96-104PE38在靶细胞上的定位

表1 rCCK96-104PE38对不同细胞杀伤效果(IC50)
2.6 毒性测试
裸鼠模型在单次注射30 mg/kg时即出现中毒现象,当剂量增加到60 mg/kg时有小鼠出现死亡(表2)。

表2 rCCK96-104PE38的急性毒力测试
2.7 体内抑瘤效果
以不同剂量的重组毒素和常规药物对结肠癌裸鼠模型进行治疗发现,20 mg/kg的rCCK96-104PE38能够显著抑制肿瘤的生长,与常规化疗药物奥沙利铂联合给药的抑瘤效果最好,见图5。

图5 体内抑瘤效果
3 讨论
重组免疫毒素是一种融合了靶向分子和毒素的人造蛋白,根据靶向分子的不同主要分为两类,一类是融合了靶向某种特异性受体的天然配体,一类是融合的抗体或单链抗体[10,11],本研究的rCCK96-104PE38重组免疫毒素就属于第一类重组免疫毒素,具有特异性靶向杀伤结肠癌肿瘤细胞的能力。
PE毒素,即绿脓杆菌外毒素,由638个氨基酸构成的一个单链多肽,属于双组分AB毒素家族[12]。PE毒素的优势在于,普通人体内没有PE毒素的预存抗体,而且PE毒素不仅毒性强,而且毒性机理研究已经很清楚,便于进行编辑改造及活性表达[12,13]。通过将PE分子非特异结构域1-252位和365-380位的氨基酸残基去除,得到了38 kD大小的PE38,具有更低的免疫原性,同时,将PE38羧基端的REDLK突变为KDEL,能够使细胞毒性提升6-10倍[14,15]。
胆囊收缩素(CCK)是由十二指肠和近端盲肠的I型肠内分泌细胞和大脑神经元合成分泌,其主要生理功能是刺激胰腺分泌、胆囊收缩、抑制胃酸分泌,产生饱腹感等[16]。CCK发挥作用均与CCK2R(胆囊收缩素2型受体)相关,而CCK2R在肿瘤细胞中过表达,因此可以将CCK作为重组免疫毒素特异性识别肿瘤细胞的识别元件[17]。CCK在人体内以多种长短不同的分子形式存在,均为含115个氨基酸的CCK原加工剪切形成的多肽[18],本研究最终选择了能发挥CCK2R亲和作用的第96-104位的Asp-Tyr-Met-Gly-Trp-Met-Asp-Phe-Gly九个氨基酸作为重组毒素的导向元件。
在测定rCCK96-104PE38重组免疫毒素对不同细胞的抑制效果时发现,其对胃癌细胞系BGC823也有明显的致凋亡作用,原因是CCK2R不仅在结肠癌细胞上高表达,在部分胃癌细胞、部分胰腺癌中也高表达[19-21],进一步证实了rCCK96-104PE38是通对CCK2R进行定位并发挥细胞毒作用。
4 结论
本实验室成功构建rCCK96-104PE38的原核表达载体,低温诱导表达出可溶性重组毒素蛋白,并通过Western blotting验证。重组蛋白经Ni-NTA亲和层析纯化。通过体外细胞实验和结肠癌裸鼠模型体内实验证实,rCCK96-104PE38具有靶向杀伤结肠癌的功能。
[1]Cunningham D, Atkin W, Lenz HJ, et al. Colorectal cancer[J]. Lancet, 2010, 375:1030-1047.
[2] 宫媛, 吴本俨. 循证医学评价结肠癌辅助化疗药物及新进展[J]. 中国新药杂志, 2007, 16(10):757-761.
[3]刘静, 黄红. 结肠癌发病机制中原癌基因与抑癌基因研究及相关药物治疗进展[J]. 中国药房, 2014, 25(45):4302-4304.
[4]Shan L, Liu Y, Wang P. Recombinant immunotoxin therapy of solid tumors:Challenges and strategies[J]. Journal of Basic and Clinical Medicine, 2013, 2(2):1-6.
[5]Mazor R, Eberle JA, Hu XB, et al. Recombinant immunotoxin for cancer treatment with low immunogenicity by identification and silencing of human T-cell epitopes[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(23):8571-8576.
[6]Feng XL, Liu ZS, Liu XL, et al. Establishment of a three-step purification scheme for a recombinant protein rG17PE38 and its characteristics identification[J]. Journal of Chromatography B, Analytical Technologies in the Biomedical and Life Sciences, 2015, 981-982:48-56.
[7]Quattrone A, Dewaele B, Wozniak A, et al. Promoting role of cholecystokinin 2 receptor(CCK2R)in gastrointestinal stromal tumour pathogenesis[J]. The Journal of Pathology, 2012, 228(4):565-574.
[8]Hayakawa Y, Jin G, Wang H, et al. CCK2R identifies and regulates gastric antral stem cell states and carcinogenesis[J]. Gut, 2015, 64(4):544-553.
[9]Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA:A Cancer Journal for Clinicians, 2016, 66(2):115-132.
[10]Kaplan G, Lee F, Onda M, et al. Protection of the furin cleavage site in low-toxicity immunotoxins based on Pseudomonas Exotoxin A[J]. Toxins(Basel), 2016, 8(8):pii:E217.
[11]Liu XF, Xiang LM, Zhou Q, et al, Actinomycin D enhances killing of cancer cells by immunotoxin RG7787 through activation of the extrinsic pathway of Apoptosis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(38):10666-10671.
[12]Michalska M, Wolf P. Pseudomonas Exotoxin A:optimized by evolution for effective killing[J]. Frontiers in Microbiology, 2015, 6:963.
[13]祁志荣, 李虹. PE类重组免疫毒素的研究进展[J]. 微生物学免疫学进展, 2006, 34(1):50-53.
[14]杜世彧. 绿脓杆菌外毒素A的结构、功能及其重组毒素[J].生物化学与生物物理进展, 1995, 22(2):112-117.
[15]Hui Q, Ma J, Song J, et al. In vitro and in vivo studies of antitumor effects of the recombinant immunotoxin MSH-PE38KDEL on melanoma[J]. Neoplasma, 2014, 61(4):392-400.
[16]杜静, 张连峰, 秦川. 胆囊收缩素作用的研究进展[J]. 中国比较医学杂志, 2007, 17(4):233-236.
[17]Sherman PJ, Separovic F, Bowie JH. The investigation of membrane binding by amphibian peptide agonists of CCK2R using(31)P and(2)H solid-state NMR[J]. Peptides, 2014, 55:98-102.
[18]Kossatz S, Behe M, Mansi R, et al. Multifactorial diagnostic NIR imaging of CCK2R expressing tumors[J]. Biomaterials, 2013, 34(21):5172-5180.
[19]Reubi JC. Targeting CCK receptors in human cancers[J]. Curr Top Med Chem, 2007, 7:3.
[20]Roy J, Putt KS, Oppola DS, et al. Assessment of cholecystokinin 2 receptor(CCK2R)in neoplastic tissue[J]. Oncotarget, 2016, 7(12):14605-14615.
[21]Gao S, Song J, Chen F, et al, A novel immunotoxin-rCCK8PE38 targeting of CCK-R overexpressed colon cancers[J]. J Drug Target, 2015, 23(5):462-468.
(责任编辑 马鑫)
Characterization of Recombinant Toxin rCCK96-104PE38 Targeting Colon Cancer
ZHANG Song1LIU Xi-lin2LI Meng1CHANG Jiang1GAO Shi-qi1HU Pan1LIU Zeng-shan1
(1. Key Laboratory of Zoonosis,Research Ministry of Education,College of Veterinary Medicine,Jilin University,Changchun 130062;2. China-Japan Union Hospital of Jilin University,Changchun 130033)
This work aims to conduct the prokaryotic expression and purification of a novel recombinant toxin rCCK96-104PE38,and to verify the targeted killing effect on colon cancer cells. A reversed cholecystokinin(rCCK96-104)was conjunct to pseudomonas exotoxin(PE38)by gene amplified technology to construct a prokaryotic expression vector. Ni-NTA affinity chromatograph was used for purification. The anti-tumor ability of rCCK96-104PE38 was verified by in vitro cytotoxicity of colon cancer cells and vivo experiment with nude mice model. Results showed that the amplified gene of rCCK96-104PE38 was in correct sequence as designed,i.e.,the active expression was successfully achieved using prokaryotic expression system of pET-28a. The purified recombinant protein induced the apoptosis of colon cancer cells in vitro,and inhibited the tumor growth in nude mice model. Conclusively,it was successful to produce the recombinant toxin rCCK96-104PE38 in high purity and with no tags,the vitro and vivo experiments confirmed that it had inhibitory ability on colon cancer.
recombinant toxin;colon cancer;cholecystokinin;pseudomonas exotoxin
10.13560/j.cnki.biotech.bull.1985.2017.04.032
2016-12-21
国家青年科学基金项目(81401953),中国博士后科学基金面上项目(2014M561303),中国博士后科学基金特别资助项目(2015T80312),吉林省青年基金项目(20160520162JH),教育部博士点基金项目(20120061110078),吉林省科学技术厅计划项目(20120966)
张嵩,男,硕士研究生,研究方向:动物性食品安全;E-mail:442557139@qq.com
柳增善,男,教授,研究方向:动物性食品安全,E-mail:zsliu1959@sohu.com;胡盼,女,讲师,研究方向:动物性食品安全,E-mail:hupan84@163.com

