慢病毒介导的Math1基因感染神经干细胞研究*
潘 松,陈绮琴,钱学贞,张 松,周 军
广东省深圳市光明新区人民医院(深圳518106)
慢病毒介导的Math1基因感染神经干细胞研究*
潘 松,陈绮琴,钱学贞,张 松,周 军
广东省深圳市光明新区人民医院(深圳518106)
目的:探讨慢病毒携带目的基因Math1感染神经干细胞的适宜条件及其影响。方法:以不同感染复数(MOI)的慢病毒分别感染神经干细胞,确定最适感染条件。无血清培养液继续培养,观察感染效率有无下降。结果:随着MOI的增加,慢病毒的效率效率逐渐增加;当MOI为10时,感染效率达(83.83±1.49)%。无血清培养液继续培养30 d后,感染效率达(81.27±1.48)%,与继续培养前比较无明显下降(P>0.05)。结论:携带目的基因的重组慢病毒可成功感染神经干细胞,被感染的神经干细胞的生长无明显改变。
神经干细胞(NSC)是一类有向神经系统方向分化潜能的,来源于神经系统的细胞;可以通过细胞的有丝分裂不断产生新的子代细胞[1]。研究[2]表明:移植入正常成年大鼠耳蜗内的NSC可以存活,并不影响大鼠的听力和内耳毛细胞的静纤毛、表皮板的形态。这为NSC作为载体移植入成年大鼠耳蜗提供了理论基础。
Math1基因属于碱性螺旋-环-螺旋(bHLH)转录因子家族的一员,是产生耳蜗毛细胞所必须的[3]。研究[4]表明:体外培养的内耳椭圆囊斑中支持细胞等被过量表达Math1后多数可转化为毛细胞。这为Math1用于毛细胞再生的研究提供了理论基础。若是能构建以NSC为载体,表达Math1基因的基因工程修饰的NSC,无疑为毛细胞再生的在体研究提供了新的研究手段。本研究通过已成功构建的含有目的基因Math1和报告基因EGFP的重组慢病毒(LV-EGFP-Math1),感染体外培养的NSC,初步探讨重组慢病毒感染NSC的适宜条件和对其生长的影响。
材料与方法
1 动物与试剂 实验动物购自广东省医学实验动物中心,怀孕14~19 d的SD大鼠;实验仪器采用常规细胞培养相关仪器和显微镜等;实验试剂参照课题组前期的研究报道[5];质粒、菌株、细胞器、主要酶和试剂具体参照课题组前期的研究报道[6]。
2 实验方法
2.1 NSC的分离、培养和鉴定:具体参照课题组前期的研究报道[5]。
2.2 Math1重组慢病毒(LV-EGFP-Math1)的构建和鉴定:具体参照课题组前期的研究报道[6]。
2.3 LV-EGFP-Math1感染NSC:①取第3代NSC球,机械吹打和细胞计数后,以105个细胞/300微升接种于4孔板。②按MOI分别为0、1、5、10分组,依次加入LV-EGFP-Math1并充分混匀,继续培养18h 。MOI为慢病毒的TU数/NSC的细胞数。
2.4 显微镜下观察并计算感染率:第5天(感染第3天),荧光显微镜观察EGFP表达的绿色荧光。随机取5个视野,计数绿色荧光细胞总数,同一视野下计数NSC总数,以前者/后者计算感染率。
2.5 NSC-LV-Math1-EGFP的继续培养:取感染第3天的NSC-LV-EGFP-Math1,继续无血清培养30d,按培养时间不同分组观察NSC生长情况和计算感染率。

结 果
1 NSC-LV-Math1-EGFP的生长和感染率情况见表1。感染第1~4天,可见绿色荧光的表达逐渐增强。从第4天开始,绿色荧光未见表达明显增强。为尽量避免由于绿色荧光反复激发造成的荧光衰减,选定感染第3天来观察LV-EGFP-Math1感染NSC的效率。
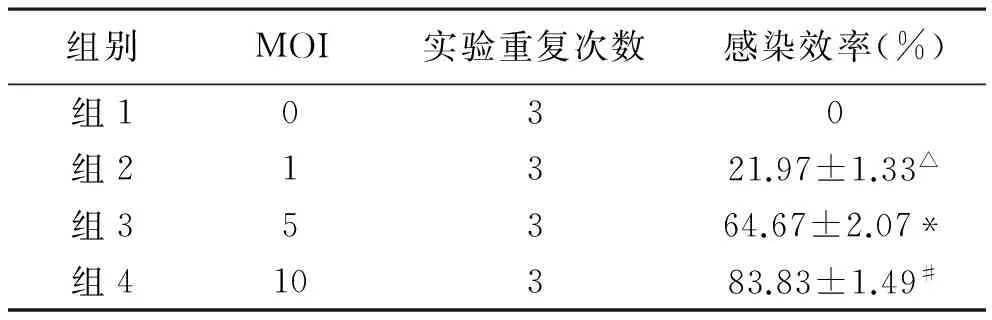
表1 不同MOI组的慢病毒感染NSC的感染效率
注:与第1组比较,△P<0.05;与第1、2组比较,*P<0.05;与第3、2、1组比较,#P<0.05
2 NSC-LV-EGFP-Math1的无血清培养的观察见表2。感染第3天的MOI为10的NSC-LV-EGFP-Math1,以无血清培养液继续培养30d后,镜下所见的神经球绿色荧光表达无明显减少,约占细胞总数的(81.27±1.48)%,与感染第3天的感染效率相比无明显降低(P<0.05)。

表2 培养不同时间的NSC-LV-Math1-EGFP的感染效率
注:两组感染效率比较,P>0.05
讨 论
利用携带目的基因的神经干细胞移植入体内,治疗神经系统疾病已日益引起研究者的注意[7];不仅携带的目的基因可以在神经干细胞中表达,神经干细胞由于其有分化为神经元细胞和神经胶质细胞的潜能[1],也可以发挥其对病变的修复和治疗作用。
我们利用慢病毒载体,同时携带目的基因Math1基因和报告基因EGFP,由于EGFP和Math1基因整合在同一病毒基因组内, EGFP和Math1基因的转录和翻译会同时进行,我们可以通过观察EGFP的绿色荧光的来确定NSC是否被慢病毒感染,进而评估慢病毒的感染效率和其对宿主细胞的影响。我们发现:随着MOI值的增加,慢病毒感染效率也逐渐增加,且各组增加比较有显著性差异;当MOI值为10时,慢病毒感染效率达到80%~90%,已可以满足后续细胞移植的实验要求。对于慢病毒感染效率的评估还可以考虑用流式细胞仪来进行,考虑到流式细胞仪检测时要求细胞尽量为单个,这对聚集的神经球细胞要将之吹打成单细胞来说,操作比较困难,当然我们的后续研究时要尽量弥补这一部分的数据。
为进一步探讨感染的目的基因是否能在宿主细胞中长期稳定表达,我们继续培养NSC-LV-EGFP-Math1一个月后发现:NSC可继续很好的生长,其携带的绿色荧光蛋白较前无明显表达减弱,感染效率与一个月前比较无明显差异,说明慢病毒载体介导的Math1基因对NSC的正常生长无明显影响并可长期、稳定地在NSC中表达。
总之,重组慢病毒LV-EGFP-Math1可以成功感染NSC,适宜MOI值为10,感染后NSC-LV-EGFP-Math1的生长活性无明显改变,可长期表达Math1基因。
[1] Lee-Kubli CA, Lu P.Induced pluripotent stem cell-derived neural stem cell therapies for spinal cord injury[J].Neural Regen Res, 2015, 10(1):10-16.
[2] Fu Y, Wang S, Liu Y,etal. Study on neural stem cell transplantation into natural rat cochlea via round window[J].Am J Oto,2009, 30(1):8-16.
[3] Yang J, Cong N, Han Z,etal. Ectopic hair cell-like cell induction by Math1 mainly involves direct transdifferentiation in neonatal mammalian cochlea[J]. Neurosci Lett,2013, 549: 7-11.
[4] Shou J,Zheng JL,Gao WQ. Robust generation of new hair cells in the mature mammalian inner ear by adenoviral expression of Hath1[J].Mol Cell Neu,2003,23(2):169-179.
[5] 潘 松,付 勇,刘 强,等.胚胎大鼠海马源性神经干细胞的分离、培养、分化和鉴定[J].陕西医学杂志,2011,40(1):3-6.
[6] 潘 松,付 勇,刘 强,等.Math1基因重组慢病毒的构建及其在293T细胞中的表达[J].中国现代医学杂志,2011,21(4):412-417.
[7] Zhao Y, Zuo Y, Jiang J,etal. Neural stem cell transplantation combined with erythropoietin for the treatment of spinal cord injury in rats[J]. Exp Ther Med,2016, 12: 2688-2694.
(收稿:2016-06-20)
The study of neural stem cells infected by recombinant lentivirus with Math1
Pan Song, Chen Qiqin, Qian Xuezhen, et al.
Guangming New District People’s Hospital in Shenzhen (Shenzhen 518106)
Objective:To explore suitable condition of NSC infected by lentivirus with Math1, growth of NSC influenced by lentivirus.Methods:To determine suitable infection condition by using lentivirus with different MOI to infect NSC. To explicit whether infected ratio reduced when infected NSC were culture by serum-free medium. Results:With the increase of MOI, infected efficiency gradually increased. Infected efficiency reached(83.83±1.49)% when MOI was 10. After sequentially cultured 30 days, infected efficiency reached(81.27±1.48)% which had no significantly decline compared to 30 days ago.Conclusion:Recombinant lentivirus with target gene could successfully infect neural stem cells, and there has no significant change in the growth of infected NSC.
Stem cells Lentivirus Infection @Lentivirus with Math1
*广东省深圳市医疗卫生类科技计划项目(201303252)
干细胞 慢病毒属 感染 @携带目的基因Math1
R392.2
A
10.3969/j.issn.1000-7377.2017.05.003

