促性腺激素受体在母犬生殖器官的表达定位研究
牛云超, 刘丹阳, 张 睿, 尹熙俊, 崔成都,*
(1.延边大学农学院;2.吉林省转基因动物与胚胎工程重点实验室:吉林 延吉 133002)
促性腺激素受体在母犬生殖器官的表达定位研究
牛云超1, 刘丹阳1, 张 睿1, 尹熙俊2, 崔成都1,2*
(1.延边大学农学院;2.吉林省转基因动物与胚胎工程重点实验室:吉林 延吉 133002)
为研究促性腺激素受体(FSHR、LHR)在母犬生殖器官中的分布情况,运用免疫组织化学SABC法对处于卵泡期、黄体期成年母犬的卵巢、子宫、输卵管中FSHR和LHR分别进行免疫定位。结果表明:FSHR和LHR阳性细胞在卵巢主要见于卵母细胞、颗粒细胞、卵泡膜细胞、外周生殖上皮细胞和血管周围间质细胞;输卵管中主要分布于输卵管黏膜表面的柱状上皮细胞和肌层细胞;子宫中主要见于子宫内膜上皮细胞、子宫腺上皮细胞。此外,发情周期不同,FSHR和LHR的表达量存在差异,卵泡期卵巢FSHR和LHR的表达量均高于黄体期,且卵泡期卵巢的FSHR阳性反应强度均高于LHR;子宫中卵泡期FSHR、LHR的阳性反应强度高于黄体期,且黄体期中LHR阳性反应强度高于FSHR;输卵管中卵泡期FSHR、LHR的阳性反应强度高于黄体期,且黄体期LHR阳性反应强度高于FSHR。本试验研究促性腺受体在动物生殖器官中的表达情况,对进一步探讨动物促性腺激素的作用机制,具有非常重要的意义。
母犬;生殖器官;FSHR;LHR
促卵泡素(FSH)和促黄体素(LH),是由垂体分泌的促性腺激素(GTH)的主要成分,这些激素必须与靶器官的促卵泡素受体(FSHR)和促黄体素受体(LHR)结合才能发挥其生理功能[1-2]。由此可知,研究促性腺受体在动物生殖器官中的表达情况,对进一步探讨动物促性腺激素的作用机制,具有非常重要的意义。研究表明,促性腺激素(FSHR、LHR)受体在鼠[3-5]、猪[6]、山羊[7]、水牛[8]等动物[9]的生殖器官中均有表达,且其表达量随发情周期不同有所差异。
犬是季节性单次发情动物,其间情期和乏情期较长,生殖活动和繁殖率具有一定的不稳定性等,不同于其他哺乳动物的特殊生殖生理特性。犬的促性腺激素受体定位和表达还未见报道。因此,本研究采用SABC免疫组化试验方法,从形态学角度入手系统研究母犬在不同发情周期生殖器官中 FSHR和LHR的表达定位情况,为探讨犬GTH受体调控犬的生殖生理作用机理提供理论依据。
1 材料与方法
1.1 材料
1) 取材 试验用1~2周岁健康未孕母犬生殖器官(卵巢、输卵管和子宫)均由吉林龙井市屠宰场提供,屠宰后迅速取出处于卵泡期和黄体期的母犬生殖器官各8组,生理盐水冲洗,4%多聚甲醛室温固定24 h。
2) 主要试剂与仪器 兔抗FSHR/LHR多克隆抗体、FSHR/LHR原位杂交检测试剂盒、即用型SABC-POD(兔IgG)试剂盒、抗兔SABC试剂盒、DAB显色试剂盒、多聚赖氨酸、焦磷酸二乙酯(DEPC)等均购自武汉博士德公司;石蜡组织切片机,石蜡包埋机,生物显微镜(日本Olympus),病理图像分析系统等。
1.2 方法
1.2.1 切片标本制备
固定组织流水冲洗,经梯度酒精脱水,二甲苯透明,制作5~6 μm厚石蜡组织切片。每个组织选取连续的相邻3张切片分别作常规HE染色、FSHR、LHR免疫组化染色,另取相邻2张切片分别用于免疫染色对照。
1.2.2 FSHR/LHR免疫组织化学染色
切片常规脱蜡入水,3% H2O2室温孵育,复合消化液消化 5~10 min,PBS冲洗2 min×3次,滴加 5%BSA封闭液室温孵育20 min,滴加兔抗FSHR 或 LHR 多克隆抗体(1∶150),4 ℃孵育过夜,PBS洗5 min×3次,滴加生物素化山羊抗兔IgG,20 ℃ 20 min,PBS(7.2~7.6)洗5 min×3次,滴加 SABC、20 ℃ 20 min,DAB室温显色5~10 min,苏木素轻度复染,脱水透明封片,生物显微镜观察照相。 阴性对照以0.02 mol/L PBS代替兔抗FSHR/LHR一抗,其余步骤同上。
1.2.3 判定标准
FSHR和LHR免疫阳性反应物质为浅黄色或棕黄色,背景无色或淡蓝色,细胞核呈淡蓝色或蓝色,反差明显。阴性对照呈阴性反应。不同发情周期犬生殖器官中,FSHR和LHR免疫阳性细胞的染色强度存在差异,由此可知其FSHR和LHR的表达量不同,染色强度大,相应受体的表达水平越高。
2 结果与分析
2.1 FSHR和LHR在犬卵巢中表达定位
犬卵巢中,FSHR、LHR免疫反应阳性物质主要见于卵母细胞、颗粒细胞、卵泡膜细胞、外周生殖上皮细胞、间质细胞。卵泡期,卵母细胞、颗粒细胞、血管周围间质、卵泡膜细胞等处均呈现中等强度的FSHR阳性反应(图1,A);卵母细胞呈现弱强度LHR阳性反应,颗粒细胞及卵泡膜细胞处呈现中等强度LHR阳性反应(图1,B);黄体期,FSHR阳性反应物质主要见于生殖上皮细胞、间质细胞及浅层原始卵泡中,其中,生殖上皮细胞呈强FSHR阳性反应、间质细胞呈中等强度强度FSHR阳性反应、原始卵泡呈弱FSHR阳性反应(图1,D);生殖上皮细胞呈强LHR阳性反应,间质细胞呈中等强度LHR阳性反应,原始卵泡呈弱LHR阳性反应(图1,D)。阴性对照组均呈阴性(图1,C、F)。
2.2 FSHR和LHR在犬输卵管中表达定位
犬输卵管中,FSHR、LHR免疫反应阳性物质主要见于粘膜上皮细胞、固有层细胞和肌层细胞及输卵管分泌物中。卵泡期,较强的FSHR、LHR阳性反应物质位于黏膜上皮、肌层和固有层细胞内(图2,A、B);黄体期,粘膜固有层和肌层内可见弱FSHR、LHR免疫反应阳性物质,而粘膜上皮内无阳性物质(图2,D、E)。阴性对照组均呈阴性(图2,C、F)。
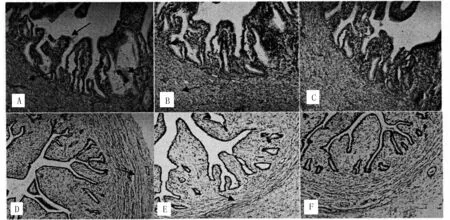
A:卵泡期 FSHR阳性;B:卵泡期LHR阳性;C:卵泡期阴性对照;D:黄体期FSHR阳性;E:黄体期LHR阳性 ;F:黄体期阴性对照。箭头所指为免疫阳性细胞。
2.3 FSHR和LHR在犬子宫中表达定位
犬子宫中,FSHR、LHR免疫反应阳性物质主要见于宫粘膜上皮细胞、固有层细胞、子宫肌层、子宫腺体细胞及子宫外膜细胞。卵泡期,FSHR、LHR阳性物质在子宫粘膜上皮细胞、子宫腺细胞、肌层和外膜等处均有较强染色(图3,A、B)。黄体期,FSHR阳性细胞在内膜上皮细胞、固有层细胞染色较弱,LHR在内膜上皮细胞处有较强染色。其中卵泡期的FSHR、LHR的整体染色强度高于黄体期 (图3,D、E)。阴性对照组均呈阴性(图3,C、F)。
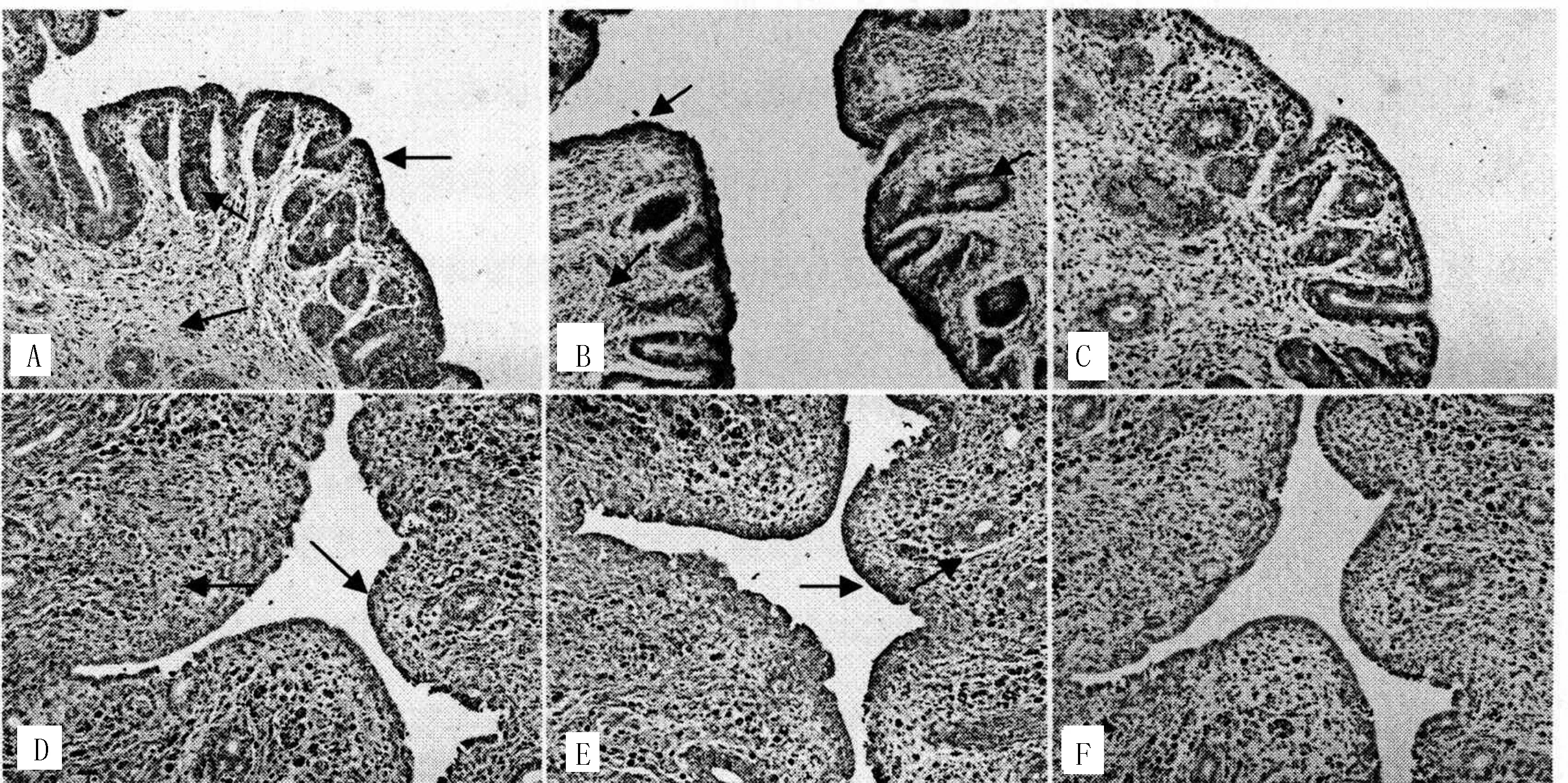
A:卵泡期 FSHR阳性;B:卵泡期LHR阳性;C:卵泡期阴性对照;D:黄体期FSHR阳性;E:黄体期LHR阳性 ;F:黄体期阴性对照。箭头所指为免疫阳性细胞。
3 讨论与结论
近年来,围绕GTH受体在动物生殖器官中的作用机制以及定位已有很多研究,在大鼠等啮齿类动物及猪、山羊、水牛等[3-8]哺乳动物中均作过相关报道,但对于母犬按发情周期进行GTH受体的研究却未见报道。
卵巢作为GTH发挥作用的重要场所,GTH受体主要分布在卵巢颗粒细胞和卵泡膜细胞[9-10]。而本试验观察到犬卵巢中FSHR、LHR阳性物质,不仅见于卵巢颗粒细胞和卵泡膜细胞,而且在卵母细胞及血管周围间质也有分布,说明FSHR、LHR的分布特点与促性腺激素的结合和敏感性应具有直接的关系。
FSHR从只有单层颗粒细胞的卵泡开始,几乎出现在所有的卵泡中[11],这与本试验结果一致,表明母犬FSH对腔前卵泡的发育具有一定的促进作用,但LH对腔前卵泡的发育作用说法不一,有关研究报道,LHR在卵泡发育早期就已存在,随后也发现LHR在体外发育的腔前卵泡中有阶段性的表达[5、12]。本试验也在母犬原始卵泡及初级卵泡中发现LHR阳性物质,但腔前卵泡中LHR的表达还有待于进一步证实。GTH通过体循环到达卵巢内的各级血管[2],本试验也观察到卵泡血管周围间质有受体分布,这有利于GTH特异性地识别并穿过血管壁到达卵泡靶细胞,使得卵母细胞保持良好生长趋势,卵泡才有机会向优势卵泡分化。
Mizarachi D研究表明,促性腺激素在性腺以外的生殖组织尤其是子宫、输卵管中也有表达,促性腺激素受体可能直接参与子宫、输卵管功能的调节。在发情前期及发情期的牛子宫颈中FSHR的含量高于其他发情阶段[14-15],而LHR及其mRNA在牛子宫内膜上皮细胞中的表达量却在黄体期最高[13]。这表明FSH、LH与相应的促性腺激素受体处于动态的平衡过程,FSHR、LHR的分布及功能在卵泡期与黄体期是有区别的,这与本试验的研究结果一致。Derecka K研究表明,在母猪卵泡期和黄体期输卵管中存在LHR转录物[16],这与当时所处的发情周期有关,在牛的输卵管粘膜上皮细胞处也发现FSHR和 LHR阳性物质,进一步表明FSH与LH可能直接调节输卵管的功能。
总之,促性腺激素受体在犬不同发育阶段的卵巢、子宫、输卵管中均表达,说明母犬生殖器官发育过程中,GTH与其他哺乳动物一样,也可能以旁分泌或自分泌的方式在生殖器官发育、发情周期中发挥了重要的调节作用。但是,本研究仅观察了卵泡期和黄体期母犬生殖器官中GTH受体表达情况,发情期的不同阶段雌犬GTH受体表达有何特点还有待于进一步研究。
[1] 陈杰.家畜生理学-第四版[M].北京:中国农业出版社,2003:35-40.
[2] 赵兴绪.兽医产科学-第四版[M].北京:中国农业出版社,2009:28-45.
[3] 吴馨培,王树迎. 小鼠卵巢促性腺激素受体的免疫组化定位[J].中国实验动物学报,2007,15(01):52-55.
[4] Minegishi T,Hirakawa T,Kishi H,et al. A role of insulin-like growth factorⅠfor follicle-stimulating hormone receptor expression in rat granulose cells[J].Biol Reprod,2000,62:325-333.
[5] 周晓旭,李雁冰,宁博林,等.不同剂量激素处理对小鼠超数排卵及产仔性能的影响[J].黑龙江八一农垦大学学报,2015,27(03)32-35.
[6] 孙建武,杨小婷,李吕木,等.日粮能量水平对圩猪生产性能·血清生化指标和肉质的影响[J].安徽农业科学.2015,43(10):134-137.
[7] 龙威海,丁玫,冯文武,等.卵泡刺激激素受体基因(FSHR)在贵州地方山羊的多态性及表达研究[J].农业生物技术学报,2015,23(06):755-761.
[8] 罗松洋培.提高牦牛生产性能的技术措施[J].安徽农业科学,2016,44(05):72-73.
[9] 李晓楠,方庆.生殖激素对龟类生殖调控的研究进展[J].安徽农业科学,2016,44(17):130-133.
[10] 王文芳.高原甘加型藏羊发情周期卵巢FSHR和LHR分布及其mRNA表达规律研究[D].兰州:甘肃农业大学,2016.
[11] 张明玉,迟晓星,丁啸宇.金雀异黄素对围绝经期模型小鼠卵巢组织及其安全性的影响[J].黑龙江八一农垦大学学报,2016,28(03):51-55.
[12] 葛杏林,候锁柱,沈鸿敏.应用免疫组织化学方法定位多囊卵巢促性腺激素受体的研究[J].河北医科大学学报,1996,17(03):129-131.
[13] 何晶,耿仁德,计红,等.海兰褐蛋鸡卵巢与输卵管FSHR与LHR基因定量的研究[J].黑龙江八一农垦大学学报,2015,27(02):27-31.
[14] Mizarachi D,Shemesh M.Follicle-stimulating hormone receptor and its messenger ribonucleic acid are present in the bovine cervix and can regulate cervical prostanoid synthesis[J].Biology of Reproduction,1999,61:776-784.
[15] Friedman S,Gurevich M,Shemesh M.Bovinecyclic endometrium contains high affinity luteinizing hormone/ human chorionic gonadotropin binding sites[J].Biol Reprod,1995,92:1020-1026.
[16] Derecka K,Pietila E M,Rajaniemi H J,et a1.Cycle dependent LH/hCG receptor gene expression in porcine nongona dal reproductive tissues[J].J Physiol Pharmacol,1995,46:77-85.
Study on the expression and localization of gonadotropin receptors in reproductive organs of bitches
NIU Yunchao1, LIU Danyang1, ZHANG Rui1, YIN Xijun2, CUI Chengdu1,2*
(1.AgriculturalCollegeofYanbianUniversity;2.JilinProvincialKeyLaboratoryofTransgenicAnimalsandEmbryoEngineering,JilinYanji133002)
In this study, we investigated the distribution of gonadotropin receptor (FSHR, LHR) in the reproductive organs of bitches. Immunohistochemical SABC method was used to investigate the expression of FSHR and LHR in the ovaries, uterus and fallopian tubes of foliage for immunization. The results showed that FSHR and LHR positive cells were mainly found in oocytes, granulocytes, follicular cells, peripheral reproductive epithelial cells and perivascular interstitial cells in the ovaries. They were mainly distributed in the columnar epithelium and myometrial cells of the oviducts, and mainly seen in endometrial epithelial cells, uterine glandular epithelial cells of the uterus. In addition, the expression of FSHR and LHR was different, and the expression of FSHR and LHR in ovarian follicle was higher than that of luteal phase. The FSHR positive rate of ovarian follicle was higher than that of LHR. The positive response intensity of LHR was higher than that of luteal phase, and the intensity of LHR was higher than that of FSHR. The positive response intensity of FSHR and LHR in fallopian tube was higher than that of luteal phase. The study of the expression of gonadal receptors in animal genital organs has great significance to further explore the mechanism of action of animal gonadotropin.
Bitch; reproductive organs; FSHR; LHR
2017-02-18 基金项目:吉林省教育厅科技基础条件平台建设专项(20150622005005JC)
牛云超(1993—),女,河北石家庄人,在读硕士,研究方向为兽医病理学与动物生殖生物学。崔成都为通信作者,E-mail:cdcui@ybu.edu.cn
1004-7999(2017)01-0071-05
10.13478/j.cnki.jasyu.2017.01.012
S858.292
A

