Notch1 通路与胶质瘤细胞管道形成能力相关性研究☆
张清平梅鑫柯超陈银生陈芙蓉陈建良陈忠平
·论 著·
Notch1 通路与胶质瘤细胞管道形成能力相关性研究☆
张清平*梅鑫△柯超△陈银生△陈芙蓉△陈建良※陈忠平△
目的 探索胶质瘤细胞来源的管道(glioma clls derived vessels,GCDV)的形成机制。方法 将胶质瘤细胞株U87、U251、U373、SF295、T98G、SKMG-4和C6进行体外三维培养,观察其管道形成能力。Western blot检测各个胶质瘤细胞株Notch1、Dll4蛋白的表达情况。结果 三维培养C6细胞单个视野下(100×)的平均管道数(25.2±5.0)个,U373为(36.4±3.20)个,U87为(19.0±2.2)个,T98G为(12.6±2.4)个,SF295为(4.0±2.)个,U251为(0.2± 0.4)个,SKMG-4为0。Notch1在U87、U251、T98G、SF295、SKMG-4、C6、U373表达相关密度分别为0.34、0.21、0.79、0.04、0.28、1.75、1.19,与管道形成能力显著相关(r=0.778,P=0.019);Dll4表达相关密度与管道形成能力不相关(r=0.635,P=0.062)。结论 Notch1蛋白表达与细胞株管道形成能力密切相关,而Dll4蛋白的表达与细胞株管道形成能力有待进一步探索。
Notch1 胶质瘤 三维培养 管道形成
血管拟态(vasculogenic mimicry,VM)是靶向血管新生治疗的重要靶点[1],肿瘤细胞体外培养时管道形成能力是其体内发生血管拟态能力的反映。目前对于管道形成能力的机制研究提示血管内皮生长因子(VEGF)[2]、血管内皮生长因子受体(VEGFR)[3]、CD31[4]、VE钙粘蛋白[5]、基质金属蛋白2(MMP-2)[6]、层粘连蛋白(laminin)[7]是重要影响因素。我们已经发现胶质瘤标本中有明显的血管拟态现象发生,并在胶质瘤细胞体外培养时证实了其管道形成能力[8],但影响管道形成能力的因素尚不明了。经典的Notch1通路在调控血管新生上有重要作用[11],而关于其在拟态管道形成的作用尚未有报道。本研究检测不同胶质瘤细胞株管道形成能力的不同,以及Notch1、以及Notch1的配体Dll4的表达水平之间的差异,并分析胶质瘤细胞株管道形成能力与Notch1、Dll4的表达相关性。
1 材料与方法
1.1 研究对象 实验所用胶质瘤细胞株 U87、U251、T98G、SF295、SKMG-4、C6、U373都由中山大学肿瘤防治中心实验研究部保存并提供。
1.2 细胞三维培养 细胞均培养于添加10%胎牛血清的DMEM培养液(美国Gbico公司)中,培养条件为37℃和5%CO2。取细胞对数生长期时段进行实验。将20μL matrigel胶(美国BD公司)平铺在35mm培养皿中。取状态良好的细胞消化成单个细胞后 DMEM培养基重悬并添加 10ng/ mLVEGF和10%胎牛血清。按1×105/mL的细胞浓度接种于matrigel胶;接种后在37℃、5%CO2条件下培养6h后观察。
1.3 Western blot检测Notch1、Dll4蛋白的表达情况 常规方法提取各个细胞株的蛋白,行SDSPAGE电泳,转膜,用50 g/L脱脂奶粉封闭1 h后。一抗为Anti-Notch1、Anti-Dll4(美国Abcam)兔来源单克隆抗体(1:1000)及β-actin(1:10000)兔来源单克隆抗体,二抗(美国Abcam)为辣根过氧化物标记的山羊抗兔抗体 (1:10000),浸泡于发光液1min后在暗房中将PVDF膜平铺于压片盒,取X光片5张铺于其上,扣紧压片盒。曝光时间5min,取出压片盒中X光片投入自动洗片机中冲洗。进行半定量比较分析,并且均采用自身灰度值校正,以目的基因的条带灰度与管家基因β-actin的灰度比值表示蛋白的表达水平。
1.4 统计学方法 在100×的放大倍数下随机选取5个视野进行管道计数,并取平均值。数据采用均数±标准差表示,应用SPSS 17.0分析,Notch1和Dll4表达水平与细胞系管道形成能力采用Pearson相关性分析,检测水准α=0.05。
2 结果
2.1 胶质瘤细胞株管道形成能力观察 按照管道形成形态以及数量共分为三类(表1)。第一类为强管道形成细胞株组,为C6和U373细胞株。C6单个视野下(100×)的平均管道数(25.2±5.0)个,U373为(36.4±3.2)个。C6和U373细胞株形成的管道管壁光滑。这两株细胞围成的管道形状相对规则,大部分为圆形、椭圆形。每个闭合环状的连接处不仅仅只有伪足,更有细胞互相连接形成管道。细胞伸出的伪足数量明显减少,C6细胞株几乎不见有伪足伸出,而U373闭合环的连接处既有纤细伪足的连接,也有多个细胞相互连接构成(图1)。第二类为弱管道形成能力组,为U87、T98G细胞株。U87单个视野下(100×)的平均管道数(19.0±2.2)个,T98G为(12.6±2.4)个。U87、T98G细胞株形成的管道大小极不规则。这两株细胞在生长过程不断相互聚集,而且每个细胞伸出较多分支,形成毛刺样结构。U87细胞之间的连接似乎更为紧密,每个闭合环状的连接处的伪足更为粗壮。相比之下T98G的连接更为纤细,而且可以看到除了连接在一处的伪足,每个细胞还有其他未连接在一起的伪足伸出,形态极似神经元细胞的树突(图2)。第三类为无管道形成能力组,为SF295、U251和SKMG-4细胞株。SF295单个视野下(100×)的平均管道数(4.0±2.2)个,U251为(0.2±0.4) 个,SKMG-4为 0。SF295、U251和SKMG-4几乎没有管道形成。SF295的管道密度大大减少,几乎没有互相连接的闭合环,偶尔见到的少细胞生长的空洞区域也较小,中间能够见到多个细胞在空洞区域穿过,很难找到闭合环状结构。而U251和SKMG-4只能看到细胞平铺生长,随着细胞密度的增加而逐渐铺满培养皿,完全无典型的环状结构(图3)。
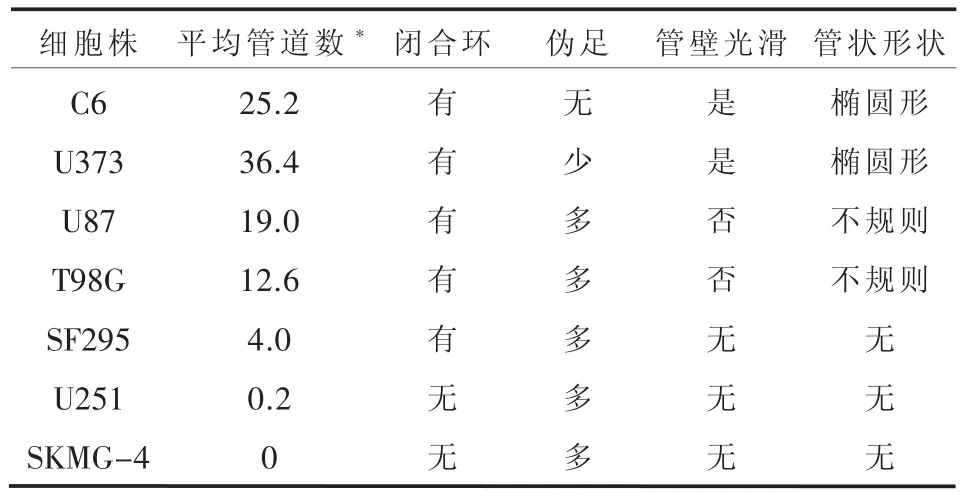
表1 胶质瘤细胞株形成管道能力
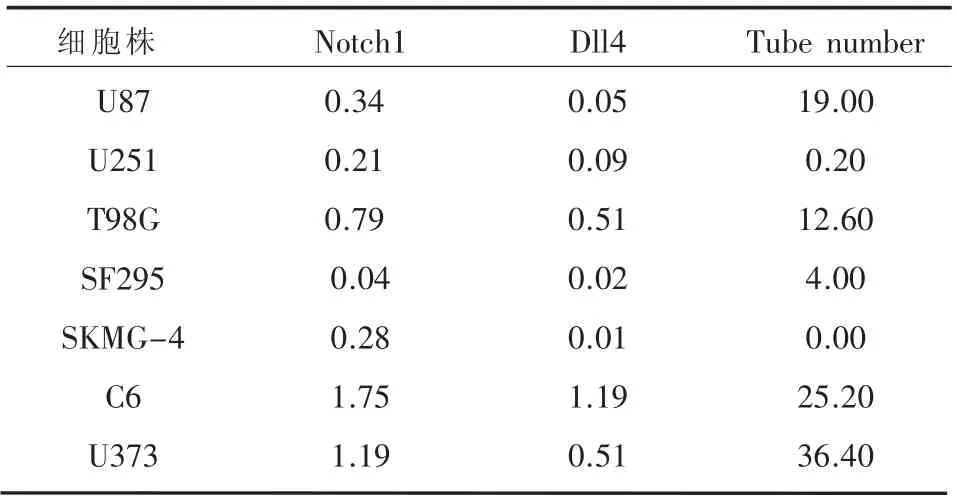
表2 不同细胞株管道形成数量以及Notch1 和Dll4蛋白表达相关密度
2.2 Notch1和Dll4的表达情况与胶质瘤细胞株管道形成能力的相关性分析 细胞株管道形成数量、Notch1和Dll4蛋白相对密度见表2。经Pearson相关性分析发现管道形成数量与Notch1表达的相关性较显著(r=0.778,P=0.019)。而管道形成数量与Dll4表达相关性不显著(r=0.635,P=0.062)。
3 讨论
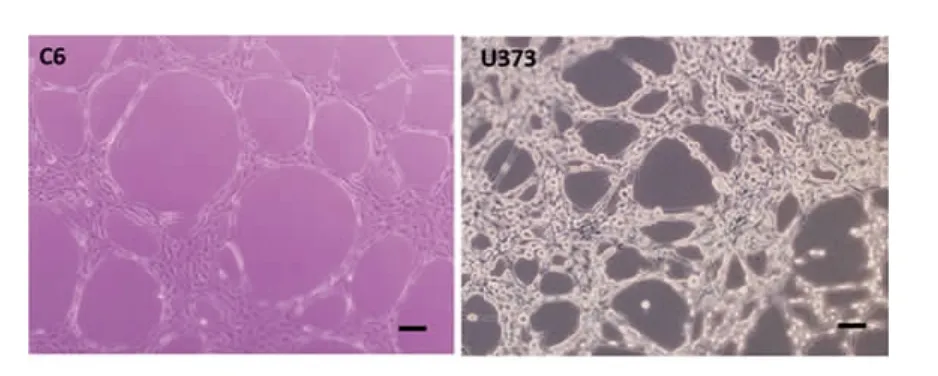
图1 C6和U373细胞株形成的管道管壁光滑。这两株细胞围成的管道形状相对更加规则,大部分为圆形、椭圆形。每个闭合环状的连接处不仅仅只有伪足,更有细胞互相连接形成管道。放大倍数×100,标尺50μm。

图2 U87、T98G细胞株形成的管道大小极不规则。这两株细胞在生长过程不断相互聚集,而且每个细胞伸出较多分支,形成毛刺样结构。放大倍数×100,标尺50μm。
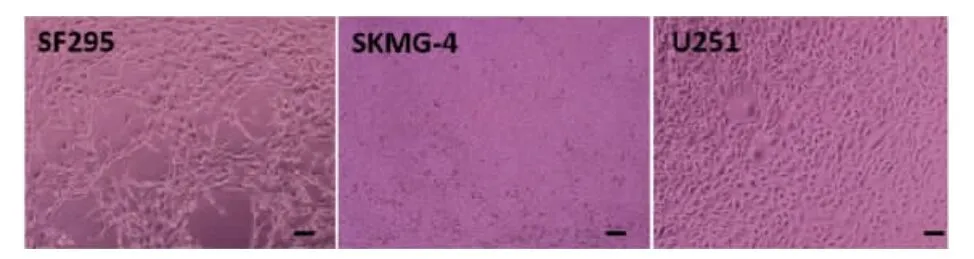
图3 SF295、U251和SKM G-4几乎没有管道形成。SF295的管道密度大大减少,几乎没有互相连接的闭合环。而U251和SKM G-4只能看到细胞平铺生长,随着细胞密度的增加而逐渐铺满培养皿,完全无典型的环状结构。放大倍数×100,标尺50μm。
抗胶质瘤血管新生治疗疗效一直不理想。有学者研究发现抗VEGF-A治疗时黑色素瘤细胞通过分泌HIF1α募集更多的肿瘤细胞来参与管道形成[9]。然而肿瘤细胞形成管道能力却大不相同。ZHU等[10]通过研究发现在肝癌细胞株中BEL-7402和HCCLM6具有管道形成能力,而HepG2却没有。BENEDITE等[11]提出Notch1调控的双重作用源于结合的配体不同。现在已经发现的主要Notch1的配体有:Delta-like 1 (Dll1),Dll3,Dll4, Jagged1和Jagged2。胶质瘤中主要表达Notch1,GBM、少突胶质细胞瘤和髓母细胞瘤也有Notch2表达。Dll4在Notch1的双重调控作用起了关键作用。Dll4能阻滞肿瘤血管成熟但在肿瘤血管新生过程中却表达上调。Notch1等通路如果作为抗血管治疗的靶点将会影响许多正常体细胞的功能,因为这些通路不仅在肿瘤细胞,在很多体细胞都是高表达状态。因此相对特异性的靶点才是靶向血管新生的治疗研究方向。
目前鲜有关于Dll4-Notch1通路与血管拟态之间关系的研究。本研究发现Notch1与血管拟态之间存在密切的关系。Notch1能促进肿瘤细胞表达内皮细胞标记物,同时形成管道样结构[12]。近来有学者的临床研究表明Dll4同样在胶质母细胞瘤中高表达。高表达的Dll4也促进了拟态血管的形成[13]。这与我们在体外实验得到的结论一致。
我们的研究初步发现能够形成平滑的环形管道的细胞株Notch1的表达水平相对也高。同样Dll4的表达也大致与Notch1的表达程度相同,这值得我们进一步研究Dll4-Notch1通路对GBM肿瘤细胞来源管道形成调控的深层机制。我们希望在拮抗肿瘤血管新生上找到特异性靶点,弥补现有对avastin治疗胶质瘤的不足。
[1]ZHANG D,SUN B,ZHAO X,et al.Twist1 expression induced by sunitinib accelerates tumor cell vasculogenic mimicry by increasing the population of CD133+cells in triple-negative breast cancer.Mol Cancer,2014,13:207.
[2]ZHANG S,LI M,GU Y,et al.Thalidomide influences growth and vasculogenic mimicry channel formation in melanoma.J Exp Clin Cancer Res,2008,27:60.
[3]ZHANG F,LIN H,CAO K,et al.Vasculogenic mimicry plays an important role in adrenocortical carcinoma.Int J Urol, 2016,23(5):371-377.
[4]SHIRAKAWA K,KOBAYASHI H,SOBAJIMA J,et al.Inflammatory breast cancer:vasculogenic mimicry and its hemodynamics of an inflammatory breast cancer xenograft model.Breast Cancer Res,2003,5(3):136-139.
[5]HESS AR,MARGARYAN NV,SEFTOR EA,et al.Deciphering the signaling events that promote melanoma tumor cell vasculogenic mimicry and their link to embryonic vasculogenesis:roleof the Eph receptors.Dev Dyn,2007,236(12):3283-3296.
[6]QIAO L,LIANG N,ZHANG J,et al.Advanced research on vasculogenic mimicry in cancer.J Cell Mol Med,2015,19(2): 315-326.
[7]SEFTOR RE,HESS AR,SEFTOR EA,et al.Tumor cell vasculogenic mimicry:from controversy to therapeutic promise.Am J Pathol,2012,181(4):1115-1125.
[8]CHEN YS,CHEN ZP.Vasculogenic mimicry:a novel target for glioma therapy.Chin J Cancer,2014,33(2):74-79.
[9]SCHNEGG CI,YANG MH,GHOSH SK,et al.Induction of Vasculogenic Mimicry Overrides VEGF-A Silencing and Enriches Stem-like Cancer Cells in Melanoma.Cancer Res,2015, 75(8):1682-1690.
[10]ZHU MS,XU LB,ZENG H,et al.Association of Notch1 with vasculogenic mimicry in human hepatocellular carcinoma cell lines.Int J Clin Exp Pathol,2014,7(9):5782-5791.
[11]BENEDITO R,ROCA C,SORENSEN I,et al.The notch ligands Dll4 and Jagged1 have opposing effects on angiogenesis.Cell, 2009,137(6):1124-1135.
[12]JUE C,LIN C,ZHISHENG Z,et al.Notch1 promotes vasculogenic mimicry in hepatocellular carcinoma by inducing EMT signaling.Oncotarget,2017,8(2):2501-2513.
[13]QIU XX,CHEN L,WANG CH,et al.The Vascular Notch Ligands Delta-Like Ligand 4 (DLL4)and Jagged1 (JAG1)Have Opposing Correlations with Microvascularization but a Uniform Prognostic Effect in Primary Glioblastoma:A Preliminary Study. World Neurosurg,2016,88:447-458.
The study on Notch1 pathway-related tubular formation of glioma cell lines.
ZHANG Qingping,MEI Xin,KE Chao,CHEN Yingsheng,CHEN Furong,CHEN Zhongping,CHEN Zhongping.Department of Neurosurgery/Neuro-oncology,Sun Yat-sen University Cancer Center,Guangzhou 510060,China.Tel:86-20-87343310.
Objective To explore the mechanism of the formation of glioma cells derived vessels(GCDV). Methods The tubular formation assay was performed on 3D cell cultures of U87,U251,U373,SF295,T98G,SKMG-4 and C6 glioma cell lines.The expression of Notch1、Dll4 were examined by western blot analysis.Result The mean number of vasculogenic channels of cell lines C6,U373,U87,T98G,SF295,U251 and SKMG-4 per area (100×)were 25.2±5.0,36.4±3.2,19.0±2.2,12.6±2.4,4±2.2,0.2±0.4 and 0,respectively.The relative protein densities of Notch1 in U87,U251,T98G,SF295,SKMG-4,C6 and U373 were 0.34,0.21,0.79,0.04,0.28,1.75 and 1.19,which were significantly related with the tubular formation ability (P<0.05).However,the expression of Dll4 was not associated with tubular formation ability (P>0.05).Conclusion Notch1 may play a key role in tubular formation of glioma cells while the role of Dll4 in the process needs further study.
Notch1 Glioma 3D cell culture Tubular formation
R331
A
2016-08-21)
(责任编辑:甘章平)
10.3969/j.issn.1002-0152.2017.02.011
☆国家自然科学基金 (编号:81372685);国家重点基础研究发展计划 (973计划)(编号:2015CB755505);广东省自然科学基金 (编号:S2013040012894);广东省科技计划项目(编号:2013B021800067,2016A02013004);深圳市科技创新委员会项目(编号:JCYJ20140416094330210);广东省医学科研基金(编号:A2014247)
* 深圳市南山区人民医院神经外科(深圳518033)
△中山大学肿瘤防治中心神经外科
※中山大学附属第八医院 深圳市福田区人民医院神经外科

