群体成员大小差异对不同生境鲤科鱼类集群行为的影响
吴 慧唐中华黄 清 况 璐 付世建
(重庆师范大学进化生理与行为学实验室, 重庆市动物生物学重点实验室, 重庆 400047)
群体成员大小差异对不同生境鲤科鱼类集群行为的影响
吴 慧*唐中华*黄 清 况 璐 付世建
(重庆师范大学进化生理与行为学实验室, 重庆市动物生物学重点实验室, 重庆 400047)
为研究群体成员大小差异对不同喜好生境鱼类集群行为特征的影响, 实验分别以鳊(Parabramis pekinensis)和中华倒刺鲃(Spinibarbus sinensis)幼鱼为实验对象, 比较分析4尾等大小(E)和不等大小(2大2小, NE)实验鱼群体的自发游泳速度、空间分布以及对恐吓刺激反应等集群行为参数的差异。结果显示: (1)和鳊相比, 中华倒刺鲃有更高的自发游泳速度、速度同步性和排列方向的极性, 但二者对恐吓刺激的反应率及反应的协调一致性相似; (2)当群体成员大小出现差异时, 两种鱼群体排列方向的极性不受影响, 且大小个体成员间的速度及其同步性均没有差异, 但整体的速度同步性与等大小群体相比有所下降; (3)个体间距离数据显示, 个体大小差异不会影响两种鱼群体的凝聚力; (4)群体成员在两种鱼群中偏好位置不同, 当群体成员大小不同时, 大个体成员更偏好占据领头鱼位置; (5)群体成员大小的差异导致两种鱼对刺激的反应率下降。研究表明: 中华倒刺鲃具有更高的活跃性、更好的群体运动的协调性, 可能与其流水生境相关; 当群体成员大小出现差异时, 成员不分大小在整体上协调运动的速度和方向, 并保持群体有较高的凝聚力, 但两种鱼类自发游泳速度调整策略截然不同(鳊大小个体速度妥协趋同, 而中华倒刺鲃低速个体速度提高); 群体成员大小差异导致鱼群对恐吓刺激的反应率有所下降, 可能原因包括体形差异导致的社会因素造成敏锐性下降、信息交流效率受阻和(或)集群收益代价出现分化影响一致决策的形成等。
鳊; 中华倒刺鲃; 凝聚力; 协调性; 群体位置; 刺激反应
集群行为在动物界中广泛存在, 据估计有多达万种以上的鱼类在其整个生活史或其生活史的某个阶段会出现集群行为[1,2]。集群行为通常表现为获取生存利益和增加竞争成本之间的权衡[3]: 一方面可能具有降低被捕食风险, 提高觅食效率等生态学收益[4—6]; 另一方面导致食物和配偶资源竞争加剧等不可避免的代价[7]。近二十年来, 硬骨鱼类的集群行为特征引起了行为生态学家的高度关注。相关研究发现鱼类集群行为特征的维系一定程度上通过个体对其近邻的位置和活动的反应来实现[8]。其中, 协调性和凝聚力是鱼群最重要的特征。群体不同成员间游泳速度的同步性和鱼群排列的极性是协调性的重要表征, 而个体间的距离反映了群体凝聚力一个指标。除此之外, 研究发现群体成员的位置尤其是领头个体获取的生态收益和代价可能与其他成员存在较大差异, 对集群运动也可能产生重要的影响[9]。
群体表型组成是指群体中不同个体成员形态大小、行为和(或)生活史等特征的异同, 具有重要的生态和社会学意义[5,10]。就群体中个体的大小差异而言, 研究发现在自然选择压力下, 表型趋同群体和表型趋异群体均有存在, 具体影响因素和行为学机制尚未明晰[11—13]。在理论上, 群体成员的个体大小不同, 在群体中的生态学收益和代价不同, 在集群行为中发挥的作用各异。群体成员大小对集群行为的协调性和凝聚力, 以及不同个体在集群中的位置也有影响。另外, 鱼类生境水流状况差异巨大, 集群行为本身对不同水流生境偏好的鱼类的生态学意义不同, 大小的差异对集群的影响也可能不同。因此, 本研究的目标是探讨群体成员大小差异对集群行为特征的影响及探讨这种差异在不同生境偏好种类之间是否具有普遍性。为完成本研究目标, 我们以喜好静水的鳊(Parabramis pekinensis)和喜好流水的中华倒刺鲃(Spinibarbus sinensis)幼鱼为研究对象, 观察比较不同生境偏好鱼类的集群行为特征。实验过程中用4尾鱼组成鱼群(以往研究发现鲤科鱼类4尾鱼聚集时会出现典型的集群行为)[14], 获取两个种类的4尾等大小和不等大小的鱼群的运动轨迹, 进而分析不同群体的群体结构及其行为差异。鉴于集群行为最重要的作用之一是防御捕食者, 而集群成员的个体大小对其被捕食的风险可能有重要影响, 我们同时测定和分析了两种鱼不同群体组成对模拟恐吓刺激的反应。
1 材料与方法
1.1 实验鱼来源及驯化
实验鳊和中华倒刺鲃幼鱼购于重庆当地养殖场, 在实验室自净化循环控温水槽中适应性驯养2周。水温控制为(25±0.5)℃, 溶氧不低于90%饱和溶氧(>7.0 mg/L)。驯养期间每日用通威156商业浮性饲料[通威集团有限公司, 中国、四川、成都, 组成: 蛋白质(41.2±0.9)%、脂质(8.5±0.5)%、碳水化合物(25.7±1.2)%、灰分(12.3±0.4)%]饱足投喂一次,投喂1h后用虹吸管清理残余饲料和粪便, 日换水量约为水体总量的10%。光周期为12L:12D。驯养2周后挑选身体健康的鳊和中华倒刺鲃幼鱼各64尾作为实验对象。所有实验对象实验前均禁食24h。
1.2 实验方案与操作方法
根据个体大小和种类将实验对象分为4个实验组, 每组8个重复。分别为: 鳊(等大小4尾, CB-E)、鳊(2尾大鱼+2尾小鱼, CB-NE)、中华倒刺鲃(等大小4尾, QB-E)、中华倒刺鲃(2尾大鱼+2尾小鱼, QB-NE)(表 1)。随后分别放入实验室自制圆形行为观察设备(直径100 cm, 高度20 cm); 为避免实验鱼的垂直方向的移动, 实验水深设为10 cm[15], 用 Logitech Pro 9000高清摄像头(罗技中国科技有限公司,中国、苏州, 像素: 200万)连续拍摄15min (30 帧/s),随后在观察设备侧壁固定的位置以手腕为支点划弧线敲击3次模拟恐吓刺激, 每次刺激间隔约20s。
拍摄视频用格式化工厂(http://format-factory. softonic.cn)软件将图像由.wmv转换为.avi格式, 随后导入图像自动跟踪软件idTracker对图像进行分析[16], 获得每尾实验鱼拍摄期间每帧的运动轨迹,得到每尾鱼每帧图像的像素坐标点。
1.3 实验参数计算
据像素和实物的相对大小转化为实验鱼实际位置(cm)的坐标点。随后进行自发游泳速度和空间位置特征的相关计算。为消除转运的影响, 相关统计数据仅采用6—15min的轨迹数据。
等大小实验组随机选取1尾鱼作为焦点鱼(Focal fish), 不等大小实验组的大、小个体各随机选取1尾鱼作为焦点鱼。仅对焦点鱼的自发游泳速度和空间分布参数进行统计。由于鳊和中华倒刺鲃不等大小组均有一视频损坏, 因此重复为7。有关焦点鱼相关参数计算公式如下
自发游泳速度(cm/s):

x(t)和y(t)分别为焦点鱼在t时刻的横、纵坐标点, dt为每帧图像的时间间隔
速度的异质性(%):

vfocalfish为焦点鱼自发游泳速度, vgroup为群体所有鱼(等大小组)或大(小)鱼(不等大小组)的平均自发游泳速度。
个体间距离(cm):
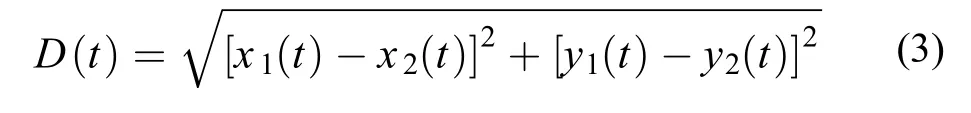
x(t)和y(t)分别为焦点鱼和计算距离的另一尾鱼在t时刻的横、纵坐标点。
为了进一步考察集群性和个体大小对群体结构的影响, 我们在每分钟选取36帧图像(2%), 逐帧观察群体中不同个体运动方向和焦点鱼处于群体最前方的次数, 得到群体排列的极性(P, %)和焦点鱼位于领头者比例(Lp, %), 其计算公式如下:
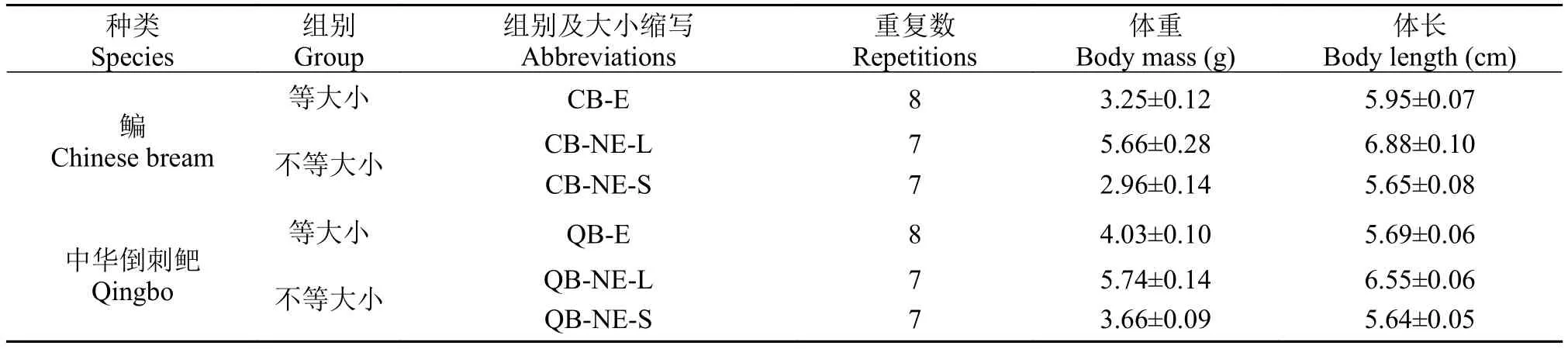
表 1 不同实验组组别及其鱼体大小(平均值±标准误)Tab. 1 The weight and length of fish under different treatments (Mean±SE)

实验鱼对恐吓刺激的反应参数通过人工观测视频得到, 反应率(R, %)和反应的一致性(C, %)的计算公式如下:

对刺激展现相同行为指该群体所有鱼都对刺激均有反应或者均没有反应。
1.4 实验数据统计分析
实验数据采用SPSS17.0(SPSS Inc, Chicago, IL, USA)进行统计分析。种类和大小对自发游泳速度、空间分布以及对刺激反应的相关数据采用双因素方差分析, 如差异显著采用Duncan多重比较或t检验分析各大小处理或种类间的统计差异; 实验焦点鱼处于领头鱼的比例与预期比例的差异采用非参数统计的二项式检验。所有数据结果均以平均值±标准误(Mean±SE)表示, 显著水平定为P<0.05。
2 结果
2.1 个体大小差异对两种鱼群自发游泳速度的影响
频率分布: 对于鳊, 无论等大小(E)组还是不等大小(NE)组的大个体和小个体鱼(NE-L和NE-S), 其自发游泳速度最高频率均出现在0—5 cm/s, 其次是0和5—10 cm/s(图 1)。对于中华倒刺鲃, 各组自发游泳速度最高频率均出现在5—10 cm/s, 但E组自发运动的出现频率依次是5—10、0—5和10—15 cm/ s, 而NE组(无论NE-L还是NE-S)依次是5—10、10—15和0—5 cm/s。
自发游泳速度: 鳊自发游泳速度显著小于中华倒刺鲃(P<0.05)(图 2A、表 2); 二者E组、NE组的NE-L和NE-S间的自发速度均无显著差异。
速度的异质性: 无论E, NE-L还是NE-S, 鳊的速度异质性均显著大于中华倒刺鲃(P<0.05, 图 2B);两种鱼E组的速度异质性均显著小于NE的NE-LL、NE-S-S和NE-L-S (P<0.05)。
2.2 个体大小差异对两种鱼群空间分布的影响
频率分布: 无论个体大小, 鳊个体间距离多出现在0—15 cm, 中华倒刺鲃个体间距离多出现在0—20 cm。鳊E和NE所有个体间距离的出现频率均依次为5—10、0—5和10—15 cm。中华倒刺鲃E和NE组的L-L、L-S距离出现最高频率前两档依次为5—10和10—15 cm, 而NE组S-S间距离最高频率前两档依次为5—10和0—5 cm(图 3)。

图 1 鳊和中华倒刺鲃的等大小(E)组和不等大小(NE)组的自发游泳速度分布频率(平均值±标准误; E组: N=8, NE组: N=7)Fig. 1 The effect of fish size on the frequency of spontaneous swimming velocity of Chinese bream and Qingbo (Mean±SE; equal size group: N=8, non-equal size group: N=7)
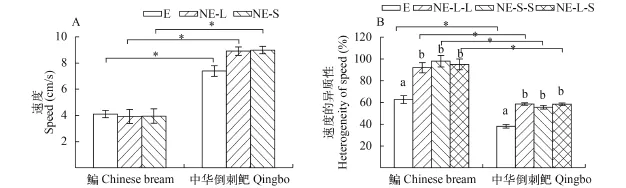
图 2 鱼群个体大小差异对鳊和中华倒刺鲃的自发游泳速度及个体间速度异质性的影响(平均值±标准误; E组: N=8, NE组: N=7)Fig. 2 The effects of fish size on the spontaneous swimming speed and heterogeneity (Mean±SE; equal size group: N=8, non-equal size group: N=7)*表示同一大小处理不同种类间差异显著(P<0.05), a, b表示同一种类不同大小处理间差异显著(P<0.05); 下同* indicate a significant difference of same treatment between two species, a, b indicate a significant difference of different treatment within same species; the same applies below

表 2 种类和鱼群成员大小差异对实验鱼群体特征影响的双因素方差分析Tab. 2 The effects of fish species and size on shoaling behavior of two cyprinids based on a two-way analysis of variance (ANOVA)
个体间距离: 鳊个体间的距离不受个体大小影响,而中华倒刺鲃NE组的S-S间距离显著小于E组个体间的距离及NE组L-L间距离(P<0.05)(图 4A)。另外,鳊E组的距离显著小于中华倒刺鲃E组(P<0.05)。
群体排列极性: 鳊群体排列极性总体上显著小于中华倒刺鲃(P<0.05; 图 4B, 表 2); 个体大小对鳊和中华倒刺鲃群体排列的极性没有显著影响。
2.3 个体大小差异对两种鱼群群体位置(处于领头鱼位置的比例)的影响
E群体: 对于鳊, 8个群体随机选择的焦点鱼仅有1尾处于领头鱼位置的比例与预期概率(即25%)无显著差异(图 5), 其余均显著大于(2尾)或小于(5尾)预期概率(P<0.05)。对于中华倒刺鲃, 仅有2尾与预期概率无显著差异, 其余均显著大于(2尾)或小于(4尾)预期概率。
NE群体: 对于鳊, 7尾大个体中2尾处于领头鱼位置比例与预期概率无显著差异, 3尾大于预期, 2尾小于预期(P<0.05); 而小个体1尾大于预期, 其余6尾均小于预期。对于中华倒刺鲃, 7尾大个体中2尾无显著差异, 3尾大于预期, 2尾小于预期; 7尾小个体中2尾无显著差异, 2尾大于预期, 3尾小于预期(P<0.05)。
2.4 个体大小差异对两种鱼群恐吓刺激反应的影响
反应率: 种类对刺激反应率没有显著影响(图
6A), 但二者E组的反应率均显著大于NE组总体反应率或大、小个体(即NE-L和NE-S)的反应率, 而
NE-L和NE-S的反应率没有显著差异(P<0.05); 中华倒刺鲃的E组和NE-L的反应率无显著差异。反应一致性: 鳊反应的一致性总体上大于中华倒刺鲃,
但是统计分析二者的E组和NE组反应的一致性均无显著差异(图 6B)。
3 讨论
3.1 鳊和中华倒刺鲃等大小鱼群群体特征的差异

图 3 鳊和中华倒刺鲃不同实验处理组个体间距离的分布频率(平均值±标准误; E组: N=8, NE组: N=7)Fig. 3 The distribution of the distance between different treatment group in Chinese bream and Qingbo (Mean±SE; equal size group: N=8, non-equal size group: N=7)

图 4 鱼群大小差异对鳊和中华倒刺鲃个体间距离及群体方向排列极性的影响(平均值±标准误; E组: N=8, NE组: N=7)Fig. 4 The effects of fish size on the distance between individuals and polarity of alignment in Chinese bream and Qingbo group (Mean±SE; equal size group: N=8, non-equal size group: N=7)
协调性和凝聚力: 就E鱼群而言, 鳊自发游泳速度仅为中华倒刺鲃的50%左右, 且鳊偏好的自发游泳速度为0—5 cm/s而中华倒刺鲃为5—10 cm/s, 表明后者有更高的活跃性。研究发现鳊群成员的自发游泳速度异质性高于中华倒刺鲃, 表明后者运动时自发游泳速度有更高的同步性和协调性。另外,群体运动在方向上的协调性指标-排列极性的数据也显示鳊低于中华倒刺鲃。这可能与两种鱼类喜好生境和社群内部结构有关[17]。一方面, 鳊喜好静水生境而中华倒刺鲃偏好流水生境, 显然自然选择要求后者有更高的活跃性和更好的集群游泳的协调性。另一方面, 鳊比中华倒刺鲃有更高的好斗性,也可能是导致其协调性下降的重要原因之一[18]。鱼群个体间的距离是凝聚力的指标, 一般认为偏好集群种类有较高的协调性和凝聚力。本研究却发现鳊个体间距离低于中华倒刺鲃, 这可能是因为后者的自发游泳速度较高, 为了避免个体间的碰撞,个体间的距离有增大趋势[19]。以往研究发现鱼群个体间距离与速度成正比[14], 因此, 我们认为衡量群体凝聚力应该综合考虑游泳速度的因素而非简单以距离衡量。

图 5 不同鳊和中华倒刺鲃鱼群焦点鱼处于领头鱼比例(E组: N=8, NE组: N=7)Fig. 5 The percentage of group leader of Chinese bream and Qingbo groups by fish size (equal size group: N=8, non-equal size group: N=7)*表示与预期值(即25%)差异显著(P<0.05)* indicate a significant difference between actual and theoretical value (25%)
空间分布和恐吓刺激反应: 虽然E鱼群个体间体形差异非常小, 本研究却发现随机选择的8尾鳊和中华倒刺鲃焦点鱼分别仅有1和2尾处于领头鱼的位置符合预期概率(即25%)。这表明即使体形差异不大, 鳊和中华倒刺鲃鱼群中不同个体的空间分布并非随机, 个体占据鱼群的位置可能与个体生理状况(如游泳能力)和个性行为特征差异(如勇敢性)有关[20—22]。值得一提的是本实验发现鳊和中华倒刺鲃对恐吓刺激的反应率和反应一致性均较高,且没有差异。反应率一定程度上反应了鱼类对外界刺激的敏锐性, 而反应的一致性可能更多的体现鱼群中成员运动和行为决策协调的一致性以及个体间信息交流是否通畅[23]。本实验发现鳊和中华倒刺鲃有较高的刺激反应敏锐性和行为决策协调一致性, 其是否为鲤科鱼类的共有特征值得进一步研究, 但显然这些特征有利于其在自然界条件下成功逃避捕食者的追击。
3.2 成员个体大小差异对两种鱼群集群特征的影响
协调性: 本研究发现鳊NE鱼群自发游泳速度与E鱼群没有差异, 而中华倒刺鲃却有所提高。这从偏好自发游泳速度分布频率也能看出, 即鳊两种类型鱼群的自发游泳速度频率分布趋势相同, 而中华倒刺鲃E鱼群依次是5—10、0—5和10—15 cm/s,而NE鱼群依次是5—10、10—15和0—5 cm/s。原因可能是鳊自发游泳速度总体偏低、个体间自发游泳速度的异质性较高, 而中华倒刺鲃相反。因此,个体大小的差异对前者自发游泳速度的影响不明显而对后者影响较大。但一般来说, 鱼类的自发游泳速度随个体增大而上升, 但两种鱼类NE鱼群中NE-L和NE-S间的自发游泳速度均没有差异, 因此出现这种变化的原因更可能是鱼群为了保持群体运动的协调性, 群体成员会改变个体的特性与群体保持一致[24]。但中华倒刺鲃成员间自发游泳速度的协调倾向于游泳能力较低的小个体提高其自发游泳速度从而保持群体的一致性, 鳊大小个体在自发游泳速度上互相妥协以达到群体运动的协调一致性。即不同的鱼类可能采取不同的策略保持群体运动的协调性, 这是本研究的重要发现之一, 是否与其生境条件相关联还有待进一步研究。研究还发现, 对于群体运动方向的协调性指标-排列极性不受鱼群成员大小差异影响, 这进一步说明不同大小个体在运动方向上高度协调。研究还发现两种鱼类的NE鱼群自发游泳速度异质性均有所下降,可能是时滞等因素造成速度调整的精确程度低于方向所致。有趣的是, 无论鳊还是中华倒刺鲃, 大小个体(NE-L-S)间的自发游泳速度异质性与L-L和S-S间没有显著差异, 这进一步说明无论不等大小鱼群的大个体和小个体成员, 都更倾向于作为整体协调运动而不会出现体形大小个体分化的现象。

图 6 不同种类的大小实验鱼对恐吓刺激的反应率及其一致性(平均值±标准误; E组: N=8, NE组: N=7)Fig. 6 The response ratio and its conformity to frighten stimulus of Chinese bream and qingbo group with different size (Mean±SE; equal size group: N=8, non-equal size group: N=7)
凝聚力和空间分布: 与E鱼群相比, NE鳊鱼群个体间距离没有显著变化, 而NE中华倒刺鲃鱼群小个体间距离显著下降。这可能是因为中华倒刺鲃自发游泳速度较高, 为避免运动中的干扰(如碰撞), 其距离变化与群体凝聚力无关而更多的体现为体长变化的结果(详见讨论第一部分)。无论如何, 由于NE鱼群的距离并没有大于E群体, 说明至少在本实验范围内群体成员大小的差异并不会降低鳊和中华倒刺鲃鱼群的凝聚力。另外, 在本研究中鳊和中华倒刺鲃NE组大个体处于领头鱼位置的概率高于小个体, 说明鱼群中较大的个体更易占据领头位置, 成为群体的领导者, 这与以往的研究结果一致[25]。
恐吓反应: 无论鳊还是中华倒刺鲃, NE鱼群对恐吓刺激的反应率都显著低于E鱼群组, 其机制值得进一步研究。首先, 大小个体间的社群等级等因素的影响造成个体获取外界信息的能力下降可能是因素之一[26]。但鉴于鱼群的凝聚力和协调性等受群体成员大小差异影响很小, 群体成员大小差异对反应的敏锐性的影响应该不是主要因素。其次,大小个体间信息交流效率的下降也可能是因素之一, 如数值上来看中华倒刺鲃NE鱼群大小个体间(NE-L-S)反应一致性有所下降, 而大个体(NE-LL)和小个体(NE-S-S)内部之间反应的一致性没有下降。然而鳊E和NE鱼群不同个体间反应的一致性均没有变化, 这说明可能存在信息交流外的因素。如不同大小个体在集群条件下其生态收益和代价不同, 如大(或小)个体相对不易被捕食, 在恐吓刺激下倾向于不做出反应以节约能量用于其他生理活动或生态行为, 而小(或大)个体为保持集群状态而与其他个体做出一致反应。无论如何, 这种反应率的下降不可避免导致NE鱼群逃避敌害的能力的下降, 这可能是鱼类偏好与同等大小的鱼类集群的原因之一[11,27]。另外, 鳊的NE鱼群反应的一致性总体上大于中华倒刺鲃, 可能是前者自发游泳速度较低,个体间距离较近, 信息传播较快等原因所致。
总之, 中华倒刺鲃比鳊具有更高的活跃性和集群运动的协调性, 这可能与二者喜好生境(静水vs.流水)和好斗性的强弱有关。当鱼群成员间个体大小出现差异时, 鱼群的凝聚力不会下降, 且在整体上协调运动的方向和速度, 不会出现大个体内部和小个体内部的分化。其中方向上的调整更为有效(E和NE鱼群没有差异), 而速度调整导致同步性有所下降, 且大小个体速度不同时速度调整的策略不一致(中华倒刺鲃倾向于最高游泳速度而鳊表现为相互妥协)。无论鳊还是中华倒刺鲃, 大个体均有更多的几率占据在鱼群的前方。另外两种鱼不等大小鱼群反应率有所下降, 可能原因包括不等大小导致的社会因素造成敏锐性下降、信息交流效率和(或)集群收益代价出现分化影响一致决策的形成等。
[1]Victoria L P, James L, Roger K B, et al. Shoal choice in zebrafish, Danio rerio: the influence of shoal size and activity [J]. Animal Behavior, 2001, 62(6): 1085—1088
[2]Ward A J, Axford S, Krause J. Mixed-species shoaling in fish: the sensory mechanisms and costs of shoal choice [J]. Behavioral Ecology Sociobiology, 2002, 52(3): 182—187
[3]Hoare D J, Krause J, Peuhkuri N, et al. Body size and shoaling in fish [J]. Journal of Fish Biology, 2000, 57(6): 1351—1366
[4]Killen S S, Fu C, Wu Q Y, et al. The relationship between metabolic rate and sociability is altered by food deprivation [J]. Functional Ecology, 2016, 30(8): 1358—1365
[5]Rodgers G M, Downing B, Morrell L J. Prey body size mediates the predation risk associated with being “odd”[J]. Behavioral Ecology, 2015, 26(1): 242—246
[6]Thünken T, Eigster M, Frommen J G. Context-dependent group size preferences in large shoals of three-spined sticklebacks [J]. Animal Behaviour, 2014, 90(1): 205—210
[7]Cote J, Fogarty S, Sih A. Individual sociability and choosiness between shoal types [J]. Animal Behaviour, 2012, 83(6): 1469—1476
[8]Herbert-Read J E, Krause S, Morrell L J, et al. The role of individuality in collective group movement [J]. Proceedings of Royal Society: Biological Sciences, 2012, 280 (1752): 20122564
[9]Jennifer E S, Sergey G, Monique B M, et al. Leadership in mammalian societies: emergence, distribution, power, and payoff [J]. Trends in Ecology and Evolution, 2016, 31(1): 54—66
[10]Farine D R, Montiglio P O, Spiegel O. From Individuals to groups and back: the evolutionary implications of group phenotypic composition [J]. Trends in Ecology and Evolution, 2015, 30(10): 609—621
[11]Ranta E, Juvonen S K, Peuhkur N. Further evidence for size-assortative schooling in sticklebacks [J]. Journal of Fish Biology, 1992, 41(4): 627—630
[12]Peuhkuri N, Ranta E, Seppa P. Size-assortative Schooling in Free-ranging Sticklebacks [J]. Ethology, 1997, 103(4): 318—324
[13]Jones K A, Croft A P, Ramnarine I W, et al. Size-assortative shoaling in the guppy (Poecilia reticulata): the role of active choice [J]. Ethology, 2010, 116(2): 147—154
[14]Fu S J, Nie L J, Wu H, et al. The effect of group size on school structure in juvenile black carp [J]. Acta Ecolo-gica Sinica, 2016, 36(19): 6062—6070 [付世建, 聂利娟,吴慧, 等. 群体大小对青幼鱼群体特征的影响. 生态学报, 2016, 36(19): 6062—6070]
[15]Hoare D J, Couzin I D, Godin J G J, et al. Context-dependent group size choice in fish [J]. Animal Behavior, 2004, 67(1): 155—164
[16]Perez-Escudero A, Vicente-Page J, Hinz R C, et al. idTracker: tracking individuals in a group by automatic identification of unmarked animals [J]. Nature Methods, 2014, 11(7): 743—748
[17]Miller N, Gerlai. From schooling to shoaling: patterns of collective motion in zebrafish (Danio rerio) [J]. PloS One, 2012, 7(11): 1—6
[18]Sybille H, Stefan F, Barbara T. Territorial aggression reduces vigilance but increases aggression towards predators in a cooperatively breeding fish [J]. Animal Behaviour, 2016, 113(1): 229—235
[19]Katz Y, Tunstrøm K, Ioannou C C, et al. Inferring the structure and dynamics of interactions in schooling fish [J]. Proceeding of the National Academy of Sciences, 2011, 108(46): 18720—18725
[20]Harcourt J L, Ang T Z, Sweetman G, et al. Social feedback and the emergence of leaders and followers [J]. Current Biology, 2009, 19(3): 248—252
[21]Nakayama S, Johnstone R A, Manica A. Temperament and hunger interact to determine the emergence of leaders in pairs of foraging fish [J]. PloS One, 2012, 7(8): e43747
[22]Burns A L, Herbert-Read J E, Morrell L J, et al. Consistency of leadership in shoals of mosquitofish (Gambusia holbrooki) in novel and in familiar environments [J]. PloS One, 2012, 7(5): e36567
[23]Brown C, Laland K N. Social learning of a novel avoidance task in the guppy: conformity and social release [J]. Animal Behaviour, 2002, 64(1): 41—47
[24]Herbert-Read J E, Perna A, Mann R P, et al. Inferring the rules of interaction of shoaling fish [J]. Proceedings of the National Academy of Sciences, 2011, 108(46): 18726—18731
[25]Pitcher T, Magurran A, Winfield I. Fish in larger shoals find food faster [J]. Behavioral Ecology and Sociobiology, 1982, 10(2): 149—151
[26]Abbott J C, Dunbrack R L, Orr C D. The interaction of size and experience in dominance relationships of juvenile steelhead trout (Salmo gairdneri) [J]. Behaviour, 1985, 92(3/4): 241—253
[27]Krause J, Godin J J. Shoal choice in the banded killifish (Fundulus diaphanus, Teleostei, Cyprinodontidae): effects of predation risk, fish size, species composition and size of shoals [J]. Ethology, 1994, 98(2): 128—136
EFFECT OF BODY SIZE VARIATION OF GROUP MEMBERS ON SHOAL BEHAVIOR OF TWO CYPRINIDS PREFERRING DIFFERENT HABITATS
WU Hui*, TANG Zhong-Hua*, HUANG Qing, KUANG Lu and FU Shi-Jian
(Laboratory of Evolutionary Physiology and Behaviour, Chongqing Key Laboratory of Animal Biology, Chongqing Normal University, Chongqing 400047, China)
The phenotypic composition of groups affect ecological and social processes, which is crucial for collective behavior research. To explore the influence of body size variation on shoal behavior between two cyprinids with different habitats, the juvenile Chinese bream (Parabramis pekinensis) preferring still water and Qingbo (Spinibarbus sinensis) enjoying flowing water were selected to study spontaneous swimming behavior, spatial structure and the response to startling stimulus of fish groups including four similar fish individuals or including two larger and two smaller fish individuals. The results showed that the spontaneous swimming speed, the synchronization of speed and the alignment polarity of the juvenile Qingbo were significantly higher than those of Chinese bream, and that the responses to frighten stimulus were similar between two species. The polarities of equal-size groups were similar to those of non-equal groups while the non-equal groups showed lower synchronization of speed in both species. However, all measured variables were not different between large and small size individuals within non-equal size group. The difference in body size did not impact group cohesion. The larger individuals of heterogeneity in spatial structure preferred to stay at the front of fish shoal. The flow regime habitats of Qingbo may explain its higher activeness and synchronization of swimming speed and alignment polarity than Chinese bream. Group members with different body size can coordinate their swimming speed and direction of movements even with higher group cohesion. Interestingly, smaller Qingbo individuals elevated their speed to keep pace with larger individuals whereas Chinese bream individuals adjusted their speed to a moderate value. Variation of body size decreased the response ratio to frighten stimulus, possibly due to decreased response acuity to external stimulus as a consequences of social factor (e.g. social hierarchy), and impaired efficiency of information flow and (or) the divergence of ecological benefits and costs between larger and smaller size individuals, which subsequently influenced the consensus decision making.
Chinese bream; Qingbo; Cohesion; Coordination; Group position; Stimulus response
Q958.118
A
1000-3207(2017)03-0552-08
10.7541/2017.71
2016-05-11;
2016-10-07
国家自然科学基金(31670418); 国家级大学生创新创业训练计划项目(201510637020)资助 [Supported by the National Natural Science Foundation of China (No. 31670418); National Undergraduate Training Program of Innovation and Entrepreneurship (No. 201510637020)]
吴慧(1995—), 女, 四川资阳人; 本科; 研究方向为鱼类行为学。E-mail: 895186234@qq.com; 唐中华(1991—), 女, 四川南充人;硕士研究生; 研究方向为鱼类生理生态及行为学。E-mail: 1490912325@qq.com*共同第一作者
付世建, E-mail: shijianfu9@cqnu.edu.cn

