氟对雄性大鼠附睾组织形态学的影响
韩永利,张建海
(山西农业大学动物科技学院,山西太谷030801)
氟对雄性大鼠附睾组织形态学的影响
韩永利,张建海
(山西农业大学动物科技学院,山西太谷030801)
试验选取12周龄雄性Wistar大鼠48只,随机分为2组,其中,对照组大鼠饮用去离子水,处理组大鼠饮用含100 mg/L氟化钠的去离子水,染氟56 d后,取附睾组织,经Bouin′s固定液固定制作石蜡切片,进行组织切片形态学观察。结果发现,与对照组相比,处理组精子的排列方式由分散于整个附睾管变成集中于附睾管一端;附睾管内的上皮细胞出现了松散的现象,上皮变矮,胞质疏松;管腔内的精子空虚,主细胞之间的间隙明显增加,排列不精密。说明氟暴露会导致附睾管内精子的数量减少、附睾管形态发生改变,具体表现在附睾管上皮细胞由紧密排列变得松散、分裂。结果可为氟的生殖毒性研究与检测提供依据。
氟;附睾管;主细胞
氟中毒是一种严重危害人畜环境的化学性疾病,在动物中,主要以消瘦、骨骼牙齿损害为主[1]。近年来,越来越多研究表明,氟对雄性生殖系统具有重要作用[2-3],其研究主要集中于睾丸组织。还有研究表明,氟中毒可引起雄性动物附睾成熟精子超微结构改变[4]。附睾是雄性动物的重要生殖器官,具有生精和内分泌的功能,精子在睾丸的曲细精管中产生,但必须经过附睾才能渐渐成熟,附睾结构的完整与否直接或间接地影响精子是否成熟,从而影响雄性的繁殖能力及子代的健康。
本试验对处理组大鼠饮用含100 mg/L氟化钠的蒸馏水,染氟56 d后,取附睾组织,经Bouin′s固定液固定制作石蜡切片,进行组织切片形态学观察,主要研究氟对附睾的形态学变化,旨在为进一步研究氟对生殖系统的影响与检测提供依据。
1 材料和方法
1.1 试验材料
供验动物为普通级12周龄Wistar雄性大白鼠48只,由山西医科大学实验动物中心提供。
1.2 主要仪器及试剂
生物显微镜购自日本Olympus公司;生物组织包埋机(HY-BM1160)购自金华惠支仪器设备有限公司,生物组织切片机(RM2265)购自德国Leica公司;生物组织摊烤片机(YT-6C)购自湖北省孝感市亚光医用电子技术有限公司;氟化钠(NaF)购自天津市化学试剂三厂。冰醋酸(AR)、生理盐水、甲醛、苏木素、伊红、无水乙醇等均为实验室常规试剂。
1.3 试验方法
1.3.1 试验动物的分组及染毒12周龄Wistar雄性大白鼠48只,进行7 d适应性饲养后,根据体质量和活动相近程度随机分成对照组(大鼠自由饮用去离子水)和高氟组(大鼠饮用含质量浓度为100 mg/L的氟化钠(NaF)水(去离子水配制,自由饮用)),每组24只,进行分笼饲养,其处理条件如表1所示。

表1 试验动物分组及氟的处理条件
1.3.2 试验样品采集和前处理分别在大鼠染毒56 d后,每组随机抽取大鼠10只,运用代谢笼收集晨尿(24 h),4℃保存,用于氟含量测定,后称质量;然后,按100 g体质量0.7 mL腹腔注射20%乌拉坦麻醉,迅速剖开大鼠,取睾丸称质量后,37℃生理盐水心脏灌流,取附睾组织称质量,切取部分组织迅速固定;余下组织称质量后,分装,于-80℃冷冻备用。
1.3.3 大鼠生长发育情况观察染毒期间,随时观察动物的精神体态与生长发育状况,每天详细记录饮水和进食情况,每周称质量一次。染毒结束后,根据记录的各脏器湿质量,计算脏器系数。
脏器系数=脏器湿质量(g)/体质量(g)× 100%。
1.3.4 制作大鼠附睾的组织切片取出附睾组织后,放入Bouin′s固定液中,固定12 h后,直接放入70%酒精中,中间换液2~3次,洗去淡黄色苦味酸后,依次用80%,85%,90%,95%(2次),100%(2次)梯度酒精脱水,二甲苯透明,常规石蜡包埋。采用常规的HE染色,制作石蜡切片。之后在光学显微镜下观察附睾的组织结构和精子的排列、形态结构。
1.4 数据处理
采用GraphPad Prism 5软件进行数据统计,测定结果用平均数±标准差表示。差异显著性利用one-way analysis of variance(ANOVA)进行分析,*代表P<0.05差异显著,**代表P<0.01差异极显著。
2 结果与分析
2.1 大鼠生长发育情况和附睾脏器系数变化
由表2可知,在处理28 d后,与对照组相比,高氟组附睾脏器系数差异不显著;处理56 d后,与对照组相比,高氟组附睾脏器系数有下降趋势,但差异不显著。
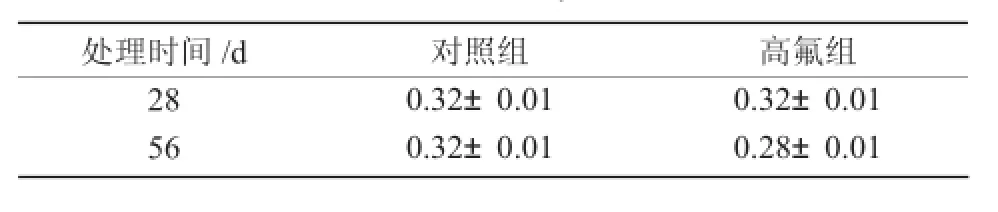
表2 雄性大鼠附睾脏体比值
2.2 大鼠睾组织的形态变化
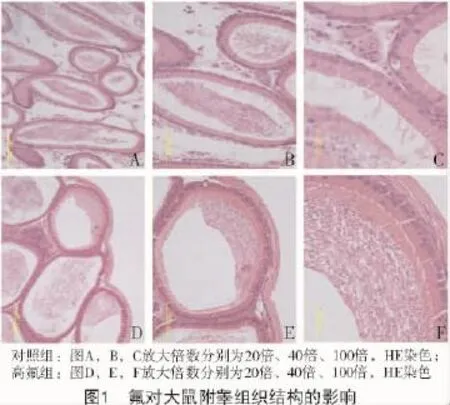
对照组大鼠附睾组织的形态如图1-A,B所示。在大鼠附睾管内的精子分布状况是分散存在于附睾管内,精子的排列不规范,精子在附睾管内清晰可见。如图1-C所示,观察附睾管的黏膜上皮表面光滑完整,可见主细胞紧密地排列在一起,主细胞呈高柱状,在主细胞的游离面有成簇的静纤毛,胞质红染,胞核圆。
高氟组大鼠附睾的组织形态如图1-D所示。附睾管内的精子排列与对照组相比发生明显的变化,其中,附睾管内的精子不均匀地排列在附睾管内,有向一侧集中的表现,说明可能附睾内的精子失去了运动能力,而附睾管内的上皮细胞出现了松散的现象,上皮变矮,胞质疏松,管腔内的精子空虚。如图1-E,F所示,主细胞之间的间隙明显增加,排列不精密、分开,主细胞游面的静纤毛消失,胞核的形状不规则,排列不整齐,有的核染色加深而小。
3 结论与讨论
氟的生殖毒性主要表现在精子生成障碍、精子数量下降[5]、精子活动率下降[6]和精子畸形率升高[7]。研究发现,工业性氟暴露会使人精子数量减少、精子活动力降低,且仅为同龄组健康人的50%或更低,说明氟对精子具有较明显的损伤作用[8]。氟可以进入附睾组织里,使附睾的血-附睾屏障缺失或损坏,并最终损害其精子的成熟和储存功能[9]。有研究发现,给大鼠饮用质量浓度为130 mg/L的氟化钠水,会导致染毒鼠精子数目下降、畸形率增高[10]。
附睾是哺乳动物精子成熟、获得受精能力[11-12]、储存和保护精子的重要器官,其具有血-附睾屏障和免疫屏障2个屏障作用[13]。附睾的免疫屏障和血-附睾屏障的缺失或损害,会导致精子及其功能受到伤害[14]。附睾是精子的储存场所,精子由睾丸运输到附睾后即开始储存,成熟后的精子获得了活动力和受精能力,然后储存在附睾尾和输精管内[15]。附睾具有内分泌功能,来自附睾的睾丸网液会产生很高的雄激素,附睾上皮本身也可以分泌少量的雄激素,它对精子的成熟与获能起重要作用。附睾具有多种糖蛋白,附睾管内的主细胞能分泌甘油磷酸胆碱、肉毒碱、抗氧化酶[16]以及多种酶,其与精子的生理功能、精子的成熟、精子的活力息息相关[17-18]。研究发现,附睾管头部对精子的成熟具有十分重要的作用[19]。
精子在附睾内的成熟过程包括获得了前向运动能力[17]、固着于透明带的能力和受精能力[20],附睾这一功能与主细胞密切相关。本试验通过大鼠染氟56 d对附睾的形态结构进行观察,结果表明,氟会对生殖系统造成危害,而关于氟是如何引起附睾的内部结构出现不同程度的损伤,以及氟是如何造成附睾内部主细胞的损伤,进而影响到精子在附睾内部成熟的具体机制还有待进一步研究。
[1]ZHANG J,LI Z,QIE M,et al.Sodium fluoride and sulfur dioxide affected male reproduction bydisturbingblood-testis barrier in mice [J].Food&Chemical Toxicology,2016,94:103-111.
[2]SUN Z,NIU R,WANG B,et al.Fluoride-induced apoptosis and gene expression profiling in mice sperm in vivo[J].Arch Toxicol,2011,85(11):1441-1452.
[3]KUMAR N,SOOD S,ARORA B,et al.Effect of duration of fluoride exposure on the reproductive system in male rabbits[J].J Hum Reprod Sci,2010,3(3):148-152.
[4]杨志强,王晓亚,曹鹏,等.氟对小鼠附睾中成熟精子超微结构的影响[J].中国畜牧兽医,2013,40(8):137-140.
[5]ZHANG J,ZHANG Y,LIANG C,et al.Choline supplementation alleviates fluoride-induced testicular toxicitybyrestoringthe NGF and MEK expression in mice[J].Toxicology&Applied Pharmacology,2016,310:205-214.
[6]HU L,YING J,MU L,et al.Fluoride toxicity in the male reproductive system[J].Fluoride,2009,42(4):260-276.
[7]HANH,SUNZ,LUOG,et al.Fluoride exposure changed the structure and the expressions of reproductive related genes in the hypothalamus-pituitary-testicular axis of male mice[J].Chemosphere,2015,135:297-303.
[8]CHINOY N J,MEHTA D,JHALA D D.Effects of different protein diets on fluoride induced oxidative stress in mice testis[J].Fluoride,2005,38(4):269-275.
[9]孙子龙,牛瑞燕,王俊东.氟对雄性小鼠生长发育及性腺中氟含量的影响[J].中国畜牧兽医,2012,39(3):227-229.
[10]甄炯,陈荣安,章孟本,等.氟化钠对雄性大鼠生殖系统影响的实验研究[J].工业卫生与职业病,2003,19(4):202-206.
[11]周宗瑶,王一飞.附睾精子成熟功能研究进展[J].生殖与避孕,2003,23(4):238-243.
[12]JONES R.Plasma membrane composition and organisation during maturation of spermatozoa in the epididymis[M]//The epididymis: from molecules to clinical practice.NewYork:Springer US,2002:405-416.
[13]张宗梁.附睾的免疫学研究[J].科学通报,2005,50(18):1935-1941.
[14]GUASTI P N,MONTEIRO G A,MAZIERO R R,et al.Pentoxifylline effects on capacitation and fertility of stallion epididymal sperm[J].Animal Reproduction Science,2017,179:27-34.
[15]乌亚罕.绵羊附睾GPx5基因表达调控的分子机制[D].呼和浩特:内蒙古农业大学,2016.
[16]EDITH A R,ADOLFO R G,EDITH C B,et al.Reactive oxygen species production and antioxidant enzyme activityduringepididymal spermmaturation in Corynorhinus mexicanus bats[J].Reproductive Biology,2016,16(1):78-86.
[17]王炜,朱伟杰,李菁,等.氯化镉对大鼠附睾结构及精子的影响[J].生殖与避孕,2007,27(5):310-313.
[18]栗瑞兰,张通,范晓梅,等.GPX5在成年绵羊附睾中的表达与蛋白定位[J].中国农业科学,2015,48(24):4989-4995.
[19]WANG A G,XIA T,CHU Q L,et a1.Effects of fluoride on lipid peroxidation,DNA damage and apoptosis in human embryo hepatocytes[J].Biomed Environ Sci,2004,17:217-222.
[20]黄崇.氟对雄性成年小鼠的生殖毒性作用及其机制研究[D].太谷:山西农业大学,2006.
Effect of Fluoride on Morphology of Epididymis in Male Rats
HANYongli,ZHANGJianhai
(College ofAnimal Science and VeterinaryMedicine,Shanxi Agricultural University,Taigu 030801,China)
The objective of this study was to explore the effect of fluoride on the histomorphology of epididymis in rats,and to provide the basis for the studyand detection offluoride toxicity.Forty-eight healthy12-week-old male Wistar rats were randomlydivided into two groups.The rats in the control group were drinking distilled water.The rats in the experimental group were drinking distilled water containing 100 mg/L sodium fluoride and exposed to fluoride for 8 weeks.Epididymis was made into paraffin sections by Bouin′s fixative fixed and observed tissue section morphology.The results showed that sperm focused on the epididymal tube end in the experimental group compared with the control group scattered throughout the epididymal tube.Epithelial cells in the epididymal tube was loose,epithelial was dwarf and cytoplasm was loose.There was a little sperm in the tube.The gaps between the main cells were significantly increased.The results suggested that the number of sperm in the epididymal tube was reduced and epididymal tube shape was changed.The shape ofepithelial cells in the epididymal tube became closelyintoloose and split.
fluoride;epididymal tube;chiefcell
10.3969/j.issn.1002-2481.2017.05.18
R995;S865.1+2
:A
:1002-2481(2017)05-0743-03
2017-03-06
国家自然科学基金项目(面上项目)(31172380)
韩永利(1989-),男,内蒙古包头人,在读硕士,研究方向:环境兽医学。张建海为通信作者。

