盐胁迫对狐尾藻种苗生理指标及吸附Pb(Ⅱ)的影响
胡 艺 陈成广 宋向楠 孙晓璐 徐赢仪 吴朝辉
(绍兴文理学院元培学院建筑工程系, 绍兴 312000)
盐胁迫对狐尾藻种苗生理指标及吸附Pb(Ⅱ)的影响
胡 艺 陈成广*宋向楠 孙晓璐 徐赢仪 吴朝辉
(绍兴文理学院元培学院建筑工程系, 绍兴 312000)
以狐尾藻种苗为研究对象,考察了不同盐度条件下其部分生理指标响应及对Pb2+的吸附能力。结果显示,盐度在4‰以上,叶绿素含量随盐度增加而呈下降趋势,但其丙二醛含量却逐渐上升,较高盐度会加剧对狐尾藻种苗体内细胞膜的氧化破坏。然而,在0.9‰~14‰范围内,随盐度的增加,POD比活力、SOD总活力、根系活力等均表现出先上升后下降的相似趋势。另外,狐尾藻种苗对营养液中Pb2+的吸附行为较符合伪二级动力学方程,其存在界面扩散、表面活性反应位点的离子交换、内扩散等三个过程,而且,水体的高盐度会削弱狐尾藻种苗对Pb2+的吸收能力。
盐胁迫;狐尾藻种苗;生理响应;铅;吸附动力学
我国城市化进程的加快及工业的迅猛发展,使得大量废水排入水体,造成的重金属污染已引起广泛的关注[1-3]。铅是一种常见的对人体肾脏及神经系统有毒害作用的重金属元素,含铅废水主要来源于冶金、金属加工、机械制造、化学药剂、石油加工、油漆颜料、纺织、电子等行业[4]。此外,受铅污染的水体还会对鱼类的代谢功能、生殖功能、抗氧化能力甚至整个种群动态造成不利影响[5]。因此寻找高效、廉价、环保的含铅废水治理技术已成为亟待解决的问题。
植物修复是已得到公认的一种环境污染治理方法,其中以水生植物的应用最为常见。已有研究表明,许多水生植物如水浮莲(PistiastratiotesL.)[6]、凤眼莲(Eichhorniacrassipes)[7]、龙须眼子菜(Potamogetonpectinatus)[2]、金鱼藻(Ceratophyllumdemersum)[8]、黑藻(Hydrillaverticillata)[9]等对水体中重金属离子有较强的去除能力。狐尾藻(Myriophyllumverticilatum)是一种多年生沉水植物,广泛分布于世界各地湖泊及水沟中,其根茎发达且对环境适应性较强,除了对水体中镉[10]、铅[11]等重金属离子有明显吸附外,常被推广应用于吸收氮、磷等营养元素以净化水质[12-14]。浙江省在绍兴市设立了河道狐尾藻治污试点,然而在试种过程出现了部分受污河道中狐尾藻种苗长势不佳的现象。袁龙义等[15]研究表明,不同盐度对沉水植物种子的胁迫有影响,一定程度上抑制了该种子的萌发。此外,崔润丽[16]指出,植物组织在盐胁迫下通过各种途径产生活性氧,而活性氧对植物内生物膜、蛋白质和核酸等功能分子有破坏作用。因此,本文主要研究不同盐度条件下狐尾藻种苗的部分生理指标响应及对重金属Pb2+的吸附能力,以期为开发利用狐尾藻治理含铅废水提供理论依据。
1 材料与方法
1.1 试验材料
试验于2015年7月-2016年6月在绍兴文理学院元培学院环境监测实验室进行。狐尾藻种苗购自浙江宝仔农业发展有限公司的狐尾藻种苗供应基地,购回后于实验室塑料水桶内采用霍格兰通用配方营养液[17]培养1周。之后,筛选长势良好,长度均一的狐尾藻种苗若干株,用自来水洗净,备用。实验中所用药品如NaCl、PbCl2等均为分析纯。
1.2 试验设计
1.2.1 狐尾藻种苗部分生理指标对盐度的响应
取6只1000mL烧杯,各加入400mL霍格兰营养液,用DDSJ-308A型电导率仪测定其盐度初始值,再向营养液中缓慢投加NaCl粉末并不断搅拌使其均匀溶解,以此对盐度进行调节,将烧杯中营养液的盐度分别调至0.9‰、2‰、4‰、7‰、10‰、14‰等6种水平,然后在每只烧杯内放入一株经筛选的狐尾藻种苗,并置于光照培养箱中,设定温度为25℃,相对湿度为60%,4盏21W日光灯提供照明,试验装置如图1。试验每隔3d更换一次营养液,培养25d后取样测定狐尾藻种苗的茎叶和根的干质量、根系活力、叶绿素含量、丙二醛含量、过氧化物酶(POD)和超氧化物歧化酶(SOD)活性等生理指标。每组试验平行条件下重复3次。

图1 试验装置图
1.2.2 狐尾藻种苗对Pb2+的吸附动力学研究
将一株狐尾藻种苗移植于400mL含10mg/LPb2+的霍格兰营养液中,并置于光照培养箱内,设定温度25℃,相对湿度60%,4盏21W日光灯照明,分别于5、10、20、30、40、60、120、150min时取样,测定其营养液中Pb2+的浓度。试验平行条件下重复3次。
1.2.3 盐胁迫对狐尾藻种苗吸附Pb2+的影响
取6只1000mL烧杯,各加入400mL含10mg/LPb2+的霍格兰营养液,并用NaCl分别调节其盐度至0.9‰、2‰、4‰、7‰、10‰和14‰,再在每只烧杯内放入一株经筛选的狐尾藻种苗,置于光照培养箱中,设定温度25℃,相对湿度60%,4盏21W日光灯照明。待吸附60min时取样,分别测定各烧杯中营养液的Pb2+浓度。每组试验平行条件下重复3次。
1.3 测定方法
试验后,狐尾藻种苗先用去离子水清洗,再剪取茎叶和根,并称其干重,然后测定各生理指标。其中,叶绿素含量用95%乙醇提取,并在波长665nm和649nm处以分光光度法[18]测定;丙二醛含量用硫代巴比妥酸比色法[18]测定;POD比活力用愈创木酚法[19]测定;SOD总活力用氮蓝四唑光化还原法[19]测定;根系活力用2,3,5-氯化三苯基四氮唑(TTC)显色法[20]测定。此外,用电感耦合等离子体发射光谱仪(MARS,Prodigyxp,USA)测定营养液中Pb2+浓度。
1.4 数据处理
采用Excel2003和SPSS19.0软件对实验数据进行统计分析,并利用Origin8.6进行图形处理。
狐尾藻种苗对Pb2+的吸附量qt和吸附率Rt计算公式如下:
(1)
(2)
式中,qt为狐尾藻种苗t时刻对Pb2+的吸附量,mg·g-1;Rt为狐尾藻种苗t时刻对Pb2+的吸附率,%;C0、Ct分别为初始、t时刻霍格兰营养液中Pb2+浓度,mg·L-1;V为霍格兰营养液的体积,mL;m为狐尾藻种苗茎叶和根的干重,g。
2 结果与分析
2.1 盐胁迫对狐尾藻种苗生理指标的影响
叶绿素含量的高低反映了植物光合作用的强弱,而丙二醛含量的多少则代表植物体内细胞膜损伤程度的大小[21]。不同盐度下狐尾藻种苗生理指标测定结果见表1。由表1可以看出,营养液盐度在0.9‰~4‰范围内,狐尾藻种苗茎叶的叶绿素含量随盐度增加而逐渐上升,这可能是因为盐度的增加使得种苗叶肉细胞脱水、体积减小,导致叶绿素含量相对变大。但随盐度的继续升高,叶绿素含量则呈现下降的趋势,这应该是由于盐胁迫下的狐尾藻种苗茎叶内离子含量高,叶绿素和叶绿素蛋白的结合度低,使更多的叶绿素被解离出来所致。此外,营养液盐度在4‰以下,狐尾藻种苗体内的丙二醛含量随盐度的增加呈先上升后下降的现象,说明其能进行自身调节以适应外界环境盐度的变化。然而,盐度的继续升高促使狐尾藻种苗在叶绿体和线粒体内产生了更多的氧自由基,加剧了对其细胞膜的氧化破坏,最终导致丙二醛含量的急剧上升,这也解释了营养液盐度在14‰时,狐尾藻种苗体内丙二醛含量高达0.292±0.054μmol·g-1的原因。
POD、SOD是活性氧清除系统中能发挥作用的抗氧化酶[22-23],而根系活力是一种能客观反映根系的吸收、合成、氧化和还原等生命活动能力的生理指标[24]。从表1还可以发现,随营养液盐度的增加,POD比活力、SOD总活力、根系活力等生理指标均表现出先上升后下降的相似趋势。这说明营养液盐度在0.9‰~7‰范围内,狐尾藻种苗通过提高体内POD和SOD等活性来清除氧自由基,以增强细胞膜在盐胁迫下的抗氧化能力,同时合成的营养物质也多,促进根系生长,导致根系活力较高。但是,当盐度在7‰以上时,过多的氧自由基使POD和SOD的活性受到强烈抑制,且遭受不可逆的破坏,狐尾藻种苗自身防御能力减弱,尤其在盐度为14‰时,其根系活力仅为0.050±0.007mg·(g·h)-1,植株新陈代谢也受到严重损伤。
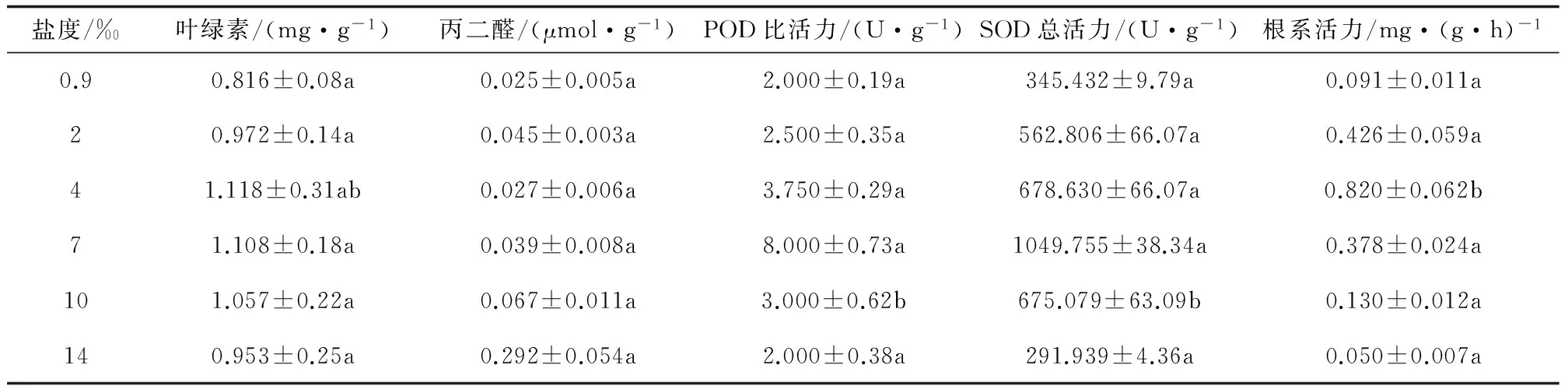
表1 盐度对狐尾藻种苗生理指标的影响
注:表中数据均为平行的均值±标准差,不同小写字母表示在P=0.05水平上差异显著。
2.2 狐尾藻种苗对Pb2+吸附动力学研究
图2反映了狐尾藻种苗对营养液中Pb2+的吸附量与吸附时间的关系。由图2可知,狐尾藻种苗对Pb2+呈正吸附,吸附量随时间延长先呈上升趋势,后逐渐趋于平衡。40min之前Pb2+吸附增量明显,60min之后吸附量基本稳定,故后续试验取60min为Pb2+吸附平衡时间。

图2 狐尾藻种苗吸附Pb2+的动力学曲线
沉水植物对重金属的整个吸附过程一般可以分为界面扩散和小孔扩散两个过程[2]。因此,本文参照常用来描述生物材料对溶液中重金属离子吸附过程的伪一级动力学方程、伪二级动力学方程和内扩散方程[25],采用Origin8.6软件对狐尾藻种苗吸附Pb2+的试验数据进行拟合分析。
伪一级动力学方程表达式为:
qt=qe(1-e-k1t)
(3)
伪二级动力学方程表达式为:
(4)
内扩散方程表达式为:
qt=kit0.5+C
(5)
式中:qt和qe分别为经过时间t时和达到吸附平衡时狐尾藻种苗对Pb2+的吸附量,mg·g-1;t为吸附时间,min;k1、k2和ki分别为伪一级动力学、伪二级动力学和内扩散方程的速率常数,其单位分别为min-1、g·(mg·min)-1和mg·(g·min0.5)-1;C为常数。
试验数据拟合结果列于表2。通过拟合参数(表2)可知,伪一级、伪二级动力学均能较好地描述狐尾藻种苗对营养液中Pb2+的吸附行为,但吸附反应更符合伪二级动力学方程,相关系数R2为0.990,说明狐尾藻种苗对Pb2+的吸附主要受其表面活性反应位点的离子交换作用控制,这与李国新等人[11]的研究结果相似。此外,从方程拟合的相关系数R2值还可看出,内扩散方程并不适合描述狐尾藻种苗对Pb2+的吸附过程,但若其拟合曲线通过原点,则速控步骤为内扩散,若不通过原点,则表示还有其他过程共同控制反应速率[26]。由图2和表2可以发现,内扩散方程中常数C不为0,即曲线未经过原点,说明内扩散不是狐尾藻种苗吸附Pb2+的唯一速控过程。

表2 狐尾藻种苗对Pb2+吸附的动力学方程拟合参数
假若狐尾藻种苗对Pb2+的吸附还存在界面扩散过程,则用Ct/C0(吸附t时间后溶液中Pb2+浓度与初始浓度之比)对吸附时间t作图进行分析,结果见图3。可以发现,狐尾藻种苗吸附Pb2+在最初的10min内Ct/C0与吸附时间t是呈近似直线关系的,其相关系数R2为0.936,这符合吸附剂外部的界面扩散规律[2],也进一步验证了狐尾藻种苗对Pb2+的吸附存在着界面扩散过程。

图3 溶液中Pb2+的Ct/C0时间变化趋势
2.3 盐胁迫对狐尾藻种苗吸附Pb2+的影响
我国沿海的一些地区,水体发生盐碱化的同时,还普遍受到重金属污染[27],这导致沉水植物往往承受着盐度和重金属的复合胁迫。然而,目前有关盐胁迫下沉水植物对重金属的吸附研究还较少。图4所示为狐尾藻种苗对不同盐度的含10mg/LPb2+的霍格兰营养液中Pb2+吸附60min时的情况。由图4可看出,狐尾藻种苗对营养液中Pb2+的吸附率随其盐度的增加而逐渐降低,且当盐度达14‰时,其吸附率降至55%,这说明水体的盐碱化会削弱狐尾藻种苗对Pb2+的吸收能力。此外,对比图2后也可发现,狐尾藻种苗对单因子Pb2+的耐受能力比NaCl与Pb2+复合胁迫的耐受能力相对强。

图4 盐度对狐尾藻种苗吸附Pb2+的影响
3 结论
本研究以筛选出的长势良好、长度均一的狐尾藻种苗作为研究对象,考察了不同盐度条件下狐尾藻种苗的叶绿素、丙二醛、POD、SOD和根系活力等生理指标响应及其对重金属Pb2+的吸附能力。结果显示,狐尾藻种苗的叶绿素和丙二醛对营养液盐度的响应表现不同,当盐度在4‰以上时,狐尾藻种苗茎叶的叶绿素含量随盐度增加而呈下降的趋势,但其体内丙二醛含量却逐渐上升,说明较高的盐度会加剧对狐尾藻种苗体内细胞膜的氧化破坏作用。然而,在0.9‰~14‰范围内,随盐度的增加,狐尾藻种苗的POD比活力、SOD总活力、根系活力等均表现出先上升后下降的相似趋势。因此,试种狐尾藻的水体,其盐度不宜过高。另外,狐尾藻种苗对营养液中Pb2+的吸附行为较符合伪二级动力学方程,其存在界面扩散、表面活性反应位点的离子交换、内扩散等三个过程,而且,水体的高盐度会削弱狐尾藻种苗对Pb2+的吸收能力。
[1] 刘红磊,李立青,尹澄清.人为活动对城市湖泊沉积物重金属污染的影响—以武汉墨水湖为例[J].生态毒理学报,2007,2(3):346-351.
[2] 彭克俭,秦春,游武欣,等.沉水植物龙须眼子菜(Potamogetonpectinatus)对镉、铅的吸附特性[J].生态环境,2007,16(6):1654-1659.
[3] 孙利军,吴伟平,刘晓骏,等.两种植物幼苗对水体中重金属铅的去除研究[J].安徽农业科学,2014,42(31):11069-11071.
[4] 郝鹏飞,梁靖,钟颖.改性沸石对含铅废水的处理研究[J].环境科学与管理,2009,34(6):106-108.
[5]VinodhiniR,NarayananM.Effectofheavymetalsinducedtoxicityonmetabolicbiomarkersincommoncarp(CyprinusCarpioL.)[J].IntJEnvironSciTech, 2008, 2(1):192-200.
[6] 聂小琴,董发勤,丁德馨,等.两种土著水生植物对铀矿坑水的修复能力研究[J].原子能科学技术,2015,49(11):1946-1953.
[7] 聂小琴,丁德馨,董发勤,等.水生植物大薸和凤眼莲对水中铀的去除[J].核化学与放射化学,2015,37(4):243-249.
[8] 陈虹,张颖,方元平,等.镉对金鱼藻植株生长和抗氧化酶活性的影响[J].湖北农业科学,2012,51(5):977-980.
[9] 简敏菲,汪斯琛,余厚平,等.Cd2+、Cu2+胁迫对黑藻(Hydrillaverticillata)的生长及光合荧光特性的影响[J].生态学报,2016,36(6):1719-1727.
[10] 李国新,薛培英,李庆召,等.pH对穗花狐尾藻吸附重金属镉的影响[J].环境科学研究,2009,22(11):1329-1333.
[11] 李国新,颜昌宙,赵超,等.穗花狐尾藻铅吸附特征与机理[J].环境科学研究,2013,26(8):892-898.
[12] 王迪,李红芳,刘锋,等.亚热带农区生态沟渠对农业径流中氮素迁移拦截效应研究[J].环境科学,2016,37(5):1717-1723.
[13] 贾一非,袁涛,马映东.狐尾藻对园林水景污染水体的净化作用[J].西北林学院学报,2015,30(6):250-254.
[14] 褚淑炜,陈小敏,潘国武,等.上庄河污染河水原位生物修复试验[J].浙江农林大学学报,2014,31(1):105-110.
[15] 袁龙义,江林枝.不同盐度对苦草、刺苦草和水车前种子萌发的影响研究[J].安徽农学通报,2008,14(17):77-56.
[16] 崔润丽,刁现民.植物耐盐相关基因克隆与转化研究进展[J].中国生物工程杂志,2005,25(8):25-30.
[17] 刘树堂.无土栽培实用技术[M].济南:黄河出版社,2004:297-300.
[18] 张志良,翟伟箐.植物生理学实验指导[M].北京:高等教育出版社,2003:80-110.
[19] 邹琦.植物生理学[M].北京:中国农业大学出版社,2000:163-166.
[20]HuT,TangQ,ZhangH,etal.AbsolutelynondestructivediscriminationofHuoshanDendrobiumnobilespecieswithminiaturenear-in-frared(NIR)spectrometerengine[J].SpectroscopyandSpectralAnalysis, 2014, 34(10): 2808-2814.
[21] 石静.水体盐度对三种植物生长和氮磷去除能力的影响[D].天津:南开大学,2010.
[22] 田国忠,李怀方,裘维蕃.植物过氧化物酶研究进展[J].武汉植物学研究,2001,19(4):332-344.
[23] 马旭俊,朱大海.植物超氧化物歧化酶(SOD)的研究进展[J].遗传,2003,25(2):225-231.
[24] 楚建周,王圣瑞,金相灿,等.底质营养状况对黑藻生长及光合作用的影响[J].生态环境,2006,15(4):702-707.
[25] 丁洋,靖德兵,周连碧,等.板栗内皮对水溶液中镉的吸附研究[J].环境科学学报,2011,31(9):1933-1941.
[26]MaZuohao,LiQiang,GaoYue,etal.Adsorptionremovalofammoniumandphosphatefromwaterbyfertilizercontrolledreleaseagentpreparedfromwheatstraw[J].TheChemicalEngineeringJournal, 2011, 171(3): 1209-1217.
[27] 龚绍琦,王鑫,沈润平,等.滨海盐土重金属含量高光谱遥感研究[J].遥感技术与应用,2010,25(2):169-177.
Effects of salt stress on physiological indicators and adsorption ability for Pb(Ⅱ) of Myriophyllum verticilatum seedling
Hu Yi, Chen Chengguang, Song Xiangnan, Sun Xiaolu, Xu Yingyi, Wu Chaohui
(Department of Architectural Engineering, Yuanpei College, Shaoxing University, Shaoxing 312000, China)
In order to explore the effects of salt stress on physiological response and adsorption ability for Pb2+of Myriophyllum verticilatum seedling, in this paper, Myriophyllum verticilatum seedlings were cultivated in Hoagland nutrient solutions which were imposed to six levels of salinities (0.9‰, 2‰, 4‰, 7‰, 10‰, 14‰ NaCl), then, five physiological indicators and removal rates of Pb2+in Hoagland nutrient solutions related with salt hardiness were measured, and the adsorption mechanism was investigated by model simulation. The results showed that leaf chlorophyll content reduced when salt concentrations were elevated, but malondialdehyde(MDA) content increased with increasing salt concentration, when above the salinity of 4‰, high salinity was thought to intensify oxidative damage to the cell membrane of Myriophyllum verticilatum seedling. While the activities of POD, SOD, root peaked at some concentration and then dropped gradually, when salinities were in the range of 0.9‰ -14‰. Besides that, the mechanism for Pb2+adsorption on Myriophyllum verticilatum seedlings was further discussed. For single Pb2+solution, adsorption process could fit well with the pseudo-second-order kinetic equation, which included three processes such as interface diffusion process, ion exchange process in surface active reaction sites, and intra-particle diffusion process. Moreover, high salinity would weaken the absorption ability for Pb2+of Myriophyllum verticilatum seedlings.
salt stress; Myriophyllum verticilatum seedlings; physiological response; Pb(Ⅱ); adsorption dynamics
绍兴市科技计划项目(2014B70041);2015年度绍兴市大学生科技创新项目(绍市教高[2015]47号)
2016-12-26;2017-02-10修回
胡艺,女,1993年生,在读本科生,研究方向:水环境污染治理研究。E-mail:1223792980@qq.com
陈成广,男,1983年生,硕士,讲师,研究方向:环境污染防治。E-mail:salen1983@163.com
X171.1
A

