2011—2015年安阳地区手足口病相关柯萨奇病毒A6 VP1基因特征
李洋 包红红 张相萍 翟明强 包小兵 黄学勇 李懿
455000 安阳市疾病预防控制中心微生物检验科(李洋、包红红、张相萍、翟明强、包小兵);450016 郑州,河南省疾病预防控制中心传染病预防控制所(黄学勇、李懿)
·论著·
2011—2015年安阳地区手足口病相关柯萨奇病毒A6 VP1基因特征
李洋 包红红 张相萍 翟明强 包小兵 黄学勇 李懿
455000 安阳市疾病预防控制中心微生物检验科(李洋、包红红、张相萍、翟明强、包小兵);450016 郑州,河南省疾病预防控制中心传染病预防控制所(黄学勇、李懿)
目的 对2011—2015年安阳地区手足口病(HFMD)相关柯萨奇病毒A6(CVA6)VP1基因进行研究,以了解本地区CV-A6的分子流行病学特征。方法 使用实时荧光PCR方法对临床病例标本进行肠道病毒型别鉴定。设计引物对CV-A6阳性标本的VP1区进行扩增和测序。构建系统进化树并进行系统进化分析。对近年流行的CVA6中国毒株的VP1基因进行进化选择压力分析。结果 2011—2015年安阳地区检出CV-A6阳性标本365份,占总肠道病毒阳性标本的比例为19.59%。系统进化分析显示,抽样调查的22条安阳地区CVA6 VP1序列中,有5条属于D1基因亚型,另外17条属于D2基因亚型。进化选择压力分析显示,D1、D2基因亚型中国株VP1基因承受的进化选择压力(ω值)分别为0.031和0.075;在D1、D2基因亚型中国株VP1基因上分别发现正选择氨基酸位点1处和4处。结论 2011—2015年安阳地区先后流行有D1、D2两种基因亚型的CVA6毒株。D2基因亚型对D1基因亚型的替代以及D2基因亚型的持续传播是造成安阳地区2013—2015年CV-A6型手足口病疫情的主要原因。
Fund programs: Scientific and Technological Project of Henan Province (122102310268); Henan Major Medical Project of Science and Technology (201001015); Health Science and Technology Innovative Talents Project of Henan Province; Scientific and Technological Project of Anyang City (2013042)
柯萨奇病毒A6(Coxsackievirus A6,CVA6)是小RNA病毒科肠道病毒属人肠道病毒A种(HEV-A)成员。早期研究认为CVA6仅能引起散发的手足口病(Hand, foot and mouth disease, HFMD)病例,在手足口病病原中的重要性远低于柯萨奇病毒A16(Coxsackievirus A16, CVA16)和肠道病毒71(Enterovirus 71,EVA71)。但是2008年CVA6型手足口病在芬兰首度暴发,之后几年间欧洲、亚洲、美洲和大洋洲的许多国家和地区也出现了不同规模疫情[1-5]。CVA6逐渐成为世界范围内手足口病的主要病原。相比其他国家,中国CVA6疫情的出现明显较晚。2011年起,东南沿海省份[6, 7]CVA6病例开始增多;2012年,华中和华东地区[8, 9]出现相同情况;2013年,CVA6高流行区扩大至北方多个省市[10-12],逐渐发展成为全国性的手足口病暴发事件。安阳地区CVA6疫情的首次升高出现在2013年,初步研究发现存在2种基因亚型毒株[13],但是由于只掌握短期数据,未能全面认识和了解此次疫情发生的过程,也未能揭示2种基因亚型毒株间的进化关系。本研究将调查时间和延伸至2011—2015年,覆盖了CVA6疫情上升前后两个阶段,以求全面认识CVA6在本地区的流行历史和发展趋势,深入揭示其分子流行病学特征,为本地区及全国CVA6型手足口病的研究提供有益资料。
1 材料与方法
1.1 标本来源及处理 在2011—2015年安阳地区各级医院收治的手足口病门诊及住院患者中采集粪便标本,总计2 270份,男性标本1 440份,女性标本830份,男女比例约为1.73∶1。标本采集、运输和保存严格依照《手足口病预防控制指南(2009年版)》。
1.2 肠道病毒核酸检测和分型 使用北京天根公司病毒核酸提取试剂盒从上清液中提取病毒RNA。使用江苏硕世公司手足口肠道病毒多通道实时荧光PCR检测试剂盒对总肠道病毒、CVA16、EVA71进行检测。具体操作参照试剂盒说明书进行。使用相关文献上的CVA6实时荧光逆转录PCR检测方法[14]对非CVA16非EVA71肠道病毒阳性标本进行检测,鉴定出CVA6阳性标本。
1.3 CVA6 VP1基因扩增和测序 在GenBank数据库中检索CVA6基因组完整序列,以VP1基因为靶段设计引物(见表1),对CVA6阳性标本进行扩增和测序。个别未能成功扩增的标本使用引物2、3和4进行分段扩增和测序[13]。引物合成及测序由苏州金唯智生物科技有限公司完成。使用Lasergene Suite 7.1软件中的Seqman程序对测序结果进行剪辑,获得全长915 nt(Nucleotide, nt)的CVA6 VP1基因完整序列。随机从2011—2015年每月上、中、下旬CVA6阳性标本中各取1~2份进行实验,最终获得61条VP1基因的完整序列(KU708569-KU708619、KT124601-KT124610)。
1.4 CVA6 VP1基因系统发育分析 从GenBank数据库中下载所有完整的CVA6 VP1基因序列。应用MEGA 6.0软件,采用邻接法(Neighbor-Joining)构建系统进化树。由于历史参考序列较多,根据时间和地理信息,将系统进化树上处于同一分支且来源相同(毒株年代和地区)的序列进行精简,保留了6个国家的40条参考序列作为各分支的代表序列,其中包括中国(1992—2014年)12个省市的32条序列。另外,将测序获得的61条安阳序列同样进行精简,将一年中12个月份划分成6个时间段(1—2月、3—4月、5—6月、7—8月、9—10月和11—12月),从系统进化树的各个不同基因型、基因亚型分支序列中,按照每年每个时间段随机选取1条序列作为代表的原则,选出22条安阳地区代表序列(其中2011年2条、2012年2条、2013年6条、2014年6条、2015年6条)。使用精简后的总计62条代表序列(参考序列40条、安阳序列22条)重新构建系统进化树。根据系统进化树上各序列间的亲疏关系,以核苷酸相似性差异约达到15%作为基因分型的标准,将CVA6划分成不同的基因型。使用1.5 CVA6 VP1基因进化选择分析 使用在线进化选择分析程序DataMonkey,采用SLAC(Single-Likelihood Ancestor Counting)法计算近年中国大陆地区CVA6不同基因亚型流行株的进化选择压力(ω值),再采用FEL(Fixed Effects Likelihood)、IFEL(Internal Fixed Effects Likelihood)和MEME(Mixed Effects Model of Evolution)法查找出VP1基因的正向选择压力位点。

表1 CVA6 VP1基因扩增及测序引物
注:引物位置参照CVA6原型株Gdula
Note:The locations of primers respond to the prototype of CVA6, Gdula
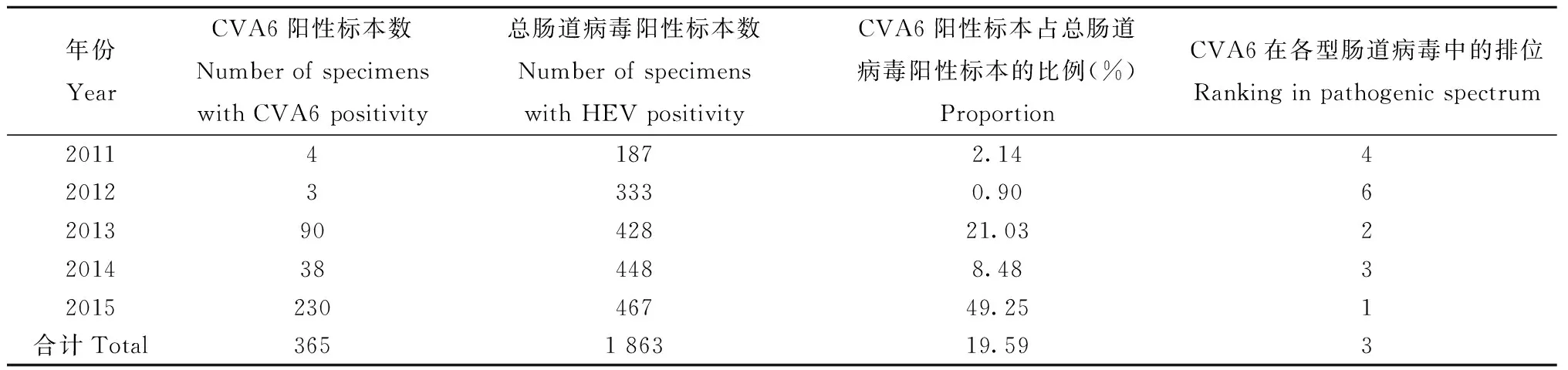
表2 安阳地区2011—2015年CVA6阳性标本数及比例
MEGA 6.0软件计算不同基因型间的平均进化距离,使用BioEdit 7.2软件计算各基因型间氨基酸序列相似性。
2 结果
2.1 肠道病毒核酸分型 2011—2015年,安阳地区共检出1 863份肠道病毒阳性标本,总肠道病毒阳性率为82.07%,其中CVA6阳性标本365份,占总肠道病毒阳性标本的比例为19.59%。在全部手足口病病原中,CVA6仅次于CVA16(682,36.61%)和EVA71(652,35%),居第3位。5年间,CVA6阳性标本检出数及其占总肠道病毒比例变化较大(见表2)。总肠道病毒阳性标本中CVA6所占比例在2013年前后的两个时间段(2011—2012与2013—2015)的差异有非常显著意义(χ2=152,P=0.00)。
2.2 CVA6病例分布特征 5年间,实验室确诊的CVA6手足口病病例中,男性231人,女性134人。患者最小2个月,最大10岁,1岁组比例最高(46.30%)。在CVA6流行水平较高的2013年和2015年,实验室确诊的CVA6聚集性手足口病分别有17起和26起,占当年总聚集性手足口病的比例分别为29.41%和76.47%。春季(3—5月份)是CVA6病例最为集中的季节,春季发病的CVA6病例占CVA6总病例的56.99%。2013年和2015年春季发病的CVA6病例占当年春季总肠道病毒感染病例的比例分别为56.25%和75.74%。
2.3 CVA6 VP1基因系统进化分析 根据系统进化树上各CVA6序列的亲疏关系,将62条CVA6序列分为A、B、C、D四个基因型(图1),各基因型间的平均进化距离介于0.181~0.216。D基因型所包含的序列数最多,其与其他基因型各序列间的核苷酸相似性为80.8%~85.9%,D基因型内各序列间的核苷酸相似性为87.5%~100%。D基因型可进一步分为2个基因亚型(D1和D2)。参与构建系统进化树的22条安阳地区CVA6序列中,有5条序列(2011年3月至2013年6月)属于D1基因亚型,17条序列(2012年11月至2015年12月)属于D2基因亚型。D2基因亚型的安阳序列中,有5条序列位于分支D2a上,12条序列位于分支D2b上。

●安阳序列;▲CVA6原型株图1 CVA6 VP1基因核苷酸序列的系统进化树 ●Anyang sequences; ▲the prototype of CVA6Fig.1 Phylogenetic tree based on the entire VP1 nucleotide sequences of the CVA6 strain
2.4 CVA6 VP1基因进化选择分析 使用DataMonkey在线分析软件采用SLAC法分别计算D1和D2基因亚型中国株VP1基因的ω值,前者为0.031,后者为0.075。采用FEL、IFEL和MEME计算方法在D1和D2基因亚型中国株中共查发现5个正向选择压力位点(表3)。
3 讨论
VP1蛋白是肠道病毒重要的衣壳蛋白,含有抗原决定位点和决定病毒组织嗜性的受体识别位点,具有与病毒血清型对应的遗传多样性,因此VP1基因是肠道病毒基因分型和遗传进化分析的重要研究对象[15]。本研究根据VP1基因序列构建的CVA6系统发育树可将CVA6分为A-D四个不同的基因型,各基因型均具有显著的时空分布差异。其中中国CVA6毒株具有较高的VP1基因多样性,B、C、D基因型在我国均有历史记录。从CVA6毒株的时间、地理信息可推测,在中国2005—2010年,D基因型取替了B基因型;2010年—2013年,D2基因亚型取替了D1基因亚型。本研究完整地捕捉到安阳地区D2基因亚型对D1基因亚型的更替过程。对测序获得的全部61条安阳本地CVA6 VP1基因序列进行基因亚型的分型发现,有10条序列(2011年3月至2013年6月)属于D1基因亚型;51条序列(2012年11月至2015年12月)属于D4基因亚型。两种基因亚型毒株的更替主要发生于2013年上半年,与此同时安阳地区CVA6流行水平突然升高,出现了CVA6流行的第一个高峰。在2013年6月以后安阳地区再没有发现D1基因亚型的CVA6毒株,D2基因亚型成为本地区唯一流行的基因亚型。这表明D2基因亚型对D1基因亚型的取代与安阳地区CVA6型手足口病疫情的发生存在密切联系。随着D2基因亚型对D1基因亚型取代完成,至2015年,安阳地区CVA6流行水平达到历史最高,CVA6超过CVA16和EVA71,跃居本地区手足口病各型肠道病毒之首。显然,D2基因亚型CVA6毒株是导致近年来安阳地区CVA6型手足口病疫情的主要原因。通过对CVA6系统进化树的分析,还发现了我国东南地区不同CVA6基因亚型毒株的更替要早于北方地区,这与东南地区首先报道CVA6流行水平升高的情况相一致。安阳地区的D2基因亚型CVA6毒株可能是从疫情出现较早的其它地区传入而来,进而在本地导致了CVA6型手足口病的暴发和流行。

表3 CVA6中国株VP1基因正向选择压力位点
注:显著性水平设为<0.1
Note:P-value of significance level<0.1
对D1和D2基因亚型中国毒株的VP1基因进行进化选择分析发现,D2基因亚型毒株相比D1基因亚型毒株具有较大的ω值和较多的正向选择压力位点。较大的ω值反映出D2基因亚型毒株所受到的纯化作用小于D1基因亚型毒株;而较多的正向选择压力位点则暗示了D2基因亚型毒株较D1基因亚型毒株更积极地朝着有利于其自身生存、传播的方向进化。因为VP1基因上分布有多个重要的中和位点,所以一旦D2基因亚型毒株在正向选择压力位点发生非同义氨基酸替换,那么可能引起病毒抗原性发生改变,这也就为新基因亚型CVA6毒株(D2基因亚型)在人群内中可以迅速、广泛传播,并成功取代老基因亚型毒株(D1基因亚型)提供了合理解释。现阶段手足口病治疗尚无特效抗病毒药物,刚上市的EVA71疫苗的免疫效果仍有待长时间验证,更为不利的是引起手足口病的肠道病毒型别众多,多种肠道病毒在人群中共循环,病毒易发生突变、重组,从而产生高致病性的新基因型或新基因亚型毒株,因此手足口病监测和防控应是多病原、多地区联动,对新出现或新传入的毒株类型要提高警惕,避免造成严重的公共卫生事件。
[1] Osterback R, Vuorinen T, Linna M, et al. Coxsackievirus A6 and hand, foot, and mouth disease, Finland[J]. Emerg Infect Dis,2009,15(9):1485-1488. doi:10.3201/eid1509.090438.
[2] Montes M, Artieda J, Pineiro LD, et al. Hand, foot, and mouth disease outbreak and coxsackievirus A6, northern Spain, 2011[J]. Emerg Infect Dis,2013,19(4):676-678. doi:10.3201/eid1904.121589.
[3] Kobayashi M, Makino T, Hanaoka N, et al. Clinical manifestations of coxsackievirus A6 infection associated with a major outbreak of hand, foot, and mouth disease in Japan[J]. Jpn J Infect Dis,2013,66(3):260-261. doi:10.7883/yoken.66.260.
[4] Flett K, Youngster I, Huang J, et al. Hand, foot, and mouth disease caused by coxsackievirus a6[J]. Emerg Infect Dis,2012,18(10):1702-1704. doi:10.3201/eid1810.120813.
[5] Hayman R, Shepherd M, Tarring C, et al. Outbreak of variant hand-foot-and-mouth disease caused by coxsackievirus A6 in Auckland, New Zealand[J]. J Paediatr Child Health,2014,50(10):751-755. doi:10.1111/jpc.12708.
[6] 曾汉日,陆靖,李晖,等. 广东省2008—2013年柯萨奇A6型肠道病毒的流行及其基因特征分析[J]. 中华微生物学和免疫学杂志,2014,34(10):742-746. doi:10.3760/cma.j.issn.0254-5101.2014.10.003.
[7] 陈炜,翁育伟,何文祥,等. 2011~2013年福建省手足口病相关病原柯萨奇病毒A组6型的分子流行病学研究[J]. 病毒学报,2014,30(6):624-629. doi:10.13242/j.cnki.bingduxuebao.002575.
[8] 查杰,封琦,马智龙. 2010—2013年江苏省泰州市非EV71和非Cox A16型手足口病肠道病毒病原谱及Cox A6 VP1基因特征分析[J]. 中华流行病学杂志,2014,35(10):1181-1182. doi:10.3760/cma.j.issn.0254-6450.2014.10.024.
[9] Feng X, Guan W, Guo Y, et al. A novel recombinant lineage's contribution to the outbreak of coxsackievirus A6-associated hand, foot and mouth disease in Shanghai, China, 2012—2013[J]. Sci Rep,2015,5:11700. doi:10.1038/srep11700.
[10] 杨国梁,马超锋,陈海龙,等. 2013年西安地区柯萨奇病毒A6流行情况及基因特征[J]. 西安交通大学学报(医学版),2014,35(4):486-489, 498. doi:10.7652/jdyxb201404014.
[11] Gu HY, Ma CJ, Yang QZ, et al. Hand, foot and mouth disease caused by coxsackievirus A6, Beijing, 2013[J]. Pediatr Infect Dis J,2014,33(12):1302-1303. doi:10.1097/INF.0000000000000467.
[12] Tan XJ, Li L, Zhang BM, et al. Molecular epidemiology of coxsackievirus A6 associated with outbreaks of hand, foot, and mouth disease in Tianjin, China, in 2013[J]. Arch Virol,2015,160(4):1097-1104. doi:10.1007/s00705-015-2340-3.
[13] 李洋,张相萍,翟明强,等. 安阳地区2013年手足口病柯萨奇病毒A6 VP1基因特征研究[J]. 病毒学报,2016,32(3):324-330. doi:10.13242/j.cnki.bingduxuebao.002927.
[14] 李洋,张相萍,翟明强,等. 柯萨奇病毒A6 TaqMan探针实时荧光逆转录PCR检测方法的建立[J]. 中国病原生物学杂志,2015,10(11):971-975. doi:10.13350/j.cjpb.151103.
[15] 韩文清,宫连凤,刘娟,等. 烟台市手足口病合并脑炎病毒分离及基因序列分析[J]. 中华实验和临床病毒学杂志,2012,26(5):338-340. doi:10.3760/cma.j.issn.1003-9279.2012.05.006.
(本文编辑:唐浏英)
VP1 genetic analysis concerning coxsackievirus A6 associated with hand, foot and mouth disease in Anyang city from 2011 to 2015
LiYang,BaoHonghong,ZhangXiangping,ZhaiMingqiang,BaoXiaobing,HuangXueyong,LiYi
MicrobiologyLaboratory,AnyangMunicipalCenterforDiseaseControlandPrevention,Anyang455000,China(LiY,BaoHH,ZhangXP,ZhaiMQ,BaoXB);InstituteforInfectionsDiseaseControlandPrevention,HenanProvincialCenterforDiseaseControlandPrevention,Zhengzhou450016,China(HuangXY,LiY)
HuangXueyong,Email:hxyzzu@163.com
Objective To study the VP1 gene of coxsackievirus A6 (CVA6) and to reveal the molecular epidemiologic characteristics of CVA6 related to hand, foot and mouth disease (HFMD) in Anyang city from 2011 to 2015. Methods Serotypes of human enterovirus (HEV) were detected with the real-time RT-PCR from the clinical specimens. Primers were designed and used to amply and sequence the VP1 region of CVA6. Phylogenetic tree was constructed and phylogenetic analysis was performed. Selection pressures of the VP1 gene were evaluated for different subgenotypes of CVA6 circulating in China in recent years. Results A total of 365 specimens with CVA6 positivity were identified in Anyang city during 2011—2015. CVA6 specimens accounted for 19.59% of all HEV-positive specimens. Phylogenetic analysis showed that all CVA6 strains were divided into four genotypes and the genotype D was further divided into two subgenotypes. Among the twenty-two Anyang sequences involved in the phylogeny of CVA6, five sequences belonged to subgenotype D1 and the other seventeen sequences belonged to subgenotype D2. The values of selection pressure of the Chinese CVA6 strains within subgenotype D1 and subgenotype D2 were 0.031 and 0.075, respectively. Only one positively selected site was detected in the VP1 gene of subgenotype D1, meanwhile four were detected in the VP1 gene of subgenotype D2. Conclusions Subgenotype D1 and its successor, subgenotype D2, circulated in Anyang city during 2011—2015. The subgenotype replacement from CVA6 subgenotype D1 to CVA6 subgenotype D2 and the continuous transmission of CVA6 subgenotype D2 were the two major causes of HFMD epidemic related to CVA6 in Anyang city during 2013—2015.
Hand, foot and mouth disease;Enterovirus;Coxsackievirus;Genotype
黄学勇, Email:hxyzzu@163.com
10.3760/cma.j.issn.1003-9279.2017.02.006
河南省科技攻关计划项目(122102310268);河南省医学科技重大攻关项目(201001015);河南省卫生科技创新型人才工程;河南省安阳市科技攻关项目(2013042)
手足口病;肠道病毒属;柯萨奇病毒;基因型
2016-04-22)

