六种注射用交联透明质酸钠的形态学观察及体外酶降解实验
王慕瑶,蒋伊晨,吴可伦,谢 利,王 杭
(四川大学华西口腔医学院颌面外科 四川 成都 610041)
•基础研究•
六种注射用交联透明质酸钠的形态学观察及体外酶降解实验
王慕瑶,蒋伊晨,吴可伦,谢 利,王 杭
(四川大学华西口腔医学院颌面外科 四川 成都 610041)
目的:体外对比瑞蓝2、乔雅登、艾丽薇、润百颜、伊婉和海薇6种HA产品的形态及酶解反应时间。方法:取6种HA各0.050ml,经2%甲苯胺蓝染色12h,水溶液状态下分别于肉眼和显微镜下观察其形态;HA染色后室温条件下(24℃)置于300U(150U/ml)透明质酸酶中溶解,显微镜下观察溶解状态,并记录溶解时间。结果:6种HA均能观察到颗粒状形态,不同HA颗粒大小及分布均有所差异,其在透明质酸酶中完全溶解所需时间也不相同。结论:尽管不同HA产品相类似,但其因交联技术、制造工艺的不同,物理性质有一定差异,这种差异会在一定程度上影响其酶解反应速度。
皮肤填充剂;透明质酸;透明质酸酶;酶解作用;不良反应
随着医疗整形美容行业的兴起,透明质酸(hyaluronic acid,HA)类皮肤美容填充剂已广泛应用于颌面部微创整形。尽管HA类填充产品相类似,但不同产品的交联方法和生产工艺不尽相同,这使得HA凝胶的物理性质,如:浓度、交联度、颗粒大小、硬度、凝聚性等有所差异,这些差异会在临床应用中有所体现。透明质酸酶(hyaluronidase,HAase)是以降解透明质酸为主的糖苷酶,可在一定程度上纠正HA注射后造成的不良反应。本实验欲探究6种国内外常用的HA类皮肤美容填充产品的外观形态,并于体外对比其在 HAase 中降解所需时间。
1 材料和方法
1.1 实验材料:6种HA产品:瑞蓝2(Restylane 2,瑞典高德美公司)、乔雅登(Juvéderm Ultra 3,法国艾尔建公司)、伊婉(Yvoire contour plus,韩国LG生命科学)、艾丽薇(Elravie deep line plus,韩国 Humedix 公司)、润百颜(BioHyalux,山东济南华熙福瑞达生物医药有限公司)和海薇(Matrifill,上海其胜生物制剂有限公司);注射用玻璃酸酶(上海第一生化药业公司,1 500U/支)。
1.2 方法
1.2.1 凝胶形态学检查:取凝胶样本50µl置于直径3cm的培养皿中,经25µl的甲苯胺蓝(2%)染色10min后,加入2ml蒸馏水将其稀释,被稀释的凝胶储存于4℃冰箱中,12h后取出,分别于裸眼及显微镜下观察6种HA产品的形态结构。
1.2.2 酶溶解实验:酶解实验前,经染色的凝胶提前置于室温下1h,再溶解于300U HAase溶液中(150U/ml),混匀,立即于显微镜下观察凝胶的酶溶解状况,记录酶溶时间。实验过程中室温为24℃,每种凝胶产品进行3次重复实验。
2 结果
2.1 HA产品的形态学检查结果:6种HA产品溶于水中观察,可见颗粒大小不一、形态不规则。6种HA产品浓度不同,颗粒尺寸均有其相应范围,见表1。裸眼观察下,不同凝胶形态学有较大差异(如图1):瑞蓝、伊婉、润百颜和海薇的颗粒形态明显且无粘性,而乔雅登、艾丽薇呈均质状,颗粒形态不明显;瑞蓝颗粒分布均匀,伊婉颗粒尺寸最大,润百颜、海薇颗粒形态相似。显微镜下结果所示(如图2),不同种凝胶形态差异更加明显:瑞蓝凝胶颗粒呈长方形,形态相对规则;润百颜及海薇颗粒形态相类似,呈方形状,且润百颜颗粒直径略大于海薇;乔雅登与艾丽薇在显微镜下可见细小颗粒状凝胶,且颗粒间紧密相靠,其中乔雅登可见较大颗粒状凝胶且颗粒直径分布范围较艾丽薇广。显微镜下的观察证实了此6种HA产品均有粒子特性。

表1 六种HA浓度、颗粒直径范围及酶解反应时间比较
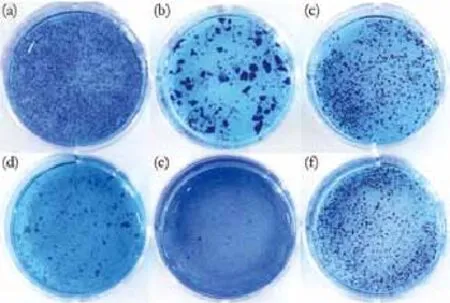
图1 六种HA产品甲苯胺蓝染色后裸眼下形态学观察比较
2.2 HA酶溶解时间检测:在相同条件下:室温24℃,HAase 300U(150U/ml),6种HA产品溶解时间结果见表1。显微镜下可直观连续地观察HA的溶解状态(图3~8):其中乔雅登溶解较快,但个别大颗粒状的乔雅登完全溶解需
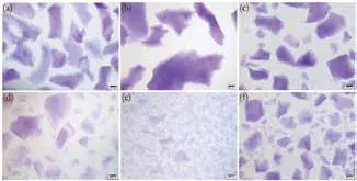
图2 六种HA 产品甲苯胺蓝染色后显微镜下形态观察
注:(a)瑞蓝 2(Restylane 2);(b) 伊婉(Yvoire contour plus);(c) 润百颜(BioHyalux);(d) 乔雅登(Juvéderm Ultra 3);(e) 艾丽薇(Elravie deep line plus);(f) 海薇(Matrifill) 60~90min,瑞蓝和艾莉薇在90min内可完全溶解,伊婉、润百颜、海薇在90min内溶解不明显。
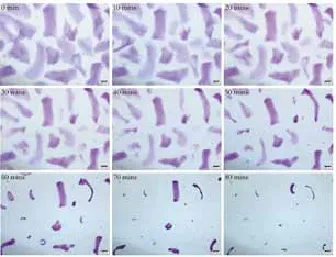
图3 瑞蓝 2(Restylane 2)酶解反应显微镜下观察
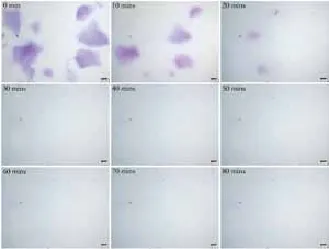
图4 乔雅登(Juvéderm Ultra 3)酶解反应显微镜下观察
3 讨论

图5 伊婉(Yvoire contour plus)酶解反应显微镜下观察

图6 艾丽薇(Elravie deep line plus)酶解反应显微镜下观察态观察
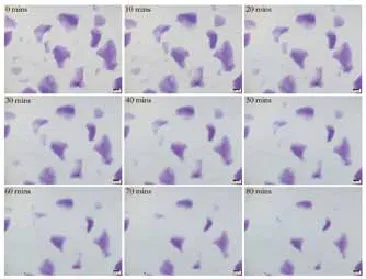
图7 润百颜(BioHyalux)酶解反应显微镜下观察
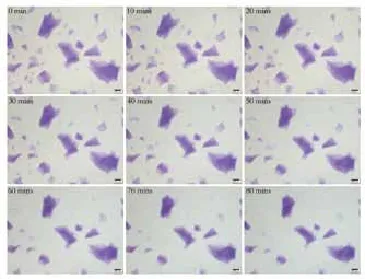
图8 海薇(Matrifill)酶解反应显微镜下观察
HA 是广泛存在于生物体内的一种酸性黏多糖,在不同物种和组织中其化学结构相同。正是由于HA 良好的生物相容性及其独特的物理特性,使其自问世以来,成为理想且常用的皮肤填充材料。HA可被 HAase 降解,普通HA在体内很快就会代谢成水和二氧化碳,不同组织中的HA半衰期不同,从几分钟(血液中)到3周不等,在皮肤中其半衰期不到1d[1]。作为皮肤填充剂使用时,为了延长疗效,一般采用交联的方法改变HA链的三维结构,以延缓其降解速度。经过交联的HA产品,维持效果约6~9个月,部分产品的疗效可维持1~2年。
3.1 HA的物理特性:HA产品的原材料是纯度相同,但分子量不同的HA粉末。交联后的HA产品因其交联技术及浓度不同而有所差异。在医学美容领域常用1,4-丁二醇二缩水甘油醚(1,4-butanediol diglycidyl ether, BDDE)作为交联剂[2]。实验中我们观察到不同种HA产品形态明显不同,瑞蓝、伊婉、海薇、润百颜与乔雅登、艾丽薇相比有更明显的颗粒状形态,这是因为它们的交联技术有所区别。以瑞蓝和乔雅登为例,虽然两者使用的交联剂均为BDDE,但瑞蓝采用的是NASHA®交联技术,其先进行分子交联工艺,制成透明质酸固块,再进行粉碎切割工艺,最后通过直径不同的筛网分选工艺,将颗粒按不同直径,分为不同临床应用的产品线。因此 NASHA® 工艺主要特点是颗粒形态明显,硬度大,直径均一,而极少量从交联HA 颗粒上自然脱落下来的游离透明质酸,又能使产品更易推注,优化临床效果,常被称为双相 HA。而乔雅登采用的是Hylacross®交联技术,形成具有3D矩形解构和均质化的HA,并且未添加未交联的HA,常被称为单相HA,因此乔雅登没有特定的颗粒尺寸大小。但Ohrlund等学者的研究发现在镜下乔雅登仍有颗粒状形态,且与瑞蓝相比,乔雅登的颗粒直径范围更广[3-4];Flynn等学者的研究也证明所有HA凝胶产品均存在低分子量HA[5];与本研究结果相一致。
除了颗粒形态外,HA还有一些其他重要的物理特性,如交联度、凝聚性、分子量、流变性能等。这些物理性质间相互影响且赋予HA独特的机械性能。例如,交联度决定了凝胶的硬度,即对抗形变的能力,凝胶交联度越高,硬度越大。其中硬度可以通过测量凝胶流变性能所体现。此外,HA的颗粒形态也在一定程度上影响其机械性能,不规则形态的颗粒可能比球形颗粒更易聚集互锁,使得凝胶均匀一致。这些特性最终会影响HA的适用范围、注射技术及最终效果[6]。
3.2 HA在临床上的应用:对临床医生来说,了解掌握HA类皮肤填充剂的特性,是满足病人不同诉求,从而达到理想治疗效果的必要条件。HA物理性质多与其临床注射效果、维持时间和抵抗酶降解相联系。
已有研究表明HA产品的持久性与HA的浓度和交联度呈正相关,但浓度高于25mg/ml的HA产品很难通过小口径针头注射[7-8],这也就阻碍了高浓度HA的开发应用。颗粒大小与形态是HA的一个重要物理性质,采用不同专有筛生产工艺或均质化生产工艺生产的HA产品,凝胶平均颗粒大小明显不同,大颗粒产品更适用于填充深层组织。HA颗粒大小与HA抵抗酶降解之间也存在一定的关系:大颗粒HA总表面积有限,限制了HAase对HA的溶解破坏;相反,小颗粒HA提供了更多总表面积,使其更容易降解。以往临床研究指出,虽然不同种HA产品的颗粒直径大小不同,但大颗粒HA产品并未显示出更长的临床持续效果,一种解释是可能其颗粒直径差别还不足以产生临床效果差异[8]。但随着HA生产技术的革新,HA类产品的丰富,一些厂商已推出同类型产品的大颗粒型号产品,如大颗粒型艾丽薇、大颗粒型伊婉,其临床维持效果也随着颗粒直径范围的扩大而增长。但值得注意的是,HA填充剂的注射效果不仅与HA填充剂的特性相关,还与注射技术及求美者生物差异相关。因此综合各种因素的影响,HA物理特性的区别可否在临床上有所体现也存在一定争议[9]。但无论如何,不同HA产品的区别为求美者提供了更精密和多元化的治疗效果。
在临床治疗中,HA填充产品抵抗内生性HAase的降解,保持长期塑形效果很重要,但HA的安全性、易使用性及求美者的舒适度等因素也同样是评估产品的重要指标。尤其随着HA的流行,注射后不良反应的报道也越来越多。常见的不良反应包括肿胀、疼痛、红斑等,一般2周内可自愈。偶尔还会出现过敏反应,肉芽肿形成。而因血管栓塞造成的皮肤坏死和失明是最严重的不良反应,也是临床上最难应对的[10-13]。治疗HA注射后所造成的组织坏死和失明是近年来的研究热点[14],虽然其治疗方法多样,但 HAase的注射仍是最为重要的[15-17]。因此,探究不同种HA产品的酶溶解速度也显得更为有意义。回顾以往研究,HAase降解HA的测定方法有色谱分析法、黏度测定法、比色测定法等[1,9,18-19],这些方法大多复杂耗时,或者需要精密昂贵的仪器。本研究在显微镜下观察对比6种HA填充产品的形态和HAase降解过程,为探究不同种HA产品的颗粒形态分布和体外酶降解时间提供了一个简单、易行、直观和重复性强的方法。值得注意的是,HA的注射后的持久性和抵抗酶降解反应并不是完全等同的概念。临床治疗中HA持久性主要体现在HA的体积保有率,其不但与HA抗酶解能力相关联,还与HA的支撑能力密切联系。
显微镜下我们发现6种HA产品的酶溶解所需时间不同。其中伊婉抗酶降解能力最强,其次是润百颜、海薇和瑞蓝,而乔雅登和艾丽薇酶溶解所需时间较短。Sall和Delorenzi等学者的研究发现体外乔雅登比瑞蓝抗降解能力更强,可能的原因是瑞蓝作为一种双相HA产品,与单相HA乔雅登相比,其不同的颗粒形态为酶解反应特供了更大的表面积[18,20]。也有研究指出,可能因乔雅登具有更高的浓度和更强的凝聚性,使得其抗降解能力更强。因为HA抵抗酶降解与其凝聚特性也存在一定关系,凝聚力使HA形成了一个紧密完整的三维网架,限制HAase的渗透和对HA的降解,是HA保持完整的重要因素[19]。相反,Park等研究者的体外实验则证明双相HA凝胶抵抗酶降解能力更强[9],本研究也发现体外溶液状态下乔雅登在HAase中溶解所需时间更短,可能是由于溶液状态下凝聚力对HA酶降解的影响很小而无法完全模拟体内情况。这是本实验的缺陷,但研究结果也进一步显示凝聚力在HA抗降解能力方面可能是一个重要因素。此外,体外实验结果提示临床医生和研究者,在体内较复杂的环境下以HAase溶解HA,尤其是想要溶解血管内的HA,所需要的时间可能更长,且不同种HA产品的溶解时间差异可能更大。这就要求临床医生应充分了解不同HA产品的物理性质,选择合适的产品进行注射治疗,并针对不同种HA产品所造成的不良反应调整治疗策略。相关问题也需要更多的体内外实验研究提供科学依据,以便指导临床医生针对不同HA产品进行更加安全有效的治疗。
(致谢:感谢高德美公司对本项目的支持。)
[1]Park S,Park KY,Yeo IK,et al.Investigation of the degradationretarding effect caused by the low swelling capacity of a novel hyaluronic acid filler developed by solid-phase crosslinking technology[J].Ann Dermatol,2014,26(3):357-362.
[2]Micheels P,Sarazin D,Tran C,et al.Effect of Different Crosslinking Technologies on Hyaluronic Acid Behavior: A Visual and Microscopic Study of Seven Hyaluronic Acid Gels[J].J Drugs Dermatol,2016,15(5):600-606.
[3]Ohrlund JA,Edsman KL.The myth of the “biphasic” hyaluronic acid fl ller[J].Dermatol Surg,2015,41:S358-S364.
[4]Stocks D,Sundaram H,Michaels J,et al.Rheological evaluation of the physical properties of hyaluronic acid dermal fl llers[J].J Drugs Dermatol,2011,10(9):974-980.
[5]Flynn TC,Thompson DH,Hyun SH.Molecular weight analyses and enzymatic degradation profiles of the soft-tissue fillers Belotero Balance, Restylane, and Juvederm Ultra[J].Plast Reconstr Surg,2013,132(2):22S-32S.
[6]Edsman K,Nord LI,Ohrlund A,et al.Gel properties of hyaluronic acid dermal fl llers[J].J Drugs Dermatol,2012,38(7pt2):1170-1179.
[7]Falcone SJ,Berg RA.Crosslinked hyaluronic acid dermal fillers: A comparison of rheological properties[J].J Biomed Mater Res A,2008,87(1):264-271.
[8]Kablik J,Monheit GD,Yu L,et al.Comparative physical properties of hyaluronic acid dermal fl llers[J].Dermatol Surg,2009,35(Supplements1):302-312.
[9]Park KY,Kim HK,Kim BJ.Comparative study of hyaluronic acid fillers by in vitro and in vivo testing[J].J Eur Acad Dermatol Venereol Jeadv,2014,28(5):565-568.
[10]Kim DW,Yoon ES,Ji YH,et al.Vascular complications of hyaluronic acid fillers and the role of hyaluronidase in management[J].J Plas Reconstr Aesthet Surg,2011,64(12):1590-1595.
[11]Ozturk CN,Li Y,Tung R,et al.Complications following injection of soft-tissue fl llers[J].Aesthet Surg J,2013,33(6):862-877.
[12]Carruthers JD,Fagien S,Rohrich RJ,et al.Blindness caused by cosmetic filler injection: a review of cause and therapy[J].Plast Reconstr Surg,2014,134(6):1197-1201.
[13]Beleznay K,Carruthers JD,Humphrey S,et al.Avoiding and Treating Blindness From Fillers: A Review of the World Literature[J]. Dermatol Surg,2015,41(10):1097-1117.
[14]Signorini M,Liew S,Sundaram H,et al.Global Aesthetics Consensus: Avoidance and Management of Complications from Hyaluronic Acid Fillers-Evidence-and Opinion-Based Review and Consensus Recommendations[J].Plast Reconstr Surg,2016,137(6):961e-971e.
[15]Bailey SH,Fagien S,Rohrich RJ.Changing role of hyaluronidase in plastic surgery[J].Plast Reconstr Surg,2014,133(2):127e-132e.
[16]Cohen JL,Biesman BS,Dayan SH,et al.Treatment of Hyaluronic Acid Filler-Induced Impending Necrosis With Hyaluronidase: Consensus Recommendations[J].Aesthet Surg J,2015,35(7):844-849.
[17]Landau M.Hyaluronidase Caveats in Treating Filler Complications[J].Dermatol Surg,2015,41:S347-S353.
[18]Sall I,Férard G.Comparison of the sensitivity of 11 crosslinked hyaluronic acid gels to bovine testis hyaluronidase[J].Polym Degrad Stabil,2007,92(5):915-919.
[19]Jones D,Tezel A,Borrell M.In Vitro Resistance to Degradation of Hyaluronic Acid Dermal Fillers by Ovine Testicular Hyaluronidase[J].Dermatol Surg,2010,36(Sup 1):804-809.
[20]Delorenzi C.Transarterial degradation of hyaluronic acid filler by hyaluronidase[J].Dermatol Surg,2014,40(8):832-841.
Morphological Comparison and Enzymatic Degradation Prof i le of Six Hyaluronic Acid Dermal Fillers
WANG Mu-yao,JIANG Yi-chen,WU Ke-lun,XIE Li,WANG Hang
(Department of Oral and Maxillofacial Surgery,West China College of Stomatology,Sichuan University,Chengdu 610041,Sichuan,China)
Objective To compare the size and shape of particles and enzymatic degradation prof l le in six hyaluronic acid (HA) dermal fl ller products.Methods Six HA dermal fl ller products were studied using staining by toluidine blue, in combination with microscopy. About 0.050 ml of sample was added into a 3cm merit dish containing 2 ml of water and 25 µl of 2% toluidine blue solution. The particles were allowed to stain for about 12 hours before being observed in a microscope. The hyaluronic acids were also exposed to hyaluronidase and photographed at different time points to determine degradation time.Results The microscopic observation confirmed that all the studied filler products contained particles and showed a differentiation in particle size and distribution between the six products. Degradation time differences among all 6 products. Conclusion Although the HA fl llers appear to be similar, their methods of cross-linking technique and manufacture are not the same. Their different ability of resistance to enzymatic degradation is concerned with their physical properties.
dermal fl llers;hyaluronic acid;hyaluronidase;enzymolysis;hyaluronic acid complications
Q946
A
1008-6455(2017)04-0052-04
2017-1-15
2017-04-05
编辑/张惠娟
王杭,女,教授,硕士生导师;四川大学华西口腔医院医疗美容科主任,口腔颌面外科学系副主任;E-mail:dr.hangwang@gmail.com

