药物性肝损伤在慢乙肝基础上的发病特点
邓 兰,Jalil-ur-ReHMAN,唐世刚
(湖南师范大学第一附属医院/湖南省人民医院 感染科,长沙 410006)
药物性肝损伤在慢乙肝基础上的发病特点
邓 兰,Jalil-ur-ReHMAN,唐世刚
(湖南师范大学第一附属医院/湖南省人民医院 感染科,长沙 410006)
目的: 研究慢乙肝基础上药物性肝损伤的临床表现、实验室指标的特点。方法: 采用回顾性分析的方法,收集2012年1月~2014年12月期间在我院诊断为药物性肝损伤患者一般资料、肝功能、凝血酶原时间等,根据乙肝表面抗原检测 (HBsAg) 分为乙肝阳性组和乙肝阴性组 (下文均简写为阳性组、阴性组) ,阳性组38例,阴性组55例。根据不同资料类型进行统计学分析。结果: 93例药物性肝损伤患者中,阴性组和阳性组DILI临床分型均以肝细胞损伤型为主,ALT、黄疸较阴性组高,阳性组发病年龄低于阴性组;阳性组重型肝炎发病率高于阴性组患者;凝血酶原时间、AST、ALP、TB、CB等比较均无明显差异。结论: 慢乙肝基础上的药物性肝损伤对肝脏损伤更重。
药物性肝损伤; 慢乙肝; 发病特点
药物性肝损伤-DILI(Drug-induced liver injury)是指暴露于常规或高剂量药物后,因药物本身或其代谢产物的毒性作用及过敏反应,而导致的肝脏损害,是常见的肝损伤原因之一[1]。DILI通常分为固有型和特异型,固有型损伤与剂量和时间相关; 特异型肝损伤难以预测[2],本文中对DILI的研究主要针对于固有型。
因我国乙肝病毒携带率高,经过多年的预防阻断,乙肝病毒携带者仍有约9000万人,DILI患者中就有1/3的患者合并乙肝感染。DILI的发生无可预测,但合并慢乙肝患者更易诱发,本文为探讨慢乙肝基础上DILI的特异性,分析其临床表现、实验室指标、损伤机制上的特点。
1 资料与方法
1.1 研究对象 2012年1月~2014年12月期间于我院住院治疗93例患者为研究目标人群,入选标准: 有明确的服药史,入院或出院诊断包含“药物性肝损伤”、“药物性肝损害”或“药物性肝炎”; 排除标准: 本次研究只纳入慢乙肝患者,其他病毒性肝炎、自身免疫性肝病及其他原因(包括酒精性脂肪肝、非酒精性脂肪肝)所致肝损伤不纳入研究范畴; 分组: 根据乙肝表面抗原测定(HBsAg)分为乙肝阳性组和乙肝阴性组,阳性组38,阴性组55例。
1.2 数据收集 收集患者的基本资料(年龄、性别、住院天数),疾病史(既往史和过敏史),实验室检查结果(出入院肝功能、凝血功能、病毒标志物)、引起肝损伤可疑药物(药物名称、剂量、使用时间)、临床症状、体征、治疗药物及疗效。
1.3 药物性肝损害的诊断标准 参照2015年中华医学会肝病学会发布的“药物性肝损伤诊治指南”进行药物性肝损伤的诊断。RUCAM评分: 采用WWW. HEPATOX. ORG/RUCAM提供的评分工具进行分值计算[3]。
1.4 临床分型 根据谷丙转氨酶和碱性磷酸酶计算R值(丙氨酸转氨酶(ALT)与碱性磷酸酶(ALP)和各自正常值上限的比值比)。R值>5.0表示肝细胞损伤型,R值<2.0表示胆汁淤积型,R值介于2.0与5.0之间,表示混合型。
1.5 严重度分级 a)轻度: ALT或碱性磷酸酶升高,但是血浆总胆红素<2.5mg/dL,INR<1.5; b)中度: ALT或碱性磷酸酶升高,并且血浆总胆红素≥2.5mg/dL,或INR≥1.5; c)中重度: ALT、碱性磷酸酶、血浆总胆红素和INR升高,且因DILI延长了住院时间; d)重度: ALT或碱性磷酸酶升高,并且血浆总胆红素≥2.5mg/dL,并且伴随以下之一情况发生。肝衰竭(INR≥1.5,腹水,肝性脑病),因DILI引起的其他器官衰竭(肾脏、肺等)(本研究中将中度与中重度均分在中度,以便于计算)。1.6 统计学方法 用SPSS17.0统计软件进行统计学分析。计量资料用t检验,用Mean±SD表示; 计数资料用卡方检验,等级资料用Wilcoxon检验,危险因素分析用Logistic回归分析。所有假设检验采用双侧检验,取α=0.05。P<0.05者,认为差异有统计学意义。
2 结果
2.1 一般情况 共收集药物性肝损害病例93例,女性53人,男性40人,平均年龄为53.41±11.88岁,好发年龄段为40~60岁。其中阴性组55人(F/M=29/26),平均年龄为56.16±11.75岁; 阳性组38人(F/M=24/14),平均年龄为49.42±11.04岁,阳性组发病年龄低于阴性组(P<0.05)(见表1)。
2.2 临床表现 阳性组中,乏力19例(50.8%),黄疸20例(53.6%),纳差9例(39.9%),其他10例(25.3%); 阴性组: 乏力31例(55.9%),黄疸28例(51.6%),纳差22例(40.9%),其他15例(26.9%)。两组临床表现均以乏力、黄疸、纳差为主,阳性组与阴性组无明显差异。
2.3 临床分型 阴性组肝细胞损伤型33例(60%),胆管细胞型16例(29%),混合型6例(11%); 阳性组肝细胞损伤型20例(53%),胆管细胞型15例(39%),混合型3例(8%)。乙肝阴性DILI和乙肝阳性DILI临床分型均以肝细胞损伤型为主。
2.4 阳性组谷丙转氨酶均数 M=530.89,阴性组谷丙转氨酶均数M=269.36,P=0.008〈0.05,有统计学意义,阳性组谷丙转氨酶高于阴性组; 阳性组谷草转氨酶均数M=375.20,阴性组谷草转氨酶均数M=364.12,P=0.802〉0.05,无统计学意义,两组谷草转氨酶无明显差异(见表1)。
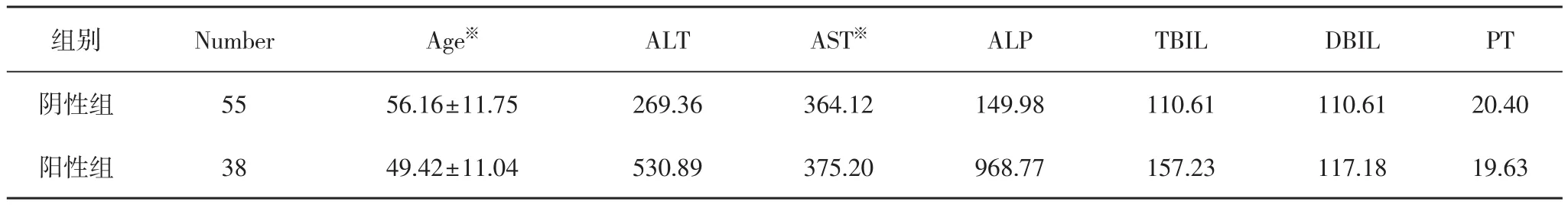
表1 93例药物性肝损伤临床基本特征
2.5 严重程度 阴性组: 轻度22例(40%),中度25例(45.5%),重度8例(14.5%); 阳性组: 轻度14例(36.8%),中度14例(31.8%),重度10例(26.3%)(见表2),对阳性组和阴性组进行Wilcoxon秩和检验,计算检验统计量Z 为-7.757,概率P=0.000<0.05,有统计学意义,阳性组重度肝炎发病(26%)高于阴性组(15%)。

表2 HBsAg阳性组与HBsAg阴性组严重程度比较
2.6 治疗预后 停用导致药物性肝损害相关药物,经过护肝降酶等对症支持治疗后,阴性组改善48例(87.3%),加重4例(7.3%),不变3例(5.5%); 阳性组改善33例(86.8%)加重3例(7.9%),不变2例(5.3%)。DILI一般预后较好,停药并护肝治疗后,实验室指标可恢复正常。93例患者,治疗后ALT、AST均显著下降,阳性组以ALT下降为主,两组AST下降幅度大致相同。
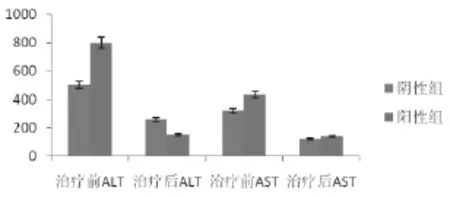
图1 HBsAg阴性组与HBsAg阳性组治疗前后转氨酶比较ALT: 谷丙转氨酶; AST: 谷草转氨酶。
3 讨论
随着医疗卫生事业的发展,新药的研发与应用,DILI的发病率逐年上升,最新统计数据显示,药物性肝损伤约约占住院病人的5%,占肝病住院者的20%,已上升至全球死亡原因第5位[4]。
DILI的发生一般无特异性,大部分患者因乏力、纳差、厌食等非特异性症状前来就医,与其他原因所致肝脏疾病类似。本文93例患者中,阳性组与阴性组均表现为乏力、纳差、黄疸,,主要临床表现无明显差异。对两组患者年龄进行t检验,显示药物性肝损伤好发于40~60岁中老年患者,且女性居多。有文献指出肝脏体积随着年龄增加而减小,女性尤其明显[5],肝脏血流量随肝脏体积减小也降低,肝功能衰退,细胞色素P450酶系活性降低,药物清除率逐年下降,加之老年人血浆蛋白含量较低,药物血浆结合率偏低,且用药机会多[6]。此观点与本研究结论一致,提示我们中老年患者用药应慎重,药物剂量应适当减少。同时,慢乙肝患者DILI的发病年龄相对偏低,是由于乙肝阳性组患者肝脏本身存在无症状炎症坏死,肝脏储备能力下降,出现DILI的机会增加[7]。
药物对肝脏的损害是多因素的,主要可归为两类,第一类是药物的直接或间接肝毒性(固有型肝毒性),与药物剂量密切相关,个体差异不大,具有可预测性。药物摄入后,与肝细胞内P450酶系及一些基团,如葡萄糖醛酸、硫酸酯甲基、巯基、甘氨酸、芳香基等结合,形成极性大、水溶性高的代谢物随胆汁排泄[8]。肝细胞发生功能障碍时,首先受损的是分泌功能,DILI患者血浆中白蛋白含量降低,药物血浆蛋白结合率下降,同时药酶活性和水平下降[9],致使胆汁酸的羟化发生障碍,正常分泌到胆汁的物质蓄积在肝内或血清中,临床上表现为黄疸、瘙痒,实验室指标以胆红素、胆汁酸、碱性磷酸酶等升高。除此之外,临床上常用的用于诊断DILI的生化指标包括谷丙转氨酶(AST)、谷草转氨酶(ALT)、总蛋白、凝血功能,对上述数据进行分析,发现肝脏受损时均有不同程度的升高。第二类是特异质超敏反应(特异型肝毒性),与药物剂量无相关性,患者个体因素、病理状态、联合用药等都在其中起作用[10],本文不予以缀述。
ALT主要分布在肝细胞胞浆中,而80%AST主要存在于肝细胞线粒体中,因损伤机制不同,DILI和慢乙肝ALT、AST上升程度各异。机体感染HBV后,诱导机体产生特异性的体液免疫和细胞免疫应答[11],细胞膜上除含有病毒特异性抗原外,还会引起肝细胞表面自身抗原发生改变,暴露出肝特异性脂蛋白抗原(LSP)[12]。LSP可作为自身抗原诱导机体产生自身抗体,通过ADCC作用(antibody-dependent cell-mediated cytotoxicity,抗体依赖性的细胞介导的细胞毒作用)[13],CTL(cytotoxic lymphocyte,细胞毒性T淋巴细胞)的杀伤作用或释放淋巴因子等直接或间接作用,导致肝细胞损伤,ALT和AST均可升高,但以ALT升高为主,慢乙肝基础上的DILI转氨酶变化,治疗前后均也以ALT变化为最为显著。而药物性肝损伤主要抑制肝内线粒体功能或活化抗体特异性的免疫反应,导致线粒体通透性转变(MPT),直接导致线粒体损伤,AST释放[14],临床上表现为AST升高。本研究通过对93例药物性肝损伤患者ALT、AST、ALP、TB、DB等进行统计学分析,两组间仅 ALT有统计学意义,AST、ALP、TB、CB等比较均无明显差异,提示AST比其他实验室指标意义更大,鉴于药物又可干预胆汁酸的分泌、摄取、肝内转运,破坏毛细胆管的骨架结构等,所以ALP也作为常规检测项目。
药物性肝损伤一般预后好,停药并护肝治疗后,93例患者中81例(87%)好转,5例(5%)不变,7例(8%)病情加重。研究表明,停用致肝损伤药物并辅以护肝治疗,临床症状和实验室指标可完全恢复正常。文献中报道,慢乙肝患者肝组织活检以淋巴细胞浸润为主,有轻微坏死炎症等表现[15]。临床上检测转氨酶、胆红素数值基本正常,或仅轻度升高,容易让人忽略,但不可否认的是,肝损伤一直存在。如果无视慢乙肝患者黄疸的出现,继续使用致肝损伤药物而导致爆发性肝炎,双重打击下,慢乙肝基础上药物性肝损伤通常较单纯急性病毒性肝炎更具有致命性[16]。通过对乙肝阳性组和阴性组的严重程度、预后进行比较,也支持HBsAg阳性为药物性肝炎的危险因素这一论点。
此外,药物性肝损伤易发生漏诊或误诊,给DILI的治疗带来了极大的阻力,除了详细询问病史,仔细鉴别实验室检查指标外,我们还通过Rucam量表(Roussel Uclaf因果关系评估表)来进行辅助DILI的诊断[17]。对本文中选取的93例DILI患者,进行RUCAM评分,98%均大于4分,提示RUCAM诊断药物性肝损伤具有可靠性。经临床和实验室检查仍不能确诊DILI或需进行鉴别诊断时,肝穿刺活检有助于进一步明确诊断和评估病损程度。综述所述,准确的诊断及有效预防才是疾病控制的最佳解决办法。正确的认识乙肝感染与药物性肝损伤之间的联系,深化对该病认识以降低该病的发病率。
[1] 于乐成, 茅益民, 陈成伟. 药物性肝损伤诊治指南[J]. 中国病毒病杂志, 2015(5): 321-341.
[2] Larrey, Dominique. “Epidemiology and individual susceptibility to adverse drug reactions affecting the liver.” Seminars in liver disease. Vol.22. No.02. Copyright© 2002 by Thieme Medical Publishers, Inc. , 333 Seventh Avenue, New York, NY 10001, USA. Tel. : + 1(212) 584-4662, 2002.
[3] 董黛青, 叶英, 李家斌. 两种药物性肝损伤诊断评分标准的临床应用比较[J]. 安徽医科大学学报, 2012, 47(7): 821-824.
[4] Li L, Jiang W, Wang J. Clinical analysis of 275 cases of acute druginduced liver disease[J]. Frontiers of medicine in China, 2007, 1(1): 58-61.
[5] Elinav E, Pinsker G, Safadi R, et al. Association between consumption of Herbalife® nutritional supplements and acute hepatotoxicity[J]. Journal of hepatology, 2007, 47(4): 514-520.
[6] Stine J G, Lewis J H. Drug-induced liver injury: a summary of recent advances[J]. Expert opinion on drug metabolism & toxicology, 2011, 7(7): 875-890.
[7] Fontana R J, Watkins P B, Bonkovsky H L, et al. Drug-induced liver injury network (DILIN) prospective study[J]. Drug Safety, 2009, 32(1): 55-68.
[8] 支杰华, 朱萱. 药物性肝病发病机制的研究进展[J]. 中国实用内科杂志: 临床前沿版, 2006, 26(5): 793-795.
[9] 陈昶铭. 药物性肝损害临床特点的研究[D]. 沈阳: [fJ 国医科大学, 2009: 12-18, 2009.
[10] Martinez M A, Vuppalanchi R, Fontana R J, et al. Clinical and histologic features of azithromycin-induced liver injury[J]. Clinical Gastroenterology and Hepatology, 2015, 13(2): 369-376. e3.
[11] 王学富. 药物诱导肝脏损伤的免疫学机制及人源化小鼠中 B 细胞特性研究[D]. 中国科学技术大学, 2012.
[12] 饶跃峰, 郑飞跃, 张幸国. 药物性肝损伤的免疫学机制[J]. 中国药学杂志, 2008, 43(16): 1207-1210.
[13] 刘祖崇, 刘邦媛, 崔凤笙, 等. 乙型肝炎 ADCC 作用及其血清抑制活性的初步探讨[J]. 重庆医学院学报, 1983, 1: 001.
[14] 秦建伟, 别平, 朱瑾. 线粒体膜通透性转换作用对再灌注损伤后肝细胞调亡的影响[J].2006.
[15] 周福平. 乙型肝炎病毒慢性感染对细胞色素 P450 2C9 表达的影响[D]. 第二军医大学, 2008.
[16] Andrade R J, Lucena M I, Fernández M C, et al. Drug-induced liver injury: an analysis of 461 incidences submitted to the Spanish registry over a 10-year period[J]. Gastroenterology, 2005, 129(2): 512-521.
[17] 陈成伟. 药物性肝损害诊断标准的评价[J]. 诊断学理论与实践, 2009(2): 121-124.
The characteristics of drug-induced liver injury on the basis of chronic hepatitis B
Deng Lan, Jalil-ur-ReHMAN, Tang Shi-gang
(Department of Infectious, Hunan Provincial People’s Hospitol/the First Affiliated Hospital, Hunan Normal University, Changsha 410006, China)
Objective To study the clinical features of drug-induced liver injury in patients with chronic hepatitis B and the characteristics of laboratory indexes. Methods By retrospective analysis method, from January 2012 -2014 year in December in our hospital diagnosed as patients with drug-induced liver injury data, liver function, prothrombin time, according to the detection of hepatitis B surface antigen (HBsAg) were divided into positive group and negative group of hepatitis B hepatitis B (hereinafter abbreviated as positive group and negative group). Positive group 38 cases, 55 cases of negative group. Statisticalanalysis was performed according to different data types. Results 93 cases of drug-induced liver injury in patients with negative group and positive group DILI clinical type in hepatocellular damage type, ALT, jaundice was higher than the negative group , positive group age lower than the negative group; positive group than in negative group the incidence of severe hepatitis patients; prothrombin time, AST, ALP, TB and CB showed no obvious differences. Conclusion Drug induced liver injury on the basis of chronic hepatitis B is more important to liver damage.
drug-induced liver injury; chronic hepatitis B; characteristics
R725.7
A
1673-016X(2017)02-0038-04
2016-01-08
唐世刚,E-mail:sjtangq@163.com

