Tfh细胞相关因子CXCL-13在小细胞肺癌中的作用及临床意义
赵静 游雅婷 钱频 范晔
·论著·
Tfh细胞相关因子CXCL-13在小细胞肺癌中的作用及临床意义
赵静1游雅婷1钱频2范晔1
目的探讨Tfh细胞的趋化因子CXCL-13与SCLC发病及进展的相关性。方法随机收集28例SCLC患者(SCLC组)和38例健康人(对照组)的临床资料和外周血样本,采用ELISA法检测小细胞肺癌(SCLC)患者外周血中滤泡性辅助性T细胞(follicular helper T cells, Tfh)的趋化因子CXC基元配体-13(chemokine C-X-C motif ligand-13, CXCL-13)表达水平,结合临床资料按照性别、年龄、吸烟情况及肿瘤分期进行亚组分析,明确各相关因素与SCLC的关系。结果SCLC组CXCL-13(55.36±5.293)ng/L明显高于对照组(28.71±2.671)ng/L,P<0.0001;在SCLC组中年龄、性别及吸烟史差异对CXCL-13表达没有显著差异:男性(53.52±5.759) ng/L、女(64.59±14.08) ng/L,P=0.4995;年龄<55岁(50.08±6.945)ng/L、年龄≥55岁(58.01±7.184) ng/L,P=0.4347; 吸烟<200年支(62.59±8.975) ng/L、吸烟≥200年支(68.09±4.128) ng/L,P=0.5854。而在SCLC组与对照组的对比中,各因素对CXCL-13的表达均有一定的影响,女性(9.976±1.534 ng/L,64.59±14.08 ng/L,P=0.0028),男性(31.07±3.778 ng/L,53.52±5.759 ng/L,P=0.0023);年龄<55岁(27.77±2.987 ng/L,50.08±6.945 ng/L,P=0.0121),年龄≥55岁(31.75±6.096 ng/L,58.01±7.184 ng/L,P=0.01);吸烟<200年支(28.15±2.723 ng/L,62.59±8.975 ng/L,P=0.0028);吸烟≥200年支(28.86±7.312 ng/L,68.09±4.128 ng/L,P=0.0005)。SCLC组中,不同肿瘤分期的CXCL-13表达有显著差异,(31.07±2.37 ng/L,57.18±5.919 ng/L,P=0.0003)。结论在SCLC患者的外周静脉血中CXCL-13的表达水平与健康对照组有显著差异,且与性别、年龄、吸烟情况有密切关系,同时肿瘤分期越晚的患者,其CXCL-13的表达水平越高。CXCL-13作为Tfh的趋化因子,对SCLC的早期临床诊断和预后判断有潜在的临床意义。
小细胞肺癌; CXCL-13; Tfh; 临床意义
肺癌是起源于支气管黏膜或腺体的恶性肿瘤,发病率为肿瘤的首位。每年有数百万的人死于肺癌[1-3]。组织病理学分型分为小细胞肺癌(small cell lung cancer, SCLC)和非小细胞肺癌(non-small cell lung cancer, NSCLC)[4]。SCLC是其中恶性程度最高的一种,且由于早期诊断困难致使患者的疗效不佳,预后较差。目前随着诊断方法进步、规范有序的诊断、分期、新化疗药物以及靶向治疗药物的出现,以及以肺癌生物学行为为依据的多学科联合治疗的不断进步,SCLC患者的生存率有所提高。然而,想要进一步提高该患者群的生存率,仍有赖于早期诊断和规范治疗[5-6]。目前,肺癌病因和发病机制尚未明确,对于发病机制及其相关影响因素的研究探索,是引领肺癌治疗突破的重要方向。近年来,肿瘤间质中浸润的炎性细胞及其趋化因子在肺癌发生和进展中的地位愈加得到肯定。滤泡性辅助性T细胞(follicular helper T cells, Tfh)是近期发现的一种特殊的辅助性T淋巴细胞[7],定位于淋巴滤泡,属于CD4+T细胞亚群[8-9],表达 趋化因子CXC基元配体-13(chemokine C-X-C motif ligand-13, CXCL-13)、白细胞介素-21(interleukin-21, IL-21)、 程序性细胞死亡-1(programmed cell death-1, PD-1)、B细胞淋巴瘤-6(B cell lymphoma-6, Bcl-6)等表面分子,它们对Tfh细胞的迁移、定位、分化、发育等起重要的辅助作用[10-13]。研究表明,Tfh细胞与多种疾病的发生有关,包括自身免疫性疾病、免疫缺陷、感染性疾病和肿瘤(包括NSCLC)等[9, 14-17]。然而Tfh细胞及其相关细胞因子与SCLC的相关性目前未见明确的报道。对Tfh相关细胞因子与SCLC的相关性的临床探索,可以促进我们对SCLC的发生、发展机制的新理解,并可能为SCLC的早期诊断与创新治疗的新靶位点提供新思路[18-20]。本研究以SCLC患者及健康人作为研究对象,通过检测和对比患患者群及健康对照组外周血中CXCL-13的表达水平[21-22],并结合临床资料探讨Tfh细胞趋化因子CXCL-13与SCLC发生发展的关系。
材料与方法
一、临床资料
随机选取第三军医大学新桥医院呼吸内科住院患者,并经病理学证实的SCLC患者28例作为SCLC组。其中男性23例,女性5例;年龄小于55周岁10例,年龄大于或等于55周岁18例;吸烟数小于200年支13例,大于200年支15例;有转移情况23例,无转移情况5例;肿瘤Ⅰ期1例,Ⅱ期3例,Ⅲ期4例,Ⅳ期20例。随机选取第三军医大学新桥医院体检中心体检健康人38例,作为对照组,其中男性20例,女性18例,年龄小于55周岁29例,年龄大于或等于55周岁9例,吸烟数小于200年支30例,大于200年支8例。两组性别、年龄、吸烟史比较有统计学意义(P<0.05),所有研究对象均被告知研究内容,并签署知情同意书。
二、研究方法
所有研究对象均为早上空腹(住院患者为入院当日治疗前),用红头管(含促凝剂)抽取肘部静脉血约4 ml,室温静置自凝30 min后,以离心半径8 cm,3 000 r/min,离心 10 min,取上清后于-80摄氏度冰箱保存,检测前所有标本于4度冰箱融化后再放置室温完全溶解,检测CXCL-13表达水平。采用酶联免疫吸附法(ELISA法)检测各组患者外周血中CXCL-13的表达水平,试剂盒由R&D公司生产,并按试剂盒操作说明书进行操作。
三、统计学方法
统计学处理采用SSPS20.0统计软件包,通过t检验、列联表ANOVA、方差分析等比较各组差异。P<0.05为差异有统计学意义。
结 果
一、两组外周血中CXCL-13水平比较
SCLC患者组血清的CXCL-13水平较健康对照组有明显增高(55.36±5.293 ng/L,28.71±2.671 ng/L),P<0.0001(图1A)。同时发现,将总体人群分别按照性别、年龄以及吸烟情况各亚组比较,CXCL-13的水平没有统计学意义,数据分别是性别亚组(43.27±3.910 ng/L,34.24±5.189 ng/L),年龄亚组(49.86±5.720 ng/L,37.62±3.198 ng/L),吸烟情况亚组(53.18±1.318 ng/L,43.1±3.761 ng/L),见图1B、C、D。
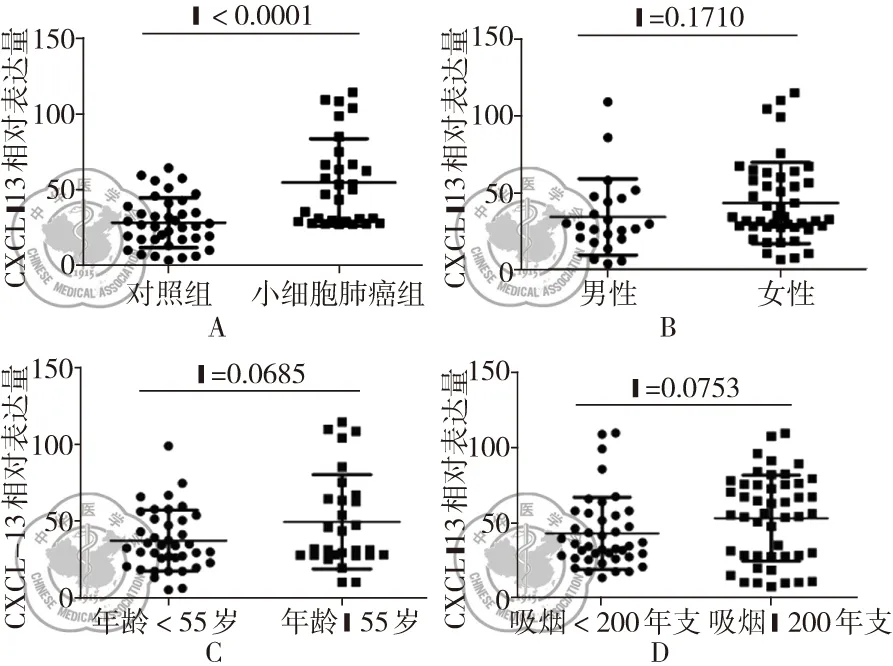
图1 SCLC组和健康对照组的CXCL-13的表达水平的比较
二、两组各亚组CXCL-13表达水平的比较
按年龄、性别及吸烟情况3个亚组比较了CXCL-13在SCLC组与对照组之间表达水平的差异,显示不同性别、年龄及吸烟情况的SCLC患者的外周血CXCL-13水平与相应对照组相比,均存在显著的统计学差异,见图2A、B、C、D、E、F。
三、SCLC组中CXCL-13与肿瘤临床分期的相关性
为进一步探索Tfh的特异性趋化因子CXCL-13与SCLC临床分期之间的关联,本实验按照患者的TNM临床分期进行分析,分别检测和统计各组SCLC患者中外周血的CXCL-13表达水平。CXCL-13的表达水平与单一临床肿瘤分期之间不存在显著的统计学差异(图3A,表1)。然而,将Ⅰ期和Ⅱ期合并,Ⅲ期和Ⅳ期合并之后,再次分析发现,CXCL-13的血清学表达水平与临床分期有着显著的统计学差异(31.07±2.37 ng/L,57.18±5.919 ng/L,P=0.0003)(图3B)。
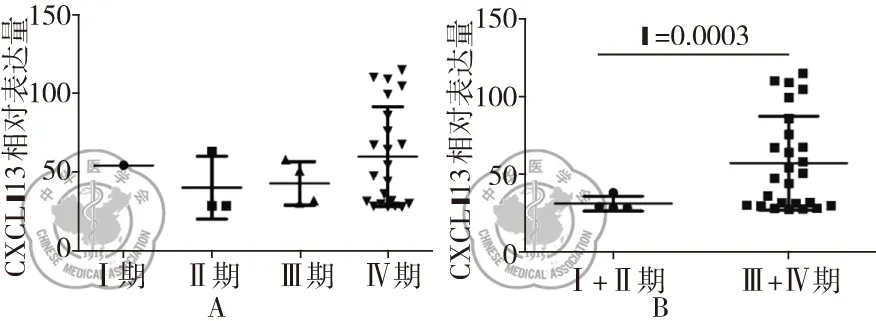
图3 CXCL-13的表达与肺癌分期的关系
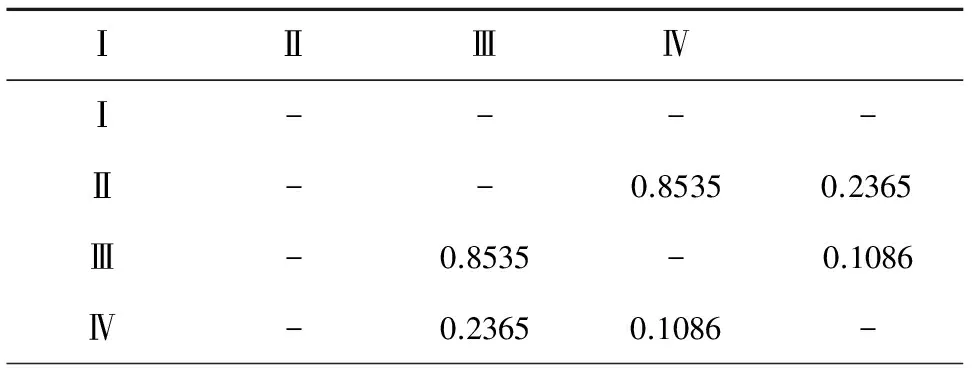
表1 不同肿瘤分期病人两两检验P值表
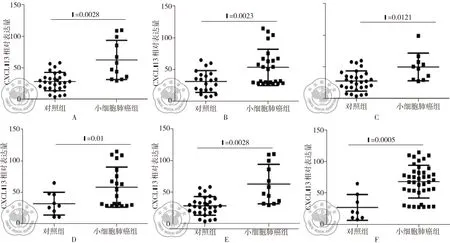
图2 SCLC组与健康对照组各亚组CXCL-13表达水平的比较
四、SCLC组中各亚组血清CXCL-13表达水平的比较
分别按照性别、年龄以及吸烟情况3个亚组进一步分析血清CXCL-13表达的情况,发现在SCLC组各亚组中,各亚组血清中CXCL-13表达水平无显著差异(P>0.05)。分别为A性别:(53.52±5.759 ng/L,64.59±14.08 ng/L),B年龄:(50.08±6.945 ng/L,58.01±7.184 ng/L),C吸烟情况:(62.59±8.975 ng/L,68.09±4.128 ng/L),见图4A、B。

图4 SCLC患者中各亚组CXCL-13的表达
讨 论
肺癌是当今世界发病率最高的恶性肿瘤之一,它严重威胁着人类的健康和生命[23-25]。在世界上许多国家,肺癌的发病率都出现了明显增高的趋势[26-28]。而在中国的很多城市,肺癌患者的数量在各种恶性肿瘤患者中更是达到了第一位。有研究统计,到2025年,我国每年因为肺癌而死亡的人数将达到约90万人。现在,肺癌已经不像过去那样被人们认为是一种少见的疾病了,肺癌与艾滋病已被世界卫生组织报告为是21世纪对人类健康威胁最大的两种常见的疾病。因此,对肺癌的发病机制、发生发展影响因素以及诊疗措施的研究刻不容缓,这也成为当今医学发展进程中一个热门命题。肺癌按照病理组织分型可以分为SCLC和NSCLC。目前,对于NSCLC的发病机制以及诊疗方法的研究已经较为丰富。而对于SCLC,它是一种高度恶性的肿瘤,临床病情进展明显快于NSCLC,其发病率占所有肺癌的10%~25%,占肺神经内分泌肿瘤的80%~90%。SCLC病情发展迅速,恶性程度高,预后较差,虽然其对放化疗敏感,手术联合放化疗等综合治疗极大提高了早期SCLC患者的生存时间,但由于目前对SCLC的发病机制不是十分清楚,其早期诊断和规范治疗仍受到了极大的限制。所以,进一步探究SCLC的发病机制将有助于该疾病的早期诊治,对提高SCLC患者的生存率也有着极其重要的临床意义。CXCL-13、IL-2、PD-1、Bcl-6等表面分子,对Tfh细胞的迁移、定位、分化、发育等起重要的辅助作用。研究表明,循环Tfh细胞在人类自身免疫性疾病和癌症中可作为诊断和判断预后的生物学标志物。本实验主要研究的是Tfh细胞趋化因子CXCL-13在SCLC发生发展中的作用及其临床意义。
本研究发现:(1)CXCL-13在SCLC组中的表达水平明显高于健康对照组。在以总人群为研究对象时,我们将其分为3组,即男性与女性相对照、年龄小于50岁与大于等于50岁相对照、吸烟小于200年支与大于等于200年支相对照,发现CXCL-13的表达水平均无显著统计学差异。并可以排除实验过程中因为年龄、性别以及吸烟程度对本实验发现的影响,从而可以得出:在SCLC患者中,CXCL-13作为Tfh细胞标志性的趋化因子,其表达水平明显高于健康人群;(2)分别将SCLC组和健康对照组按照年龄、性别、吸烟情况进行分组分析,分别比较CXCL-13的表达水平,发现各亚组中,CXCL-13的表达水平均有显著的统计学差异,SCLC组CXCL-13表达水平明显高于健康组。这进一步排除了年龄、性别以及吸烟情况对本实验结果的影响,更有力地证明了(1)中的结论;(3)同时,检测了不同TMN分期的SCLC患者外周血的CXCL-13表达水平,发现不同TMN肿瘤分期的SCLC患者的CXCL-13表达水平存在显著统计学差异,进一步分析发现,分期越晚的SCLC患者外周血中CXCL-13表达水平越高。由此推测,CXCL-13与SCLC的发生有着明显的相关性;(4)最后,将实验中的所有SCLC患者按照年龄、性别、吸烟情况进行分组,分别分析CXCL-13在各组的表达水平。发现不同年龄、不同性别以及不同吸烟情况的SCLC患者的CXCL-13表达水平没有显著性统计学差异。
综上所述, Tfh细胞趋化因子CXCL-13在SCLC患者的表达水平是呈显著增高的,且增高水平与肺癌分期相关,分期越高,其表达水平越高。这提示Tfh细胞趋化因子CXCL-13与SCLC的恶性程度有确切的相关性,并且可能在SCLC的发生发展中起一定的促进作用。根据实验结论,或许将来可以通过检测患者外周血中的CXCL-13来帮助早期发现及诊断SCLC,同时也可以根据CXCL-13的表达水平,结合影像学资料以及其他辅助检查对SCLC患者进行预后的初步判断。本实验结果为下一步明确CXCL-13在SCLC中的具体作用机制奠定了必要的基础条件。同时,研究还提示,Tfh细胞在SCLC的发病中可能发挥着重要作用。除了CXCL-13以外,Tfh其他相关分子也可能扮演着十分重要的角色,然而其具体功能和相关机制尚有待进一步深入研究。
1 任成山, 白莉, 钱桂生. 慢性阻塞性肺疾病合并肺癌临床特征及新理念[J/CD]. 中华肺部疾病杂志(电子版), 2015, 8(2): 137-142.
2 王会中, 任成山, 金发光. 肿瘤生物标志物在肺癌患者检测中的临床意义及研究进展[J/CD]. 中华肺部疾病杂志(电子版), 2016, 9(3): 329-333.
3 Lawrence RE, Salgia R, MET molecular mechanisms and therapies in lung cancer[J]. Cell Adh Migr, 2010, 4(1): 146-152.
4 Liang Y, Tian B, Zhang J, et al. Tumor-targeted polymeric nanostructured lipid carriers with precise ratiometric control over dual-drug loading for combination therapy in non-small-cell lung cancer[J]. Int J Nanomedicine, 2017, 12: 1699-1715.
5 Hamilton G, Rath B, Ulsperger E. How to target small cell lung cancer[J]. Oncoscience, 2015, 2(8): 684-692.
6 Zhou T, Hong S, Hu Z, et al. A systemic inflammation-based prognostic scores (mGPS) predicts overall survival of patients with small-cell lung cancer[J]. Tumour Biol, 2015, 36(1): 337-343.
7 Saavedra D, Garcia B, Lage A. T cell subpopulations in healthy elderly and lung cancer patients: Insights from cuban studies[J]. Front Immunol, 2017, 8: 146.
8 Johnston RJ, Poholek AC, DiToro D, et al. Bcl6 and blimp-1 are reciprocal and antagonistic regulators of T follicular helper cell differentiation[J]. Science, 2009, 325(5943): 1006-1010.
9 Ma CS, Suryani S, Avery DT, et al. Early commitment of naive human CD4(+) T cells to the T follicular helper (T(FH)) cell lineage is induced by IL-12[J]. Immunol Cell Biol, 2009, 87(8): 590-600.
10 Akiba H, Takeda K, Kojima Y, et al. The role of ICOS in the CXCR5+ follicular B helper T cell maintenance in vivo[J]. J Immunol, 2005, 175(4): 2340-2348.
11 Rasheed AU, Rahn HP, Sallusto F, et al. Follicular B helper T cell activity is confined to CXCR5(hi)ICOS(hi) CD4 T cells and is independent of CD57 expression[J]. Eur J Immunol, 2006, 36(7): 1892-1903.
12 Bauquet AT, Jin H, Paterson AM, et al. The costimulatory molecule ICOS regulates the expression of c-Maf and IL-21 in the development of follicular T helper cells and TH-17 cells[J]. Nat Immunol, 2009, 10(2): 167-175.
13 Pangault C, Amé-Thomas P, Ruminy P, et al. Follicular lymphoma cell niche: identification of a preeminent IL-4-dependent T(FH)-B cell axis[J]. Leukemia, 2010, 24(12): 2080-2089.
14 Ito T, Hanabuchi S, Wang YH, et al. Two functional subsets of FOXP3+ regulatory T cells in human thymus and periphery[J]. Immunity, 2008, 28(6): 870-880.
15 Shi W, Li X, Cha Z, et al. Dysregulation of circulating follicular helper T cells in nonsmall cell lung cancer[J]. DNA Cell Biol, 2014, 33(6): 355-360.
16 Zhou DM, Xu YX, Zhang LY, et al. The role of follicular T helper cells in patients with malignant lymphoid disease[J]. Hematology, 2017, doi: 10.1080/10245332.2017.1300623.
17 Ma QY, Huang DY, Zhang HJ, et al. Function of follicular helper T cell is impaired and correlates with survival time in non-small cell lung cancer[J]. Int Immunopharmacol, 2016, 41: 1-7.
18 Hamilton G, Rath B, Smoking. inflammation and small cell lung cancer: recent developments[J]. Wien Med Wochenschr, 2015, 165(19-20): 379-386.
19 Sheng SY, Gu Y, Lu CG, et al. The distribution and function of human memory T cell subsets in lung cancer[J]. Immunol Res, 2017, doi: 10.1007/s12026-016-8882-y.
20 Jiang W, Zhang W, Wu L, et al. MicroRNA-related polymorphisms in PI3K/Akt/mTOR pathway genes are predictive of limited-disease small cell lung cancer treatment outcomes[J]. Biomed Res Int, 2017, 2017: 6501385.
21 Chen L, Huang Z, Yao G, et al. Erratum to: The expression of CXCL13 and its relation to unfavorable clinical characteristics in young breast cancer[J]. J Transl Med, 2016, 14(1): 318.
22 Hui W, Zhao C, Bourgoin SG. LPA Promotes T cell recruitment through synthesis of CXCL13[J]. Mediators Inflamm, 2015, 2015: 248492.
23 Yuan F, Si-Ning C, Ji-Hong Z, et al. Clinical study of lung-supplementing and stasis-dissolving decoction (Bufei Huayu Tang) combined with gefitnib for treatment of advanced non-small cell lung cancer[J]. Pak J Pharm Sci, 2016, 29(6(Special)): 2185-2189.
24 Morrison EJ, Novotny PJ, Sloan JA, et al. Emotional problems, quality of life, and symptom burden in patients with lung cancer[J]. Clin Lung Cancer, 2017, doi: 10.1016/j.cllc.2017.02.008.
25 Ferguson MK, Huisingh-Scheetz M, Thompson K, et al. The influence of physician and patient gender on risk assessment for lung cancer resection[J]. Ann Thorac Surg, 2017, doi: 10.1016/j.athoracsur.2017.01.066.
26 Zhou D, Tang W, Liu X, et al. Clinical verification of plasma messenger RNA as novel noninvasive biomarker identified through bioinformatics analysis for lung cancer[J]. Oncotarget, 2017 ,doi: 10.18632/oncotarget.16701.
27 Zhao F, Zhou Y, Ge PF, et al. A prediction model for lymph node metastases using pathologic features in patients intraoperatively diagnosed as stage I non-small cell lung cancer[J]. BMC Cancer, 2017, 17(1): 267.
28 Sateia HF, Choi Y, Stewart RW, et al. Screening for lung cancer[J]. Semin Oncol, 2017, 44(1): 74-82.
(本文编辑:黄红稷)
赵静,游雅婷,钱频,等. Tfh细胞相关因子CXCL-13在小细胞肺癌中的作用及临床意义[J/CD]. 中华肺部疾病杂志(电子版), 2017, 10(2): 178-182.
Role and clinical significance of Tfh cell associated factor CXCL-13 in the pathogenesis of small cell lung cancer
ZhaoJing1,YouYating1,QianPin2,FanYe1.
1DepartmentofRespiratoryDiseases,XinqiaoHospital,ThirdMilitaryMedicalUniversity,Chongqing, 400037,China;2InstituteofRespiratoryDiseasesofPLA,XinqiaoHospital,ThirdMilitaryMedicalUniversity,Chongqing, 400037,China
FanYe,Email:fygan2007@163.com
Objective To detect expression levels of follicular helper T cells (follicular helper T cells, Tfh) chemokine C-X-C motif ligand-13 (CXCL-13) in small cell lung cancer (SCLC) patients and healthy human peripheral blood, to investigate the interaction between Tfh cells chemokine CXCL-13 and SCLC in the pathogenesis and progression. Methods It was randomly collected that the clinical data and peripheral blood samples of 28 cases of SCLC patients (SCLC group) and 38 healthy people (control group), Tfh cell chemokine CXCL-13 was detected by ELISA assay in peripheral blood, combined with clinical data, according to gender, age, smoking status and tumor stage subgroup analysis, clear the relationship between the related factors and SCLC. Results SCLC group CXCL-13 (55.36±5.293) ng/L was significantly higher than the control group (28.71±2.671 ng/L),P<0.0001; in the SCLC group, age, sex and smoking history differences on the expression of CXCL-13 had no significant difference: male(53.52 ± 5.759) ng/L, female (64.59 ± 14.08) ng/L,P=0.4995; aged <55 years old (50.08±6.945)ng/L, aged≥55 years old (58.01±7.184)ng/L,P=0.4347; smoking<200 years (62.59±8.975)ng/L, smoking≥200 years (68.09±4.128)ng/L,P=0.5854. And in contrast to the SCLC group and the control group, the influencing factors on CXCL-13 expression were female (9.976±1.534, 64.59±14.08 ng/L,P=0.0028), male (31.07±3.778 ng/L, 53.52±5.759 ng/L,P=0.0023); age<55 (27.77±2.987 ng/L, 50.08±6.945 ng/L,P=0.0121), aged≥55 years old (31.75±6.096 ng/L, 58.01±7.184 ng/L,P=0.01); smoking<200 years (28.15±2.723 ng/L, 62.59±8.975 ng/L,P=0.0028); smoking≥200 years (28.86±7.312 ng/L, 68.09±4.128 ng/L,P=0.0005). In the SCLC group, the expression of CXCL-13 in different tumor stage had significant difference(31.07±2.37 ng/L, 57.18±5.919 ng/L,P=0.0003). Conclusions The expression level of CXCL-13 in patients with SCLC in peripheral blood were significantly different from those of the healthy control group, and gender, age, smoking status are closely related, and the later stage of tumor patients, the CXCL-13 expression level is higher. CXCL-13, as a chemokine of Tfh, has potential clinical significance in early diagnosis and prognosis of SCLC.
Small cell lung cancer; CXCL-13; Tfh; Clinical significance
10.3877/cma.j.issn.1674-6902.2017.02.013
国家自然科学基金资助项目(81570051)
400037 重庆,第三军医大学新桥医院呼吸内科1400037 重庆,第三军医大学新桥医院野战内科研究所2
范晔, Email: fygan2007@163.com
R734.2,R563
A
2017-03-10)

