DNA条形码技术在金银花和山银花鉴定中的应用
张嘉熙 张 琦 张晓谦 张彦帅
(北京市第九中学 北京 100041)
0 前言
金银花(Lonicera japonica),又名忍冬。 “金银花”一名出自《本草纲目》,由于忍冬花初开为白色,后转为黄色,因此得名金银花。药材金银花为忍冬科忍冬属植物忍冬及同属植物干燥花蕾或带初开的花。山银花与金银花外形十分相像,亲缘关系相近。事实上,山银花指忍冬科的2种植物:菰腺忍冬(Lonicera hypoglauca)、华南忍冬(Lonicera confusa),生于溪边、旷野疏林下或灌木丛中,产于我国南方各地。中医认为金银花性寒而山银花药性热,金银花用于清热解毒、通经活络,而山银花则在某些方面与其功效完全相反。金银花中含有较多的木樨草苷,而山银花几乎不含,此外,山银花中绿原酸的含量略高,这也会导致二者药用功效略有不同[1]。综上所述,有必要对两者进行鉴别。
金银花和山银花为近缘植物,药材的形状特征比较相似,此外,无论是金银花还是山银花,都有许多改良品种,用传统方法鉴别具有一定困难[2]。而DNA条形码技术首先由加拿大动物学家Paul Hebert提出[3],是以 DNA 分类学为基础,利用一段标准DNA序列作为标记,实现快速、准确和自动化的物种鉴定方法。
DNA条形码技术所利用的ITS片段为rDNA上一个片段且ITS区不加入成熟核糖体,有极大保守性,故在进化过程中承受的自然选择压力非常小,能容忍更多的变异。在绝大多数的真核生物中表现出了极为广泛的序列多态性,即使是亲缘关系非常接近的2个种都能在ITS序列上表现出差异,显示最近的进化特征。ITS2是中度保守区域,其保守性基本上表现为种内相对一致,种间差异比较明显。此外ITS序列片段较小、易于分析,目前已被广泛应用于植物属内不同种间或近似属间的系统发育研究中。
1 材料与方法
1.1 材料

表1 材料来源
1.2 试剂 植物DNA提取试剂盒(北京百泰克生物技术有限公司,北京),2×TaqPCR Master Mix(北京百泰克生物技术有限公司,北京)。
1.3 DNA提取
1)将金银花和山银花研磨成粉末状,各取30 mg置于1.5 mL离心管中,加入 550 μL 65℃预热后的Buffer P1和β-巯基乙醇混合液和4 μL RNaseA,剧烈涡旋震荡至形成均匀胶体,室温静置 10 min。 2)加入 130 μL Buffer P2,充分混匀,12 000 r/min离心 3 min。 3)取上清液 200 μL 至分离柱 A,12 000 r/min 离心 3 min。 4)取下液,300 μL Buffer P3,颠倒混匀。加入吸附柱AC,12 000 r/min离心 1 min。5)倒掉废液,加入 500 μL 漂洗液 WB,12 000 r/min离心1 min,弃废液。
将吸附柱AC置于干净离心管中,在吸附膜中间部位加入50 μL洗脱缓冲液EB(提前预热至65℃),室温静置 3 min,12 000 r/min 离心 1 min。
1.4 PCR扩增及测序
ITS2 引物:ITS2F 5′-ATGCGATACTTGGTGTGAAT-3′
ITS3R 5′-GACGCTTCTCCAGACTACAAT-3′
1.5 分光光度法测DNA浓度和纯度
1.5.1 实验原理 组成DNA的碱基均具有一定的吸收紫外线特性,最大吸收值在波长250~270 nm之间,腺嘌呤的最大紫外线吸收值在260.5 nm,碱基与戊糖、磷酸形成核苷酸后其最大吸收峰不会改变,但核酸的最大吸收波长是260 nm,吸收低谷在230 nm。该物理特性为测定核酸溶液浓度提供了基础。
1.5.2 实验仪器 石英比色皿、UV-240紫外分光光度计。
1.5.3 实验过程 1)用EB溶液校准。2)用移液器量取 2.5 μL样本于石英比色皿上测量[4]。
2 结果与分析
2.1 金银花与山银花PCR扩增结果 由图1、图2、表2可以看出提取到适量的目标DNA(500 bp)。

图1 基因组DNA电泳结果
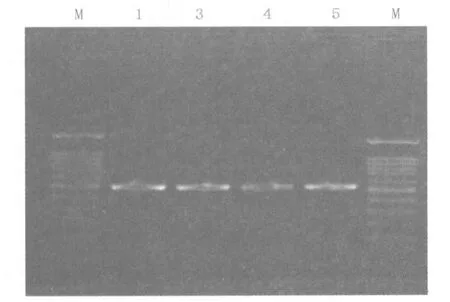
图2 PCR扩增后电泳结果
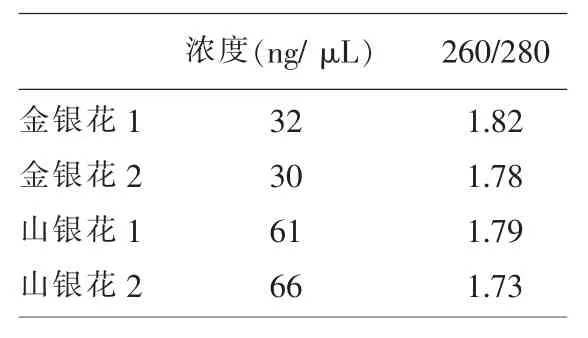
表2 PCR光密度值(检测DNA的浓度和质量)
2.2 金银花与山银花ITS2序列种内种间变异分析
本研究涉及金银花与山银花不同来源的序列共计20条,包括药材样品4条,对照药材样品16条,药材序列长度均为228 bp,其他序列长度为221~228 bp。金银花G+C的含量为75.4%,华南忍冬G+C的含量为73.7%,菰腺忍冬为71.9%,如表3。
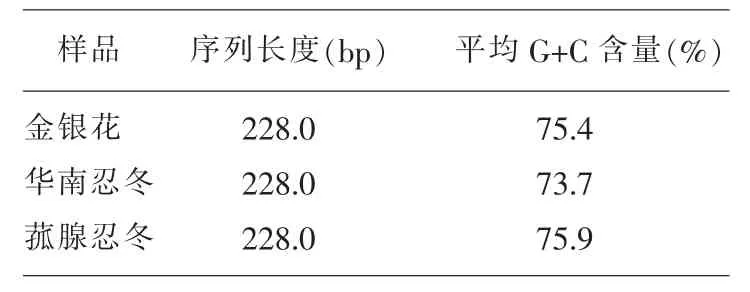
表3 G+C含量
金银花种内 K2P遗传距离[5]0.0393。山银花种内遗传距离为0.0296和0.0424。山银花与金银花的K2P遗传距离为:0.0364和0.0523。种间最小遗传距离不都大于种内遗传距离,见表 4。
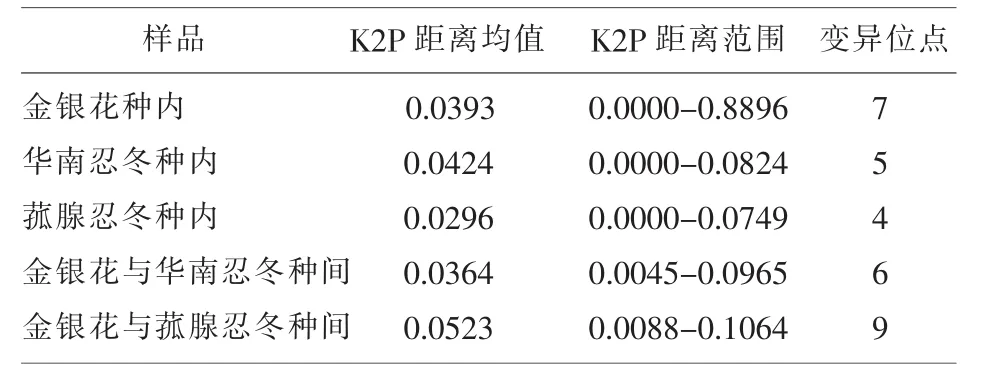
表4 K2P遗传距离

图3 基于ITS2序列构建的NJ树
3 讨论
山银花种类繁多,形态类似。由于山银花存在不同种类,本实验选取菰腺忍冬和华南忍冬,其中C4、C5为菰腺忍冬。根据上述结果可发现,药材山银花不同基原物种在NJ树上混杂在一起,难以明显区分。而金银花与山银花位于不同组,由此可推测金银花山银花之间是存在一定区别的。在渐变式物种形成中,体现了2步遗传差异——第1步是种群间的随机遗传分化,第2步是隔离促成的群体间生殖隔离。在遗传分化上,第2步可能并不多(尽管是生殖隔离完成的一步),其涉及的常是与生殖有关的“关键少数”基因,从而解释金银花种内和华南忍冬种内遗传距离大于金银花与华南忍冬种间遗传距离的现象。
理想的DNA条形码应满足以下几个标准:①具有可以区分物种的足够变异和分化,同时种内变异必须足够小;②有高度保守的引物设计区以便于设计通用引物;③片段足够短,以便于DNA提取和PCR扩增,尤其是对部分降解的DNA的扩增[6]。通过分析实验结果可知,一些金银花样品与山银花样品区分度较低,这说明仅通过ITS2序列不能测定所有种类的金银花与山银花,即ITS2序列并不适宜鉴定所有种类山银花与金银花。ITS、matK、tmL-tmF序列也可鉴别金银花及其易混品,rps16也有较好的DNA条形码应用前景,可作为金银花及其易混品分子鉴别的DNA条形码候选序列。
由于金银花与山银花的ITS序列变异位点太多且繁杂,所以对于这二者的鉴定,ITS2序列可以起到一定作用,但最好结合其他序列和鉴定方法,这样的区分将更加精准有效。
主要参考文献
[1]黄位猛.金银花与山银花的鉴别.广东职业技术教育与研究,2015(2):191.
[2]杨翠玲.易混品金银花与山银花的鉴别.山西中医学院学报,2006,7(4):48.
[3]Hebert P D,Cywinska A,Ball S L.Biological identifications through DNA barcodes.Proceedings of the Royal Society B,2003,270(1512):313.
[4]周建国,马双姣,黄玉龙,等.种子类药材补骨脂及其混伪品的ITS2条形码序列鉴定.世界中医药,2016,11(5):786.
[5]Kimura M.A simple method for estimating evolutionary rates of base substitutions through comparative studies of nucleotide sequences.Journal of Molecular Evolution,1980,16(2):111.
[6]闫华学,于杰.DNA条形码技术在植物中的研究现状.植物学报,2010,45(1):102.

