“PCR扩增DNA片段及凝胶电泳鉴定”实验的突破
张 瑾 (北京市第四中学 北京 100034)
1 问题的提出
高中生物学课程标准的内容标准中,要求组织学生“尝试PCR(DNA聚合酶链式反应)技术的基本操作和应用”,建议开展“用某个DNA片段进行PCR扩增”的实验活动。为此,浙科版教材设有“DNA片段的PCR扩增”实验。该实验有助于学生理解PCR反应的原理,掌握PCR和琼脂糖凝胶电泳技术,认同现代生物技术的应用价值。教材中使用亚甲基蓝溶液对电泳后的凝胶进行染色,亚甲基蓝基本无毒,能将无色的DNA染成蓝色,染色结果稳定且肉眼可见,染液可回收和反复利用。
但是,本实验选用的实验材料是市售的λ噬菌体DNA或大肠杆菌,前者较为昂贵,后者需进行培养。该实验流程约为3课时,其中的电泳和染色需安排2节课连堂,教师调课有困难。此外,教材对实验数据的处理也没有具体要求,通过实验培养学生理性思维的预期目标也难以实现。
2 实践中探索
针对以上问题,笔者在近年的教学实践中逐步对该实验进行了探索,具体如表1。
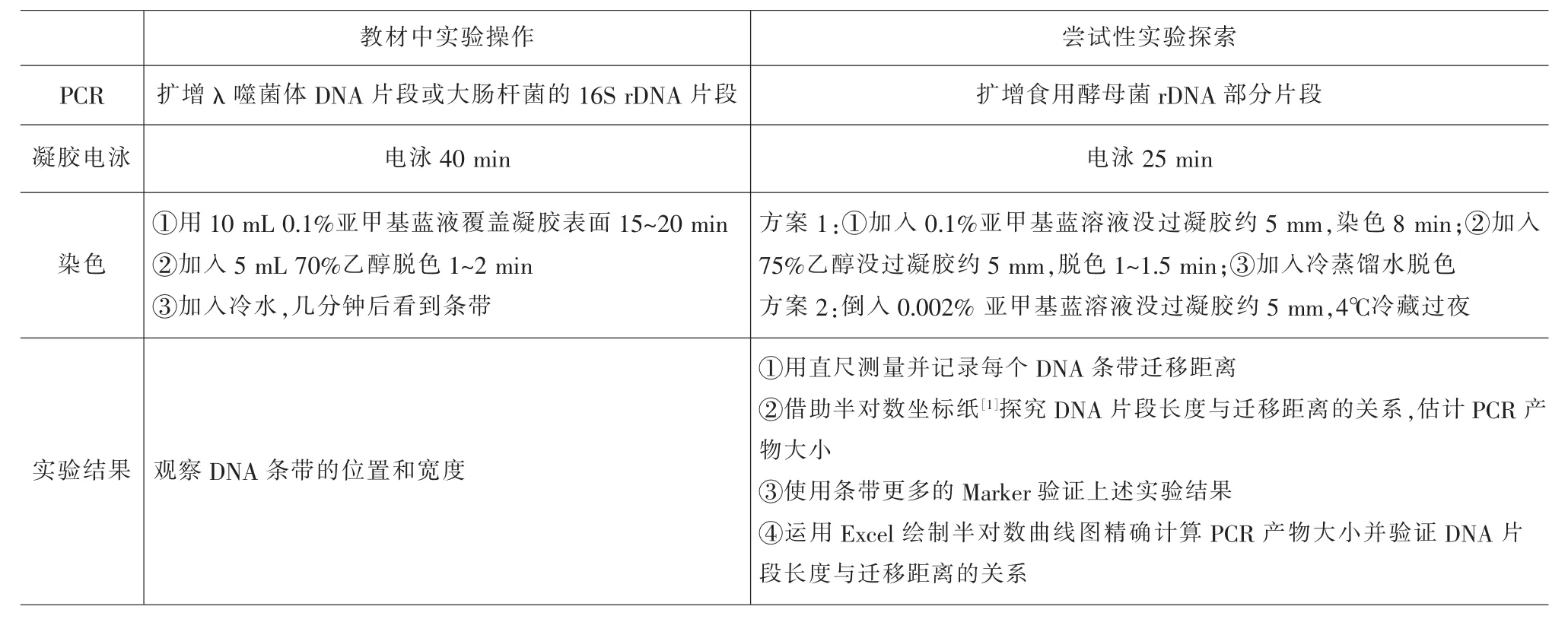
表1 实验改进前、后对比表
2.1 以酵母菌为实验材料 为了便于实验准备,笔者将实验材料改为超市购买的食用高活性干酵母(酿酒酵母),并将其制成酵母细胞悬液。具体操作是:称取0.1 g干酵母粉,放于盛有100 mL无菌水的三角瓶中,盖上封口膜用皮筋绑好,摇匀后在温暖环境下活化2 h即可。
2.2 简化实验步骤
1)PCR扩增酵母细胞的核糖体DNA(rDNA)部分片段。酵母细胞中编码核糖体18S rRNA、5.8S rRNA、25S rRNA的3个DNA序列,中间相隔2个内转录间隔区(internal transcribed spacer,ITS)。 成熟的核糖体RNA中不包括ITS序列,因此自然选择压力较小,能容忍更多变异。此外,ITS序列拷贝数高,长度多在1 000 bp以内,容易被PCR扩增。PCR扩增ITS序列,不仅可以鉴定病原真菌,筛选酿酒的酵母菌株,还可以通过测序和比对不同物种的序列建立进化树,体现了PCR技术在医疗、工业和进化研究上的应用价值。
本实验使用真菌通用ITS引物(ITS1引物和ITS4引物)扩增5.8S rDNA及其两端的2个ITS的全部序列,以及相邻的18S rDNA和25S rDNA的部分序列,总长度为841 bp。引物A(ITS1引物)序列为 5′-TCCGTAGGTGAACCTGCGG-3′。 引物 B(ITS4引物)序列为 5′-TCCTCCGCTTATTGATATGC-3′[2]。实验所用扩增缓冲液、dNTP、TaqDNA聚合酶和引物均为市售产品。

图1 核糖体DNA部分片段示意图
PCR具体步骤为:使用微量移液器将PCR反应体系(见表2)各成分加入到0.2 mL已灭菌的微量离心管中。阴性对照则是用无菌水代替酵母细胞悬液。切记不可加入过多酵母,否则细胞壁会影响PCR效果;且酵母细胞悬液需摇匀后再吸取。反复吹吸使反应液混合均匀,以3 000 r/min的转速离心30 s,使反应液集中于微量离心管的底部。将微量离心管放入PCR仪中,反应条件参数设置如图2。扩增后的PCR产物可贮存于-20℃冰箱中。
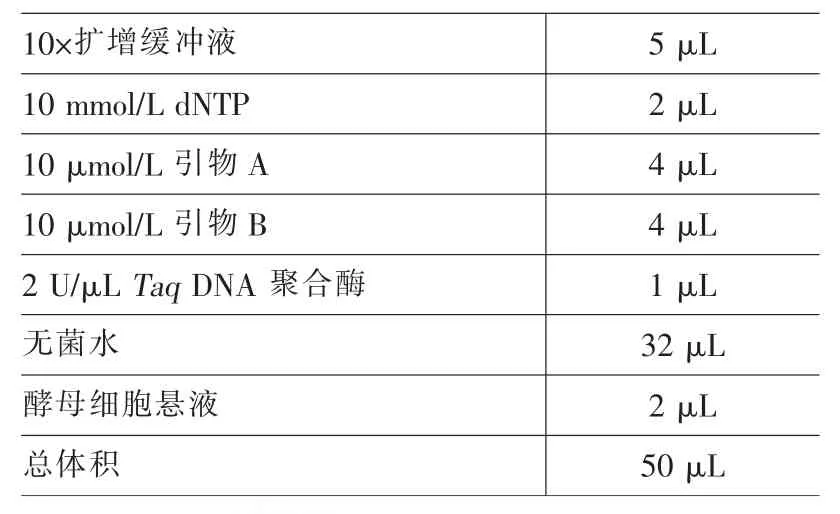
表2 PCR反应体系配方
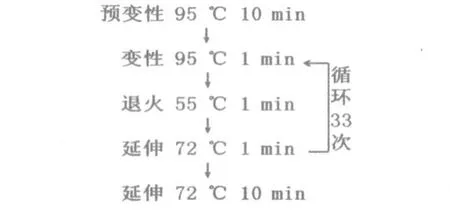
图2 PCR反应条件流程图
2)缩短凝胶电泳时间。教材上是80 V电压下电泳40 min,现压缩到25 min即可看到PCR产物和Marker条带。具体操作方法是:①制备琼脂糖凝胶:称取琼脂糖0.25 g加到盛有25 mL电泳缓冲液的三角瓶中(电泳缓冲液为市售50×TBE电泳缓冲液加蒸馏水稀释而成。5×TBE电泳缓冲液制备方法为:称取54 g Tris,27.5 g硼酸溶于800 mL蒸馏水中,加入 20 mL 0.5 mol/L EDTA,调节 pH至 8.0,加水定容至1 L,室温保存备用)。盖上封口膜并用橡皮筋绑住;用微波炉加热1 min,使琼脂糖熔化呈透明;倒入胶盒,注意避免产生气泡。待凝胶完全凝结,小心拔出梳子,将其从胶盒中取出,放入电泳槽内,加样孔一端朝向负极。向电泳槽中加入电泳缓冲液,并没过凝胶。②加样:用微量移液器向50 μL PCR产物中加入 10 μL 6×上样缓冲液,并反复吹吸混合均匀。将10 μL和20 μL样品混合液分别缓慢加到2个加样孔内。阴性对照组方法同上,加样 10 μL。 将 20 μL DNA Marker 与4 μL 6×上样缓冲液混合均匀,全部加到加样孔内;若市售DNA Marker已含有上样缓冲液,则无需混合,直接加样25 μL。每次加样需更换1个枪头。尽量避免使用最外侧的加样孔,其染色效果有时不理想。③电泳:盖上电泳槽盖,连接好电极插头后再接通电源。将直流电泳仪电源的电压设置成80 V,电泳25 min。注意观察溴酚蓝不要迁移出凝胶。
2.3 优化染色方案 教材中的3步染色法,操作时间较长。笔者通过反复实践,提出2种可行的染色方案,既确保实验效果理想,又能满足教师的不同排课需求。
染色方案1:压缩并改进3步染色法,1课时完成电泳和染色。具体方法是:①将凝胶放入培养皿里,倒入0.1% 亚甲基蓝溶液没过凝胶约5 mm,染色8 min。轻轻晃动培养皿,让染液进入凝胶下表面与培养皿之间,不要留有气泡。染色后回收染液,染液需避光保存。②倒入75%乙醇没过凝胶约5 mm,不断晃动培养皿1~1.5 min。再倒去乙醇。③加入冷的蒸馏水进行脱色,当出现清晰的蓝色条带时,倒去蒸馏水终止脱色。此过程中可更换被染蓝的蒸馏水。此外,凝胶在蒸馏水中不宜浸泡过久,否则条带颜色变淡直至无色。
上述方案主要改进之处有:将染色时间从“15~20 min”压缩为“8 min”,因电泳时间已经从“40 min”压缩到“25 min”,从而 1 课时就可以完成电泳、染色和观察,较原有方案减少了1课时,同时染色结果十分清晰(如图3)。染色时间缩短之后,染液的深度对染色结果的影响就显现出来。同样是染色8 min,图3是染液没过凝胶约5 mm的结果,图4是染液覆盖凝胶的结果(使用Marker 5 000),可见前者较为清晰。因此,将“染液覆盖凝胶”改为“没过凝胶约5 mm”,即向装有凝胶的普通中号培养皿中倒满染液。此外,将“冷水”改为“冷的蒸馏水”,是由于自来水中的氯会影响染色效果。此外,凝胶厚度不同,染色效果也有所差异,教师可进行预实验并适当调整染色时间。
染色方案2:向盛有凝胶的培养皿中倒入0.002%亚甲基蓝溶液(将2 mL的0.1%亚甲基蓝溶液加入10 mL电泳缓冲液中,再加入88 mL蒸馏水,避光保存),并没过凝胶约5 mm。轻轻晃动培养皿,让染液进入凝胶下表面与培养皿之间。盖上培养皿盖,4℃冷藏过夜。次日观察经过染色处理的凝胶板,看到清晰的蓝色区带后,倒去染液,终止染色。
本方案将染色步骤简化为1步,染色效果仍很好。教师可利用剩余时间讲解观察实验现象的时间和方法,由于亚甲基蓝的染色效果较为稳定,可组织学生利用次日的课余时间观察实验结果。
2.4 细化观察方法 学生观察凝胶板上呈现的DNA蓝色条带时,可先在桌上铺一张白纸,在光下手持盛有凝胶的培养皿距白纸5 cm以上,找到较为清晰的条带。再将凝胶置于平的透明玻璃板上,放在三脚架上面进行观察和手机拍照。在观察的同时,可在实验报告单上绘制草图,标出DNA蓝色条带的数目和位置。
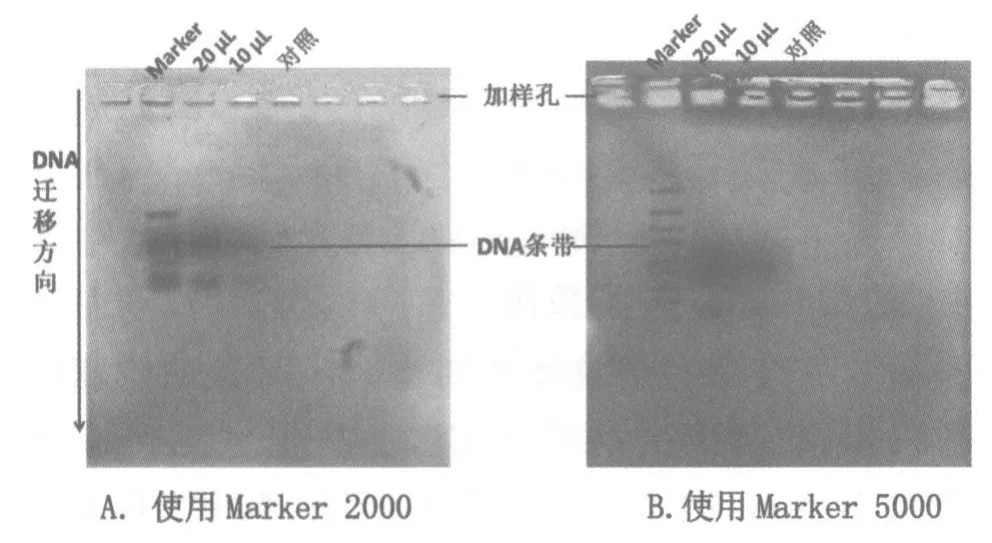
图3 染液没过凝胶5 mm染色结果照片
图4 染液覆盖凝胶染色结果照片
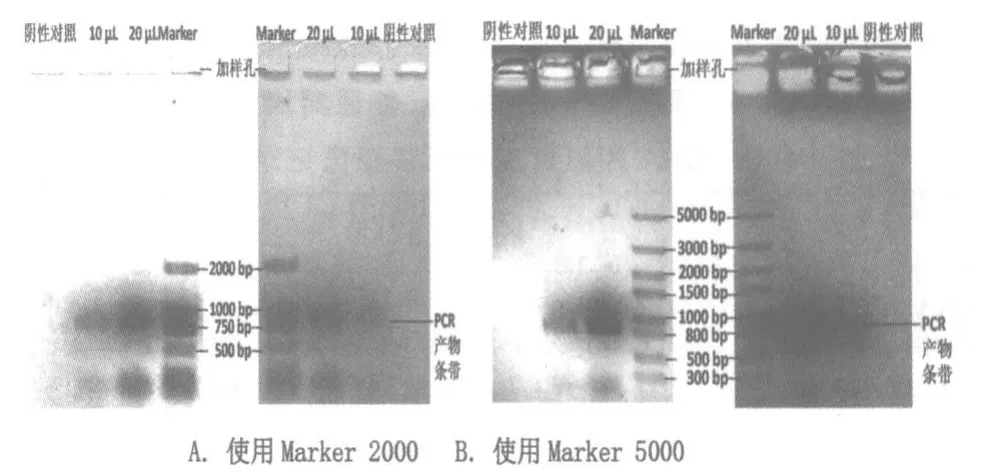
图5 实验结果局部照片及黑白镜像
3 获得理想的实验效果
高中生物学实验强调引导学生体验知识形成的过程,重视学生的科学思维训练,培养严谨和实事求是的科学态度。实践表明,只有实验进展顺利并获得理想的实验效果,才能为学生的科学思维训练提供必要条件。本实验中染色凝胶板上呈现的清晰蓝色条带(如图3和图5),即为DNA所在位置。PCR产物的长度介于800~1 000 bp之间,20 μL的 PCR产物样品混合液的条带比 10 μL的条带深且宽,阴性对照组则无PCR产物条带。
在实验教学活动中,引导学生通过分析实验数据得出结论,是进行科学思维训练的最好方式。但在以往教学过程中,仅提示学生通过对比Marker条带估计PCR产物的大致长度,却忽略了3个问题:①PCR产物条带位于2条Marker条带之间,应该如何科学地估值?②估测PCR产物长度只用到了Marker的1个或2个条带,丢弃了Marker其他条带中所蕴含的宝贵信息,应如何充分地分析实验数据?③DNA片段长度的对数与迁移距离呈负相关,应如何处理与对数相关的实验数据?在学科教研活动中教师普遍认为,这节实验课获得的数据是培养学生理性思维的极好素材。理性思维是基于论证及逻辑推理的思维过程和方式,引导学生解决以上问题的过程就是对学生进行逻辑思维训练的过程,因此笔者在本实验活动中又进行了如下尝试:
1)用直尺测量凝胶电泳后不同DNA片段迁移距离(图6),即凝胶板上每条DNA条带与加样孔之间的距离,记录于表3。

图6 测量DNA条带的迁移距离照片
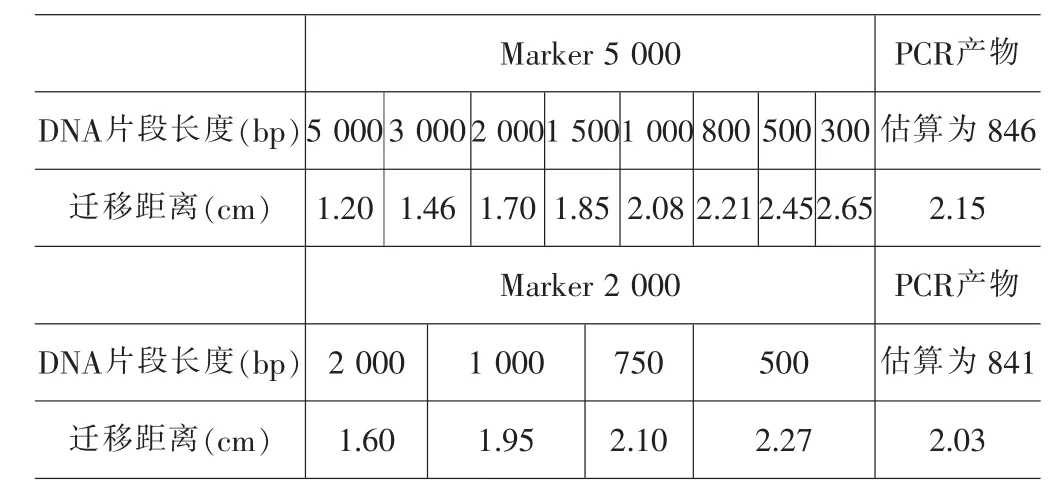
表3 DNA片段长度与迁移距离记录表
2)借助半对数坐标纸分析对数数据。如图7A所示,迁移距离所在的X轴是分度均匀的普通坐标轴;DNA片段长度所在的Y轴是分度不均匀的对数坐标轴,在此轴上某点与0点的实际距离为该点对应数(即DNA片段长度)的对数值,但是在该点标出的值是DNA片段长度原数值。实际应用时,往往根据需要使用半对数坐标纸的一部分,如图7A纵轴的起点就是100而不是0。将Marker 2000清晰的4个条带的数据标到图上,可见所有的点在一条直线上。从而推断“DNA片段长度的对数与迁移距离呈负相关”,绘制趋势线(直线)作为标准曲线。据此标准曲线和PCR产物条带的迁移距离,可推断出PCR产物的大小约为840 bp。本次估值建立在Marker全部条带信息的基础上,更加科学。半对数曲线图的绘制易于教师展开教学;学生也习得了处理对数的简便方法,绘图和分析图表的能力得到了提升;数据的获取和分析更为深入。
3)使用条带更多的Marker 5 000验证上述实验结果的正确性。将Marker 5 000的8个条带的数据标记在半对数坐标纸上,8个点也位于一条直线上,其趋势线与Marker 2 000很接近,且基本平行。根据Marker 5 000实验结果中PCR产物的迁移距离和趋势线,推断PCR产物大小也约为840 bp,从而证明之前实验分析方法和结论的正确性。为了更好地比较2条趋势线,本文中使用Marker 2 000的凝胶实际电泳时间为23.5 min,比另一组短1.5 min,从而避免2条线过于重合导致绘图、分析的困难。在实际教学过程中,教师可利用等待电泳和染色的时间引导学生分析课前准备的已染色凝胶,将学生分为2组,分别分析使用不同Marker的2块凝胶,然后互为验证,学生再运用课上学得的分析方法分析自己的实验结果。
4)运用Excel绘制半对数曲线图精确计算PCR产物大小。如果想获得精确的实验结果,学有余力的学生可以课下尝试用Excel处理数据,或由教师汇总全班数据:将表3中Marker条带的信息输入到Excel中,选择绘制“散点图”,将纵坐标轴设置成 “对数坐标”。添加趋势线时选择 “指数”类型,并显示公式及R2值,从而获得半对数曲线图,如图7B。可见2条直线接近且基本平行,0.99的R2值说明趋势线与数据的拟合度很好,证明了DNA条带的迁移距离与片段长度的对数呈负相关。将PCR产物2次实验的迁移距离分别带入公式,计算出其长度约为846 bp及841 bp,与实际长度841 bp很接近。运用软件分析实验结果是信息技术与现代生物技术的结合,不仅实验结果分析更为精确,也激发了学生的学习兴趣,使学生的理性思维水平得以提高。
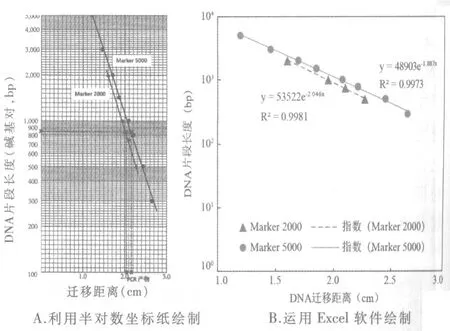
图7 DNA片段长度与迁移距离曲线图
4 达到预期的教学效果
本实验原本是验证性实验,半对数曲线图的引入,使之转变为探究性实验。先通过Marker条带在图上对应的点寻找规律,当推断出“DNA片段长度的对数与迁移距离呈负相关”,绘制标准曲线后,又利用这个规律估测PCR产物大小,解决实际问题。然后,用条带更多的Marker进行平行实验,进一步验证上述实验结果的真实性,最终得出令人信服的实验结论。此外,测量DNA条带的迁移距离时容易产生误差,可采取多次测量、全班汇总等方法减小误差。学有余力的学生可使用Excel汇总数据,绘制半对数曲线图,精确计算PCR产物的大小,通过R2值验证“Marker的DNA条带的迁移距离与片段长度的对数呈负相关”的正确性。由此可见,引导学生用数学模型法分析实验数据,其论证过程严谨,逻辑推理结论可信,从而将发展学生的生物科学素养落到实处。
主要参考文献
[1]The College Entrance Examination Board.AP biology lab manual for students.New York:The College Board,2001:74.
[2]Cavalieri D,Mcgovern P E,Hartl D L,et al.Evidence forS.cerevisiaefermentation in Ancient Wine.Journal of Molecular Evolution,2003,57(1):S226.

