蜜柚叶黄酮的提取及其抗氧化与降尿酸活性研究
郑亚美,任娇艳,史传超
(华南理工大学食品科学与工程学院,广东广州 510640)
蜜柚叶黄酮的提取及其抗氧化与降尿酸活性研究
郑亚美,任娇艳*,史传超
(华南理工大学食品科学与工程学院,广东广州 510640)
研究蜜柚叶总黄酮的提取工艺、抗氧化活性及其对黄嘌呤氧化酶的抑制活性。采用正交实验对蜜柚叶黄酮的提取工艺进行优化,探究蜜柚叶黄酮的最佳提取工艺条件。并通过DPPH自由基、羟自由基及超氧阴离子清除实验探究蜜柚叶黄酮对自由基离子的清除活性;通过黄嘌呤氧化酶活性抑制实验初步判断其降尿酸功效。结果表明:蜜柚叶黄酮的最佳提取条件为料液比1∶30(g/mL)、乙醇浓度80%、浸提时间6 h、浸提温度80 ℃,黄酮得率为12.41 mg/g。蜜柚叶黄酮对DPPH自由基、羟自由基及超氧阴离子均表现出较强的清除活性,IC50值分别为:1.47、1.04、1.49 mg/mL。同时,蜜柚叶黄酮对黄嘌呤氧化酶抑制活性的IC50值为4.8 mg/mL。
蜜柚叶,黄酮,抗氧化,降尿酸活性
人体新陈代谢会产生大量的自由基,由自由基导致的氧化损伤与许多疾病的发生与发展有密切的关系,如动脉粥样硬化、血栓的形成、糖尿病及致癌、促癌及癌的形成过程中均有自由基的产生与参与[1]。因此,易于人体吸收且能清除人体内自由基的天然抗氧化剂-黄酮类化合物已成为现阶段研究的热点。黄酮类化合物是广泛存在于植物皮、根、叶、果实中的一类天然有机化合物,具有广泛的生物活性,如抗氧化、抗肿瘤、抑菌、调节免疫、抗炎、抗过敏、止血镇痛等,已被列为保健食品的一类功能因子[2]。流行病学研究还表明,长期摄入富含黄酮类化合物的食物能显著地降低肿瘤、心脑血管疾病等慢性病的发生机率[3]。
我国柚子栽培面积大,种植历史悠久。目前,人们对柚子的研究主要集中于柚子果皮及果肉的研究,对柚子叶的研究鲜有报道。柚子叶似柑、橘叶,呈椭圆形或长卵圆形,翼叶为心脏型,是典型的单复叶。为探究柚子叶功能性成分,本实验采用正交实验方法优化柚子叶黄酮的提取工艺,并通过DPPH自由基、羟自由基及超氧阴离子清除活性实验探究柚子叶黄酮的抗氧化活性,通过测定柚子叶黄酮对黄嘌呤氧化酶的抑制活性初步评价其降尿酸功效,以期为柚子叶黄酮的综合开发利用提供一定的参考。
1 材料与方法
1.1 材料与仪器
蜜柚采摘之后成熟期蜜柚叶 广东梅州;芦丁 分析纯,国药集团化学试剂有限公司;亚硝酸钠(分析纯)、无水乙醇 广东光华科技股份有限公司;硝酸铝、结晶氯化铝、盐酸 广州化学试剂厂;氢氧化钠 天津启轮化学科技有限公司;氯化硝基四氮唑蓝(NBT),1,1-二苯基-2-三硝基苯肼(DPPH·)、黄嘌呤、黄嘌呤氧化酶 Sigma公司。
RE-52AA型旋转蒸发器 上海亚荣生化仪器厂;UV754N紫外分光光度计 上海仪电分析仪器有限公司;THZ-82A水浴恒温振荡器 常州澳华仪器有限公司;Synergy NEO HTS多功能微孔板检测仪 美国伯腾仪器有限公司。
1.2 实验方法
1.2.1 工艺流程 将洗净的蜜柚叶于太阳下常温晒干后置于80 ℃烘箱烘20 min彻底烘干,将烘干的蜜柚叶去梗、粉碎并过60目筛后装入封口袋中备用。实验过程中,准确称取10.0 g蜜柚叶粉末于一定体积分数的乙醇溶液中,恒温振荡浸提一段时间后用三层纱布过滤,将滤液于4000×g条件下25 ℃高速离心20 min,收集并浓缩(45 ℃恒温旋转蒸发浓缩)滤液至体积为50 mL。设计单因素实验研究料液比、乙醇浓度、浸提时间、浸提温度对蜜柚叶黄酮浸提效果的影响。
1.2.2 单因素实验
1.2.2.1 料液比对蜜柚叶黄酮提取效果(总黄酮得率)的影响 准确称取10.0 g蜜柚叶粉末于锥形瓶,分别按料液比为1∶10、1∶20、1∶30、1∶40、1∶50的比例依次加入80%的乙醇溶液,在70 ℃的摇床中恒温浸提6 h,探索料液比对蜜柚叶黄酮提取效果的影响。
1.2.2.2 浸提时间对蜜柚叶黄酮浸提效果的影响 准确称取10.0 g蜜柚叶粉末于锥形瓶,各加入80%的乙醇溶液60 mL,并置于80 ℃ 的摇床中恒温提取2、4、6、8、10 h,研究浸提时间对蜜柚叶黄酮浸提效果的影响。
1.2.2.3 浸提温度对蜜柚叶黄酮浸提效果的影响 准确称取10.0 g蜜柚叶粉末于锥形瓶,各加入80%的乙醇溶液60 mL,并分别置于40、50、60、70、80 ℃温度下的摇床中恒温浸提6 h,探索温度对蜜柚叶黄酮浸提效果的影响。
1.2.2.4 乙醇体积分数对蜜柚叶黄酮浸提效果的影响 准确称取10.0 g蜜柚叶粉末于锥形瓶,分别加入体积分数为50%、60%、70%、80%、90%的乙醇溶液60 mL,并置于80 ℃的摇床中恒温浸提6 h,研究乙醇体积分数对蜜柚叶黄酮浸提效果的影响。
1.2.3 提取工艺的正交实验优化 在单因素实验基础上,用Design-Expert 8.0设计正交实验,确定柚子叶黄酮提取的最佳工艺条件。实验以料液比、乙醇体积分数、浸提温度及浸提时间作为4个考察因素,选取3个水平,并设计L9(34)正交实验。

表1 蜜柚叶黄酮提取工艺正交实验因素水平表Table 1 Factors and levels table of orthogonal experiment
1.2.4 测定方法
1.2.4.1 总黄酮含量的测定 测定方法参考文献[4]。取6个10 mL试管,向其中加入0、0.6、1.2、1.8、2.4、3 mL浓度为0.2 g/mL的芦丁标准液,然后加去离子水至体积为3 mL,混匀后加入150 μL质量分数为5%的NaNO2溶液,振荡混匀,静置6 min后加入300 μL 质量分数为10%的AlCl3·6H2O溶液,振荡混匀,静置5 min后加入1.0 mL浓度为1 mol/L的NaOH溶液,最后加入550 μL去离子水至反应液总体积为5.0 mL,振荡均匀,并于510 nm波长处测定吸光值。线性回归方程为y=0.0011x-0.0002(R2=0.9999),式中,x为芦丁溶液质量浓度(mg/mL),y为A510 nm。吸取蜜柚叶浸提液10 μL,按标准曲线的步骤测吸光度,并将结果按x=(y+0.0002)/0.0011计算得浸提液中黄酮浓度。
提取得率(mg/g)=测定浓度×稀释倍数×提取液体积/提取所用粉末质量
1.2.4.2 蜜柚叶黄酮抗氧化活性测定 将蜜柚叶浸提液配制成0.5、1.0、1.5、2.0、2.5 mg/mL五个浓度梯度溶液备用。
a. DPPH·的清除活性 测定方法参照文献[5]。用无水乙醇将DPPH·试剂溶解定容,配制成浓度为0.1 mmol/L的DPPH·储备液,置于冰箱中冷藏备用。精密量取蜜柚叶黄酮溶液1 mL及DPPH·醇溶液2 mL混匀,室温下反应30 min后在517 nm处测定吸光度。DPPH·清除率(%)=[1-(As-Ac0)/Ac1]×100,式中As代表样品吸光度,Ac0代表样品溶液空白对照吸光度,Ac1代表DPPH·醇溶液吸光度。
b.对羟自由基清除能力的测定 参照文献[6]采用邻二氮菲法测定羟自由基清除能力。样品管:将1.2 mL浓度为5 mmol/L的邻二氮菲与0.8 mL pH=7.4的PBS充分混匀后,加入1.2 mL一定浓度梯度的蜜柚叶黄酮溶液,混匀之后分别加入1.2 mL浓度为15 mmol/L的EDTA、1.2 mL浓度为15 mmol/L的FeSO4及1.6 mL体积浓度为0.1%的H2O2,37 ℃保温1 h后在536 nm处测定混合溶液的吸光值记为A样品。
损伤管:以1.2 mL的PBS溶液代替样品溶液,其他均与样品管相同,536 nm处测定混合溶液的吸光值记为A损伤。
未损伤管:以1.6 mL的PBS溶液代替H2O2溶液,其他均与样品管相同,536 nm处测定混合溶液的吸光值记为A未损伤。
羟自由基清除率(%)=(A样品-A损伤)/(A未损伤-A损伤)×100
c.对超氧阴离子清除活性的测定 测定方法参照文献[7]。于96孔板微孔中分别加入20 μL 3 mmol/L的黄嘌呤溶液后再加入0.6 mmol/L NBT溶液180 μL,振荡摇匀后加入20 μL蜜柚叶浸提液,摇匀后于37 ℃反应5 min,然后向混合溶液中加入20 μL浓度为0.1 u/mL的黄嘌呤氧化酶溶液,将96孔板于37 ℃恒温保温30 min后于560 nm处测定吸光值,记为Asample。
以磷酸盐缓冲液代替样品溶液作为空白对照,560 nm处测定吸光值,记为Acontrol。
清除率(%)=(Acontrol-Asample)/Acontrol×100
为综合评价蜜柚叶黄酮对自由基离子的清除活性,实验以不同浓度的VC及没食子酸溶液为对照品,并以同样的实验方法测定其对各自由基离子的清除活性。
1.2.4.3 蜜柚叶黄酮对黄嘌呤氧化酶的抑制活性测定 测定方法参照文献[8]。于96孔板中每孔加入50 μL待测样品液及50 μL 浓度为0.005 μ/mL的黄嘌呤氧化酶液(XO),于酶标仪中振荡30 s后,25 ℃保温5 min。然后加入150 μL 浓度为0.4276 mmol/L的黄嘌呤溶液(Xanthine),振荡30 s后,25 ℃保温25 min,在290 nm波长处检测,空白实验以pH=7.4的PBS溶液代替样品液,每个样品扣除颜色实验是以pbs代替黄嘌呤氧化酶溶液。每组样品设置三个平行。以不同浓度的别嘌呤醇做阳性对照。
1.3 数据处理
实验重复三次,实验结果采用平均值±标准差(mean±SD)的形式表示。使用Origin 8.5软件和SPSS 19.0 软件对数据进行单因素方差分析(One-Way ANOVA),并利用 Origin 8.5 软件进行绘图。
2 结果分析
2.1 各单因素对蜜柚叶总黄酮浸提效果的影响
2.1.1 料液比对蜜柚叶总黄酮提取效果的影响 如图1所示,料液比对总黄酮提取效率影响显著,当液料比小于1∶40时,随着液料比的增加,总黄酮得率显著增加,这可能是因为溶剂量的增加提高了柚子叶与溶剂间黄酮类化合物的浓度差,从而减少了柚子叶中黄酮类物质的残留量[9]。当液料比大于1∶40时,增加料液比,总黄酮得率变化不明显,这一结果说明当料液比为1∶40时,柚子叶原料中的总黄酮已基本完全溶出。所以选择料液比为1∶20、1∶30及1∶40为正交实验研究水平。

图1 料液比对蜜柚叶总黄酮得率的影响Fig.1 Effect of ratio of material to solvent on extraction efficiency of flavonoids from Honey pomelo leaves

图2 浸提时间对蜜柚叶总黄酮得率的影响Fig.2 Effect of extraction time on extraction efficiency of flavonoids from Honey pomelo leaves
2.1.2 浸提时间对蜜柚叶黄酮浸提效果的影响 如图2所示,随着浸提时间的增加蜜柚叶总黄酮的提取率呈先增加后基本不变的趋势,这一结果说明,当恒温浸提时间达到6 h左右,柚子叶原料中的黄酮类物质已基本完全溶出,此时蜜柚叶黄酮的提取得率为11.67 mg/g,继续增加浸提时间,黄酮类化合物的得率不再增加[10]。所以选择浸提时间为4、6及8 h为正交实验研究水平。
2.1.3 浸提温度对蜜柚叶黄酮浸提效果的影响 浸提温度对蜜柚叶总黄酮提取效果的影响结果如图3所示,随着浸提温度的增加,总黄酮得率总体呈上升趋势,这是因为温度升高,溶剂粘度减小,浸提液及溶质扩散系数增大,分子运动更加激烈,从而使得有效成分的溶解和渗透速度加快,黄酮的溶出速度随之增大,得率提高[11-12]。但由图可知,当温度高于70 ℃时,总黄酮得率增加不明显,且有下降趋势,这可能是因为温度过高,导致部分黄酮类物质分解的结果[13]。所以选择浸提温度为60、70及80 ℃为正交实验研究水平。

图3 浸提温度对蜜柚叶总黄酮得率的影响Fig.3 Effect of extraction temperature on extraction efficiency of flavonoids from Honey pomelo leaves
2.1.4 乙醇体积分数对蜜柚叶黄酮浸提效果的影响 乙醇体积分数对蜜柚叶总黄酮提取效果的影响结果如图4所示,随着乙醇体积分数的增加,总黄酮得率呈现出显著的先增加后降低的趋势,且在乙醇体积分数为70%左右时,总得率达到最佳。出现这种现象的原因可能是因为黄酮类物质在醇类溶剂中的溶解度大于在水中的溶解度[14]。当浸提体系为乙醇-水体系时,乙醇体积分数越大,黄酮类物质的浸出率就越大[15]。但当乙醇体积分数达到一定值,继续增加乙醇体积分数,其他醇溶性杂质的浸出效率也随之增加,此时,杂质与目标物质的竞争力增大,从而使黄酮类物质的提取率下降[16-17]。所以选择乙醇体积分数为60%、70%及80%为正交实验研究水平。

图4 乙醇体积分数对蜜柚叶总黄酮得率的影响Fig.4 Effect of ethanol concentration on extraction efficiency of flavonoids from Honey pomelo leaves
2.1.5 正交实验探究 根据单因素实验结果,选取料液比(A)、浸提时间(B)、浸提温度(C)、乙醇体积分数(D)四个因素按照L9(34)正交表对蜜柚叶黄酮提取工艺进行优化。实验结果如表2所示。

表2 正交实验设计及结果Table 2 Orthogonal array design and results
由正交实验结果可知,四个实验因素对蜜柚叶总黄酮提取得率的影响依次为:浸提温度(C)>乙醇体积分数(D)>浸提时间(B)>料液比(A)。蜜柚叶黄酮提取最佳工艺条件为:A2B2C3D3,即料液比为 1∶30、浸提时间 6 h、浸提温度80 ℃、乙醇体积分数 80%。在以上优化后工艺条件下进行验证实验,蜜柚叶黄酮得率为12.41 mg/g。
2.2 蜜柚叶黄酮的抗氧化活性及其对黄嘌呤氧化酶的抑制活性
2.2.1 蜜柚叶黄酮对DPPH·、羟自由基及超氧阴离子的清除活性 DPPH·是一种很稳定的以氮为中心的自由基,其分子中3个苯环的共振稳定作用及空间障碍使位于分子中间的氮原子上不成对的电子不能发挥其应有的电子成对作用,从而能够捕获(清除)其他自由基[18]。DPPH·的清除反应是一类基于电子转移的反应。图5表示蜜柚叶黄酮对DPPH·的清除活性,VC、没食子酸及蜜柚叶黄酮对DPPH·的清除活性均随浓度的增加而升高。其中,在相同浓度下,VC对DPPH自由基的清除活性均高于没食子酸,当蜜柚叶黄酮浓度为2.5 mg/mL时,其对DPPH自由基的清除率为57%。VC、没食子酸及蜜柚叶黄酮对DPPH·清除活性的IC50值分别为47.94 μg/mL、77.71 μg/mL、1.47 mg/mL。

图5 蜜柚叶黄酮对DPPH·的清除作用Fig.5 DPPH· radical scavenging activities of flavonoids from Honey pomelo leaves
羟自由基是人体内最活泼的自由基,它能够杀死红细胞,使DNA、多糖及细胞膜等物质降解,但当加入自由基清除剂以后,由它所致的有害效应会明显降低[19]。蜜柚叶黄酮对·OH的清除活性结果如图6所示,VC、没食子酸及蜜柚叶黄酮对·OH的清除活性均呈一定的计量效应关系,浓度越高,对·OH的清除活性越强。当蜜柚叶黄酮的浓度为2.5 mg/mL时,其对·OH的清除率为97%。VC、没食子酸及蜜柚叶黄酮对·OH清除活性的IC50值分别为0.36、0.54、1.04 mg/mL。
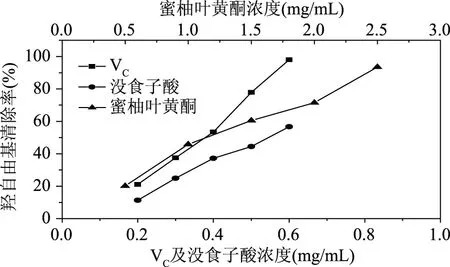
图6 蜜柚叶黄酮对羟自由基的清除作用Fig.6 ·OH radical scavenging activities of flavonoids from Honey pomelo leaves
超氧阴离子与人体内-OH结合后的产物会导致细胞DNA的损伤,从而破坏人体机能[20]。蜜柚叶黄酮对超氧阴离子的清除活性结果如图7所示,相同浓度下,没食子酸对超氧阴离子的清除活性高于VC。当没食子酸浓度为0.8 mg/mL时其对超氧阴离子的清除率达到99%。当VC浓度为1.0 mg/mL时对超氧阴离子的清除率达到97%。蜜柚叶黄酮对超氧阴离子的清除活性随浓度的增加而增强,当蜜柚叶黄酮浓度为2.5 mg/mL时其对超氧阴离子的清除活性为79%。没食子酸、VC及蜜柚叶黄酮对超氧阴离子清除活性的IC50值分别为:0.43、0.57、1.49 mg/mL。

图7 蜜柚黄酮对超氧阴离子的清除活性flavonoids from Honey pomelo leaves
2.2.2 蜜柚叶黄酮对黄嘌呤氧化酶的抑制活性 蜜柚叶黄酮对黄嘌呤氧化酶的抑制活性结果如图7所示,总体上,蜜柚叶黄酮对黄嘌呤氧化酶的抑制活性与别嘌呤醇抑制黄嘌呤氧化酶活性趋势一致,均呈一定的剂量效应关系,即随着浓度的增加,抑制活性增强。别嘌呤醇及蜜柚叶黄酮对黄嘌呤氧化酶抑制活性的IC50值分别为8.7 μg/mL、4.8 mg/mL。张雪等[21]研究了大血藤、锁阳、吴茱萸、木瓜、老鹤草五种中草药水提及醇提物对黄嘌呤氧化酶的抑制作用,除老鹤草水提及醇提物对黄嘌呤氧化酶抑制活性的IC50值小于4.8 mg/mL以外,其余4种中草药的水提及醇提物抑制黄嘌呤氧化酶的IC50值均大于4.8 mg/mL,说明蜜柚叶黄酮对黄嘌呤氧化酶的抑制活性较一般中草药都要强。

图8 蜜柚黄酮对黄嘌呤氧化酶的抑制活性Fig.8 Effect of xanthine oxidase activity of flavonoids from sweet pomelo leaves
3 结论
通过工艺优化,确定提取蜜柚叶黄酮的最佳工艺条件为:料液比为 1∶30、浸提时间 6 h、浸提温度80 ℃、乙醇体积分数80%。此条件下,黄酮得率可以达到12.41 mg/g。同时蜜柚叶黄酮对DPPH自由基、羟自由基及超氧阴离子清除活性的IC50值分别为1.47、1.04、1.49 mg/mL。与大血藤、锁阳、吴茱萸、木瓜等中草药相比,蜜柚叶黄酮表现出较强的黄嘌呤氧化酶抑制活性。蜜柚叶黄酮的分离纯化、结构鉴定及对黄嘌呤氧化酶抑制机理还有待进一步研究,本实验首次研究蜜柚叶黄酮的抗氧化活性及其对黄嘌呤氧化酶的抑制活性,旨在为蜜柚叶的综合开发利用提供一定的理论依据。
[1]李富华,刘冬,明建. 苦荞麸皮黄酮抗氧化及抗肿瘤活性[J]. 食品科学,2014,35(7):58-63.
[2]张德权,台建祥. 生物类黄酮的研究及应用概况[J]. 食品与发酵工业,1999(6):52-57.
[3]Kong S,Lee J. Antioxidants in milling fractions of black rice cultivars[J]. Food chemistry,2010,120(1):278-281.
[4]Dewanto V,Wu X,Adom K K,et al. Thermal processing enhances the nutritional value of tomatoes by increasing total antioxidant activity[J]. Journal of agricultural and food chemistry,2002,50(10):3010-3014.
[5]周桂芬,吕圭源. 铁皮石斛不同部位黄酮碳苷类成分及清除 DPPH 自由基能力比较研究[J]. 中国中药杂志,2012 (11):1536-1540.
[6]张强,辛秀兰,杨富民,等. 红树莓果醋酿造过程中抗氧化性能的变化[J]. 食品科学,2016,37(3):6-11.
[7]Ren J,Zhao M,Shi J,et al. Purification and identification of antioxidant peptides from grass carp muscle hydrolysates by consecutive chromatography and electrospray ionization-mass spectrometry[J]. Food Chemistry,2008,108(2):727-736.
[8]王晓. 核桃壳中黄嘌呤氧化酶抑制活性物质的分离鉴定及构效关系的研究[D]. 华南理工大学,2015.
[9]许晖,孙兰萍,张斌,等. 花生壳总黄酮乙醇提取工艺研究[J]. 食品工业科技,2007,28(8):135-139.
[10]Chen L,Ding L,Yu A,et al. Continuous determination of total flavonoids in Platycladus orientalis(L.)Franco by dynamic microwave-assisted extraction coupled with on-line derivatization and ultraviolet-visible detection[J]. Analytica chimica acta,2007,596(1):164-170.
[11]唐津忠,鲁晓翔,陈瑞芳. 金莲花中黄酮类化合物的提取及其抗氧化性研究[J]. 食品科学,2003,24(6):88-91.
[12]范菁华,徐怀德,李钰金,等. 超声波辅助提取花椒叶总黄酮及其体外抗氧化性研究[J]. 中国食品学报,2010(6):22-28.
[13]蒋琼凤,温拥军,袁志辉. 半边莲总黄酮提取工艺及抑菌活性的研究[J]. 天然产物研究与开发,2015(27):865-869.
[14]郑晓涛. 菊芋叶总黄酮含量变化及其提取,纯化,抗氧化性研究[D]. 南京:南京农业大学,2012.
[15]武兴菲. 肉桂总黄酮提取分离分析及抗氧化活性探讨[J]. 医药卫生,2015(11):37-41.
[16]阳梅芳. 柚子黄酮类物质提取,分离及生物特性研究[D]. 广州:华南理工大学,2013.
[17]李全国. 乐陵枣叶总黄酮的提取,分离纯化,鉴定及其抗氧化活性研究[D]. 齐鲁工业大学,2014.
[18]Huang D,Ou B,Prior R L. The chemistry behind antioxidant capacity assays[J]. Journal of agricultural and food chemistry,2005,53(6):1841-1856.
[19]蔡仲军,陈仕江,尹定华,等. 不同产地冬虫夏草清除羟自由基作用的研究[J]. 中草药,2004,35(1):57-59.
[20]赵静,李玉琴,王芳乔,等. 6 种黄酮类化合物清除超氧阴离子自由基能力及其构效关系[J]. 中国医药导报,2014,11(29):7-10.
[21]张雪,周英,管静,等. 5 种中药材提取物对黄嘌呤氧化酶的抑制作用[J]. 山地农业生物学报,2015(4):51-54.
Extraction of flavonoids fromHoneypomeloleaves and study on its antioxidant and uric acid reduction activities
ZHENG Ya-mei,REN Jiao-yan*,SHI Chuan-chao
(School of Food Science and Engineering,South China University of Technology,Guangzhou 510640,China)
In order to investigate the extraction processes of flavonoids fromHoneypomeloleaves and its antioxidant and uric acid reduction activities,the extraction conditions of flavonoids were optimized primarily by orthogonal array design. In addition,the DPPH·,hydroxyl free radical and superoxide anion free radical scavenging activities were determined to evaluate the antioxidant activity of the flavonoids and the inhibition of xanthine oxidase activity was determined to preliminary judging its uric acid reduction activity. Results indicated that optimal extraction processing parameters were the ratio of material to solvent of 1∶30(g/mL),ethanol concentration of 80%,extraction temperature of 80 ℃,extraction time of 6 h,the extraction efficiency of flavonoids fromHoneypomeloleaves was 12.41 mg/g. Meanwhile,in DPPH radical,hydroxyl radical and superoxide anion scavenging assays,the IC50of the scavenging activities of flavonoids fromHoneypomeloleaves were 1.47,1.04 mg/mL and 1.49 mg/mL. The inhibition of xanthine oxidase assay illustrated that the flavonoids showed a certain degree of suppression effect of xanthine oxidase(IC50:4.8 mg/mL).
Honeypomeloleaves;flavonoids;antioxidant activity;uric acid reduction activity
2016-10-04
郑亚美 (1991-),女,硕士研究生,研究方向:食品生物化学、食品营养与健康,E-mail:zheng386007@163.com。
*通讯作者:任娇艳(1980-),女,教授,研究方向:食品生物化学、食品营养与健康,E-mail:jyren@scut.edu.cn。
广东省自然科学杰出青年基金项目(S2013050013954);“广东特支计划”科技青年拔尖人才项目(2014TQ01N645);2016年广东省攀登计划项目(pdjh2016b0049)。
TS201.1
B
1002-0306(2017)08-0262-06
10.13386/j.issn1002-0306.2017.08.042

