海洛因成瘾者复吸相关低频振幅特征的静息态fMRI研究
李林斌,李哲,陈佳杰,刘洁蓉,魏璇,李玮,王玮,李强*
海洛因成瘾者复吸相关低频振幅特征的静息态fMRI研究
李林斌1,李哲2,陈佳杰2,刘洁蓉2,魏璇2,李玮2,王玮2,李强2*
目的探讨海洛因成瘾者复吸相关的静息态脑功能特征。材料与方法31例海洛因成瘾者参加本前瞻性纵向静息态功能磁共振研究,随访6个月后确定复吸组与非复吸组,分析两组大脑低频振幅差异,且分析差异区低频振幅值与复吸行为的相关性。结果与非复吸组相比,复吸组低频振幅值升高的脑区为右侧前扣带回、眶额回及颞中回,降低的脑区为左侧海马旁回、右侧后扣带回、双侧梭状回及左侧顶下小叶。结论海洛因成瘾复吸者与非复吸者大脑神经活动存在明显差异,控制功能的下降及学习记忆功能的异常增加与复吸行为密切相关,这些异常功能特征对海洛因成瘾者复吸风险具有一定的预测价值。
海洛因成瘾;复吸;静息态;磁共振成像
李林斌, 李哲, 陈佳杰, 等. 海洛因成瘾者复吸相关低频振幅特征的静息态fMRI研究. 磁共振成像, 2017, 8(1): 22-25.
海洛因成瘾是我国以及全世界亟待解决的重大的社会及医学问题。美沙酮维持治疗是国际公认的对海洛因成瘾治疗有效果的方法,在帮助海洛因成瘾患者戒除毒品中发挥着重要的作用。但美沙酮维持治疗过程中仍存在较高的复吸率。如何防止复吸是目前海洛因成瘾治疗所面临的重大挑战和迫切需要解决的问题。复吸的机制目前仍不是很清楚,本研究拟采用静息态磁共振成像中的低频振幅(amplitude of low frequency fluctuation,ALFF)的方法,评价复吸相关的大脑神经活动特征,以期为进一步有针对性地指导成瘾治疗,降低复吸率提供理论依据。
1 材料与方法
1.1 选择受试者
招募西安灞桥区美沙酮门诊的31例稳定治疗的海洛因成瘾患者,纳入标准:(1)符合DSM-V标准,除尼古丁外无其他成瘾行为;(2)美沙酮维持治疗至少6个月,稳定治疗药量至少1个月;(3)右利手,汉族;(4)年龄为30~45岁。排除标准:(1)目前或曾经严重的精神疾病或神经系统疾病;(2)曾有头颅外伤史;(3)曾有心血管病或内分泌病史;(4)目前有临床疾病或正在使用药物;(5)磁共振禁忌证。
本研究方案经过唐都医院伦理委员会审查并批准。每个被试均被告知研究内容且填写知情同意书。
1.2 数据采集
采用GE MRI 3.0 T Signa扫描设备。在正式实验扫描前,为了让受试者熟悉扫描环境,进行“模拟扫描”,持续1 min。正式扫描时,受试者被动注视黑色背景中心白色十字,不想特别的事情,头部保持不动。功能影像采集用梯度平面回波序列(GRE-EPI),扫描参数:重复时间2000 ms,回波时间30 ms,视野256 mm×256 mm,矩阵64×64,层数32,层厚4 mm,层间距0 mm,反转角90°,空间分辨率4 mm×4 mm×4 mm。结构像采集用3D FSPGR T1WI序列,扫描参数:重复时间7.8 ms,回波时间3.0 ms,视野256 mm× 256 mm,矩阵256×256,层数166,层厚1 mm,层间距0 mm。空间分辨率1 mm×1 mm×1 mm。影像数据由经验丰富的放射科主治医师进行读片,以确保参与者中不存在脑内器质性病变。
1.3 复吸行为判断标准
对所有参与者在影像数据采集后进行6个月随访。每次随访前3 d通知被试。每次随访进行尿检和对海洛因使用情况进行评估。笔者认为,任何海洛因的吸食和(或)使用其他物质量的增加(如酒精)的都被认为是复吸行为。确认复吸的条件:在6个月的随访期间的任何时间:(1)海洛因尿检阳性和(或)自我报告使用过海洛因;(2)自报使用其他物质与基线水平进行比较增加50%以上。
1.4 数据处理
运用DPABI软件对静息态功能磁共振数据进行预处理。包括时间校正、头动矫正,标准化,空间平滑(8 mm高斯平滑核)。进而进行ALFF计算,并对其进行低频滤波(0.01~0.08 Hz)。
1.5 统计分析
使用SPSS软件对两组人口学数据统计分析。使用DPABI软件对ALFF激活图进行两样本t检验分析,统计阈值设为P<0.05,Alphasim校正。以差异区峰值坐标为球体中心,6 mm半径为感兴趣区,提取复吸组脑区ALFF值,并与复吸次数作相关分析。
2 结果
2.1 人口学特征
根据复吸评价依据,16名海洛因成瘾者复吸,均表现为复吸海洛因,而非其他物质(酒精)使用增加,复吸次数为(4.8±2.9)次,海洛因使用剂量为(1.2±1.1) g,其余15名海洛因成瘾未复吸,两组在吸烟情况、受教育程度、年龄、美沙酮食用情况和海洛因食用情况等方面均没有显著统计学差异(表1)。
2.2 fMRI结果
与非复吸组相比,复吸组右侧前扣带回、眶额回及颞中回的ALFF值减低,而左侧海马旁回、右侧后扣带回、双侧梭状回及左侧顶下小叶的ALFF值增高(P<0.01,AlphaSim校正,t=2.7633,cluster>16)(图1)。
2.3 相关分析
差异区ALFF值与复吸次数的相关分析无法满足多重比较校正。
3 讨论
本研究首次对海洛因成瘾者复吸相关的静息态脑功能特征进行研究,结果显示,与非复吸者比复吸者在静息状态下,ALFF值显著性降低的脑区包括右侧前扣带、眶额回、颞中回;ALFF值显著性升高的脑区包括左侧海马旁回、右侧后扣带回、双侧梭状回及左侧顶下小叶。该结果表明海洛因成瘾者的复吸行为与抑制性控制,对毒品的记忆,视觉空间注意力等功能异常密切相关。
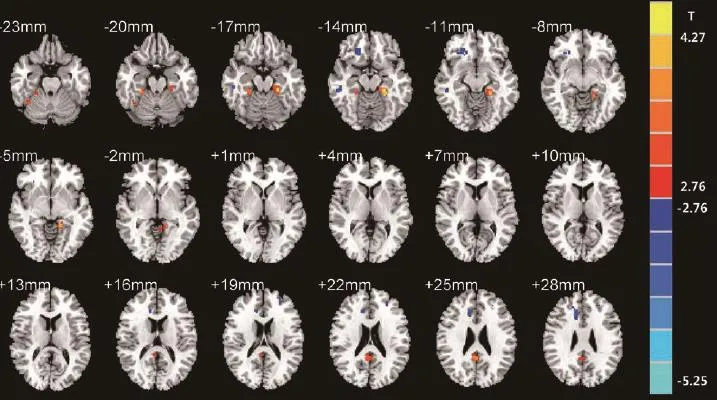
图1 与非复吸组相比,复吸组ALFF值明显降低的脑区(蓝色):右侧前扣带回、眶额回及颞中回;ALFF值明显升高的脑区(红色):左侧海马旁回、右侧后扣带回、双侧梭状回及左侧顶下小叶(P<0.01,AlphaSim校正)Fig. 1 Compared with non relapser group, the relapser group demonstrated lower ALFF value (blue color) in right anterior cingulate cortex, orbitofrontal gyrus and middle temporal gyrus and greater ALFF value (red color) in left hippocampus, right posterior cingulate cortex, bilateral fusiform and left inferior parietal lobule (P<0.01, corrected for AlphaSim).
前扣带回皮层在基于奖赏的行为决策过程和认知控制过程中发挥重要作用[1], 同 时 参与觅药行为[2]。内侧前额叶皮层同样 参 与 行 为 决 策 , 并参与情感信息处理和目标导向行为计划的制定过程[3]。眶额回皮层在动机/驱动环路中发挥作用[4],同时也参与毒品突显性反应、抑制性控制、情感调节等过程[5]。Goldstein等[6]曾利用Stroop任务研究发现,可卡因依赖者在毒品相关线索条件下执行认知控制任务时,前扣带回皮层和内侧眶额回皮层呈明显负激活,其激活程度与行为学任务的正确率呈反比关系。海洛因成瘾者尽管经过美沙酮维持治疗,复吸者在静息状态下认知控制相关脑区的功能组织模式仍存在异常,可能与海洛因成瘾者难以戒断吸毒有关。Lyoo等发现颞叶皮层在海洛因成瘾中起着重要的作用,药物成瘾者颞叶灰质的密度是大幅度降低的[7]。有研究人员发现,海洛因成瘾者与健康被试比较,表现为海洛因相关的前额叶、颞叶等区域的灰质体积减小,而且海洛因使用的时间与其灰质体积呈负相关关系。说明药物成瘾者颞叶功能的异常与其灰质结构的损伤密切相关,海洛因复吸者颞叶ALFF值的减低与其复吸程度有一定的联系,不同程度地反映了功能异常的颞叶对海洛因复吸行为的作用。
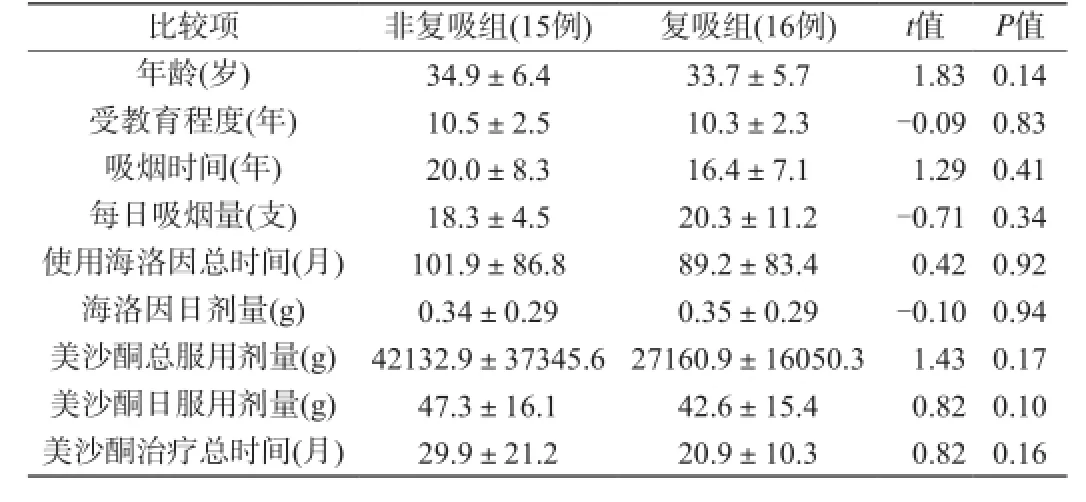
表1 海洛因成瘾者人口学资料比较(x±s)Tab. 1 Comparison of demographic data of heroin addicts (x±s)
海洛因相关线索实验表明海马旁回活动异常的增加反映了对于感觉性刺激、情感、记忆处理过程异常活跃[8-9];扣带回和背外侧1前额叶皮层对海洛因相关线索的活动增加反映了异常的认知控制处理过程[10]。结合本研究结果表明,海洛因成瘾者即使经过长期美沙酮维持治疗后,其毒品的突显性仍然明显较高,同时抑制性控制能力被削弱,机动驱动回路和记忆回路的明显激活,长此以往将形成一种正反馈回路,最终导致海洛因成瘾者不顾任何后果的强迫性觅药、复吸,难以戒断。
梭状回及顶下小叶与视觉空间注意力有关[11-12]。前期研究发现,海洛因成瘾者在海洛因线索比中性线索条件下上述脑区明显激活[13],本研究结果中复吸者上述脑区活动异常增高,提示其视觉空间注意力异常的程度比非复吸者更大。
本研究还存在一些局限性值得注意:两组的样本少,在后续的研究中需增加被试数;在本研究中尚不能确定激活脑区之间的功能联系,需在后续研究中尝试采用因果分析方法确定信息流的方向与大小。
本研究首次对海洛因成瘾者复吸相关的静息态脑功能特征进行研究,结果提示海洛因成瘾复吸者与非复吸者之间多个脑区静息态脑功能存在差异,表明海洛因成瘾者控制功能减弱以及学习记忆功能异常增加与复吸行为密切相关。
[References]
[1]Crowther A, Smoski MJ, Minkel J, et al. Resting-state connectivity predictors of response to psychotherapy in major depressive disorder. Neuropsychopharmacology, 2015, 40(7): 1659-1673.
[2]Kalivas PW, Volkow ND. The neural basis of addiction: a pathology of motivation and choice. Am J Psychiatry, 2005, 162(8): 1403-1413.
[3]Zhao LY, Tian J, Wang W, et al. The role of dorsal anterior cingulate cortex in the regulation of craving by reappraisal in smokers. PloS One, 2012, 7(8): e43598.
[4]Hu Y, Salmeron BJ, Gu H, et al. Impaired functional connectivity within and between frontostriatal circuits and its association with compulsive drug use and trait impulsivity in cocaine addiction. JAMA Psychiatry, 2015, 72(6): 584-592.
[5]Walter M, Denier N, Gerber H, et al. Orbitofrontal response to drugrelated stimuli after heroin administration. Addiction biology, 2015, 20(3): 570-579.
[6]Goldstein RZ, Tomasi D, Rajaram S, et al. Role of the anterior cingulate and medial orbitofrontal cortex in processing drug cues in cocaine addiction. Neuroscience, 2007, 144(4): 1153-1159.
[7]Volkow ND, Fowler JS, Wang GJ, et al. Dopamine in drug abuse and addiction: results from imaging studies and treatment implications. Molecular psychiatry, 2004, 9(6): 557-569.
[8]Adinoff B, Gu H, Merrick C, et al. Basal hippocampal activity and its functional connectivity predicts cocaine relapse. Biol Psychiatry, 2015, 78(7): 496-504.
[9]Delgado MR, Dickerson KC. Reward-related learning via multiple memory systems. Biol Psychiatry, 2012, 72(2): 134-141.
[10]Wang W, Li Q, Wang Y, et al. Brain fMRI and craving response to heroin-related cues in patients on methadone maintenance treatment. Am J Drug Alcohol Abuse, 2011, 37(2): 123-130.
[11]Schmidt A, Walter M, Gerber H, et al. Normalizing effect of heroin maintenance treatment on stress-induced brain connectivity. Brain, 2015, 138(Pt 1): 217-228.
[12] Zhang W, Li H, Pan X. Positive and negative affective processing exhibit dissociable functional hubs during the viewing of affective pictures. Hum Brain Mapp, 2015, 36(2): 415-426.
[13] Li Q, Li W, Wang H, et al. Predicting subsequent relapse by drugrelated cue-induced brain activation in heroin addiction: an eventrelated functional magnetic resonance imaging study. Addiction biology, 2015, 20(5): 968-978.
Abnormal amplitude of low-frequency fluctuation associated with relapse behavior in heroin addict: a resting-state functional magnetic resonance image study
LI Lin-bin1, LI Zhe2, CHEN Jia-jie2, LIU Jie-rong2, WEI Xu-an2, LI Wei2, WANG Wei2, LI Qiang2*1Company 11, Battalion 3, The First Brigade of Cadets, Fourth Military Medical University, Xi’an, Shaanxi Province, Xi'an 710038, China
2Department of Radiology, Tangdu Hospital, Fourth Military Medical University, Xi'an, Shaanxi Province, Xi'an 710038, China
*
Li Q, E-mail: tdqiangqiang@foxmail.com
Received 10 Nov 2016, Accepted 9 Dec 2016
ACKNOWLEDGMENTSThis work was supported by grants from the National Natural Science Foundation of China (NO. 81671661, 81371532).
Objective:To investigate the characteristics of the relapse related brain function of heroin addicts during the resting state.Materials and Methods:Thirty-one heroin addicts were included in a prospective longitudinal study of resting state functional magnetic resonance imaging. The relapse group and non relapse group were determined after six month-follow-up, and the differences in amplitude of low-frequency fluctuation (ALFF) value between two groups were analyzed. Then the relationship between ALFF value of differential regions and relapse behavior was analyzed.Results:Compared with non relapse group, the relapse group demonstrated significantly greater ALFF value in the right anterior cingulate gyrus, orbitofrontal gyrus and temporal gyrus, demonstrated lower ALFF value in the left parahippocampal gyrus, right posterior cingulate gyrus, bilateral fusiform gyrus and left inferior parietal lobule. No significantly relationship between the ALFF value of differential brain regions and relapse behavior was found.Conclusions:The relapses and non-relapses vary significantly in the brain function, the decline of control function and the abnormal increase of learning and memory function are closely related with relapse behavior. These abnormal functional characteristics have a certain predictive value for the relapse risk of heroin addicts.
Heroin addiction; Relapse; Resting state; Magnetic resonance imaging
国家自然科学基金(编号:81671661、81371532)
1. 第四军医大学学员旅三营十一连,西安 710038
李强,E-mail:tdqiangqiang@foxmail. com
2016-11-10
R445.2;R322.81
A
10.12015/issn.1674-8034.2017.01.006
2. 第四军医大学唐都医院放射诊断科,西安 710038
接受日期:2016-12-09

